Что такое нуклеиновый обмен
Что такое нуклеиновый обмен
О значении нуклеопротеидов и нуклеиновых кислот было указано выше (см. Химия нуклеопротеидов) Помимо их главной роли в хранении и реализации наследственной информации, следует указать на важную регуляторную функцию адениловой системы и свободных нуклеотидов, контролирующих в качестве коферментов скорость метаболических процессов. С другой стороны, нет никаких экспериментальных доказательств, что нуклеиновые кислоты являются незаменимыми пищевыми факторами и вряд ли играют существенную роль в качестве энергетического материала. Поскольку структурными мономерными компонентами нуклеиновых кислот являются мононуклеотиды, состоящие в свою очередь из азотистых оснований, пентоз и фосфорной кислоты, естественно, будут рассмотрены (помимо краткого изложения вопросов переваривания и всасывания нуклеиновых кислот) проблемы метаболизма этих индивидуальных блоков нуклеиновых кислот, как и самих макромолекул. В частности, будут детально изложены пути биосинтеза и распада пуриновых и пиримидиновых нуклеотидов, современные представления о механизмах синтеза и деградации ДНК и РНК в живых организмах, а также участие нуклеиновых кислот в биосинтезе белка.
В первом приближении обмен нуклеиновых кислот можно представить в следующем общем виде (по Кантарову и Шепартцу):
Всасываются преимущественно нуклеозиды, и в таком виде часть азотистых оснований может быть использована для синтеза нуклеиновых кислот организма. Если же происходит дальнейший распад нуклеозидов до свободных пуриновых и пиримидиновых оснований, то гуанин не используется для синтетических целей. Что касается других оснований, то, как показывают опыты с меченным по азоту аденином и урацилом, в тканях они могут включаться в состав нуклеиновых кислот. Однако экспериментальные данные свидетельствуют о том, что биосинтез азотистых оснований, входящих в состав нуклеиновых кислот органов и тканей, протекает преимущественно, если не целиком, de novo из низкомолекулярных азотистых и безазотистых предшественников.
ОБМЕН И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ
Дата добавления: 2015-11-06
Размер файла: 116.86 KB
Работу скачали: 22 чел.
Поделитесь работой в социальных сетях
Если эта работа Вам не подошла внизу страницы есть список похожих работ. Так же Вы можете воспользоваться кнопкой поиск
ОБМЕН И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты высокомолекулярные полимерные соединения, мономером которых являются мононуклеотиды.
Мононуклеотиды включают в свой состав три вещества: азотистое основание, углевод (рибоза или дезоксирибоза), фосфорную кислоту. Различают 2 вида азотистых оснований: пуриновые (производные пурина) и пиримидиновые (производные пиримидина).
Рибонуклеиновые кислоты (РНК)
Все виды РНК состоят из одной полинуклеотидной цепи. Азотистые основания в РНК представлены аденином, гуанином, урацилом, цитозином. Углевод представлен рибозой. Различают несколько видов РНК.
Транспортные РНК (тРНК ) осуществляют транспорт аминокислот на рибосомы, к месту синтеза белка. Молекулярная масса тРНК составляет около 30 000 дальтон. Полинуклеотидная цепь тРНК включает в свой состав 70-80 нуклеотидов. На долю тРНК приходится около 15% всего запаса РНК клетки. В тРНК содержится большое количество минорных нуклеотидов. Между комплементарными нуклеотидами участков тРНК возникают водородные связи, и формируется её вторичная структура в виде трилистника (форма «клеверного листа»). В составе тРНК выделяют 2 важных функциональных участка. На средней петле располагается антикодон, комплементарный кодонам иРНК, на открытом конце акцепторный участок, к которому присоединяется аминокислота. Для переноса каждой аминокислоты в клетках имеется «своя» тРНК.
тРНК имеет 3-ю структуру, которая представляет собой компактное наложение петель друг на друга.
Различают изоакацепторные тРНК, которые переносят одну и ту же аминокислоту, но отличаются одним нуклеотидом в антикодоне.
Вторичная структура наиболее распространённой В формы ДНК представляет собой правозакрученную двойную спираль, в одном витке которой уложено 10 пар нуклеотидов. Шаг спирали равен 3,4 нм. В фагах присутствует Z форма (зигзагообразная) и кольцевая форма ДНК.
Для ДНК характерна более компактная укладка в виде суперспирали. ДНК формирует надмолекулярную структуру, объединяясь с ядерными белками и формируя полинуклеосомы.
ДНК образует вязкие растворы с двойным лучепреломлением, поглощающие УФЛ в интервале 260-280 нм. Под действием концентрированных растворов кислот, мочевины, физических факторов возможна денатурация ДНК, при которой происходит разрыв водородных связей и расхождение цепей молекулы ДНК. Денатурация может носить обратимый характер и переходить в реактивацию восстановление водородных связей и структуры ДНК после удаления денатурирующего фактора. При ренативации возможно явление гибридизации объединение комплементарных молекул ДНК из разных организмов. Возможна гибридизация нитей ДНК с РНК.
Обмен нуклеиновых кислот.
Переваривание нуклеиновых кислот
Распад нуклеиновых кислот в тканях
Распад нуклеиновых кислот в тканях идентичен процессу их переваривания. Углеводы и фосфорная кислота используются стандартно, а азотистые основания подвергаются распаду до конечных продуктов: мочевой кислоты (пуриновые основания) и мочевины (пиримидиновые основания).
Распад пуриновых нуклеотидов
Распад пуриновых оснований происходит путём их гидролитического дезаминирования без разрыва пуринового кольца с образованием мочевой кислоты.
Распад пуриновых оснований происходит не в свободном виде, а в составе нуклеозидов.
Для уменьшения гиперурекемии используют препараты аналоги пуриновых оснований (например, аллопуринол), которые угнетают фермент ксантиноксидазу и блокируют образование мочевой кислоты.
Распад пиримидиновых нуклеотидов
Распад пиримидиновых оснований происходит путём их гидролитического дезаминирования с разрывом кольца и образования мочевины.
Синтез пуриновых нуклеотидов
Возможны 2 способа синтеза пуриновых нуклеотидов в тканях: основной путь (синтез из простых предшественников) и дополнительный путь (синтез из готовых азотистых оснований).
Основной путь синтеза пуриновых нуклеотидов
Особенностью синтеза пуриновых нуклеотидов является образование трехкомпонентного нуклеотида с первых стадий синтеза.
Источники атомов углерода и азота в пуриновом кольце:
1-из аспарагиновой кислоты
8- из метенил ТГФК
Авторегуляция синтеза пуриновых нуклеотидов
Регуляторными ферментами синтеза пуриновых нуклеотидов являются фосфорибозилкиназа и амидотрансфераза Активность этих ферментов по аллостерическому механизму подавляются высокими концентрациями пуриновых нуклеотидов. На конечных стадиях синтеза ГТФ активирует синтез адениловых нуклеотидов, а АТФ гуаниловых нуклеотидов.
Дополнительный путь синтеза пуриновых нуклеотидов
Возможен синтез пуриновых нуклеотидов из готовых пуриновых оснований и активной формы рибозы.
Аналогично протекает синтез ГМФ. При врождённом дефекте гипоксантин-гуанинфосфорибозилтрансферазы развивается заболевание Леш Нихана, при котором наблюдается гиперурикемия, нарушение психики.
Синтез пиримидиновых нуклеотидов
Основной путь синтеза пиримидиновых нуклеотидов происходит из исходных простых веществ. Особенностью синтеза пиримидиновых нуклеотидов является предварительный синтез пиримидинового кольца и включение его в состав нуклеотида только на завершающих стадиях.
При дефекте оротатфосфорибозилтрансферазы развивается оротатацидурия. ОМФ является предшественником уридиловых, цитидиловых и тимидиловых нуклеотидов
Авторегуляция синтеза пиримидиновых нуклеотидов
Ключевыми ферментами являются карбамаилфосфатсинтетаза и карбамаиаспартаттрансфераза
Эти аллостерические ферменты угнетаются высокими концентрациями готовых пиримидиновых нуклеотидов.
Синтез уридилового нуклеотида: Синтез цитидилового нуклеотида
Синтез тимидилового нуклеотида:
Многие противоопухолевые препараты являются ингибиторами фермента тимидилатсинтетазы.
Дополнительный путь синтеза пиримидиновых нуклеотидов возможен из готовых оснований.
Возможны 2 пути биосинтеза ДНК в организме: репликация, репарация
Сущность репликации сводится к соединению нуклеотидов в комплементарную антипараллельную дочернюю цепь ДНК. В репликации выделяют 3 стадии: инициация (начало синтеза), элонгация (удлинение цепи), терминация (окончание синтеза).
Репарация ДНК происходит при появлении в её молекуле повреждений, искажений. При репарации вначале распознаётся место повреждения, затем ферменты рестриктазы вырезают дефектный участок, ДНК-полимеразы по принципу комплементарности синтезируют отсутствующий участок, а ДНК-лигазы прикрепляют его к сохранившимся участкам неповреждённой ДНК.
Биосинтез РНК (транскрипция)
Транскрипция синтез молекулы РНК по матрице ДНК. Биологическая роль: перенос генетической информации с ДНК на РНК. Для транскрипции необходимы:
Выделяют 3 стадии транскрипции: инициация, элонгация, терминация
На молекуле ДНК имеется особый участок промотор, с которым связывается РНК-полимераза. Промотор иногда называют ТАТА участком (преобладает тимин, аденин, между которыми 2 Н-связи). Рядом с промотором расположены сигнальные участки, определяющие скорость транскрипции. Далее в молекуле ДНК располагаются кодирующие (экзоны) и некодирующие (интроны) участки гена. Участок (сайт) терминации определяет окончание синтеза РНК.
Синтезированная РНК переписывает с кодирующей нити ДНК, как кодирующие участки, так и некодирующие участки гена и является про-РНК (незрелой РНК). Про-РНК в последующем подвергается созреванию (процессингу). Существует несколько механизмов процессинга:
Особенности процессинга для рРНК, тРНК, иРНК.
Процессинтг тРНК происходит путём метилирования азотистых оснований и добавления акцепторного участка ЦЦА в сочетании со сплайсингом.
Процессинтг рРНК заключается в вырезании из большого предшественника фрагментов всех видов РНК: 18S; 5S; 5,8S; 28S;.
Возможен альтернативный сплайсинг, который состоит в том, что для разных белков интроны могут играть роль экзонов.
Возможен и безматричный синтез РНК; он происходит из нуклеозиддифосфатов при участии фермента полинуклеотидфосфорилазы. В этом варианте синтезируются стандартные, небольшие молекулы РНК, необходимые для синтеза стандартных белков.
Таким образом, передача генетической информации происходит в следующем направлении: ДНК→ РНК→ белок. Однако, в некоторых фагах, эмбриональных тканях возможен синтез ДНК по матрице РНК (РНК→ДНК). Этот вариант синтеза катализирует фермент РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). В вирусах возможен также вариант синтеза РНК→РНК при участии РНК-репликазы.
Биосинтез белков трансляция
Основной структурой синтезируемых белков является первичная структура (последовательность аминокислот в полипептидной цепи), которая заложена в генетическом коде ДНК.
Генетический код имеет ряд характеристик.
Таким образом, код ДНК является линейным непрерывным и однонаправленным. Последовательность нуклеотидов строго соответствует последовательности аминокислот в синтезируемом белке принцип коллинеарности.
Для трансляции необходимы следующие факторы:
На первой подготовительной стадии происходит активация аминокислот и связывание их со своей транспортной РНК. В этой стадии участвуют ферменты аминоацил-тРНК-синтетазы. Это специфичные ферменты, обеспечивающие соединение аминокислоты с соответствующей тРНК.
Элонгация включает в себя замыкание пептидной связи, транслокацию рибосомы по иРНК с использованием энергии ГТФ и АТФ. К свободному А-участку присоединяется своим антикодоном вторая тРНК со второй аминокислотой. Под действием фермента пептидилтрансферазы первая аминокислота отрывается от первой тРНК и присоединяется ко второй аминокислоте с формированием дипептида. В последующем происходит смещение (транслокация) рибосомы по иРНК на расстояние 3 нуклеотидов. При этом вторая тРНК с дипептидом оказывается в пептидильном участке, а аминоацильный участок освобождается. Первая тРНК покидает рибосому и уходит в цитозоль за новой аминокислотой, а к А-участку присоединяется третья тРНК с третьей аминокислотой. Затем дипептид переносится на третью аминокислоту сообразованием трипептида. Синтез полипептидной цепи белка происходит в направлении от N-конца к С-концу. В процессе трансляции тРНК выполняет своеобразную адапторную роль в переводе четырёхзначной информации иРНК в двадцатизначную в белках.
Терминация происходит при приближении белоксинтезирующего комплекса к терминирующему кодону иРНК (УАГ, УГА). Этому кодону не соответствует ни одна из тРНК, поэтому не приносится новая аминокислота, и синтез белка обрывается.
Посттрансляционная модификация белков
Многие синтезированные белки в последующем подвергаются посттрансляционной модификации. Существует несколько её вариантов. Наиболее часто встречается:
Ингибиторы биосинтеза белка
В клинической практике применяют в качестве антибактериальных препаратов ингибиторы синтеза нуклеиновых кислот и белка в микроорганизмах. Они проявляют эффект на различных стадиях:
Антимицин Д встраивается в молекулу ДНК и блокирует синтез новой ДНК,
Новобиацин ингибирует ДНК-гиразу (топоизомеразу),
Рифамицин блокирует РНК-полимеразу,
Тетрациклин, левомицетин связывают либо малую, либо большую субъединицу рибосомы и тем самым блокируют синтез белка,
Пенициллин блокирует синтез белков, входящих в оболочку микроорганизмов.
Регуляция биосинтеза белка
Наиболее подробно выяснена регуляция синтеза белка на микроорганизмах. Общепринятой является схема авторегуляции Моно и Жакоба. Согласно этой схеме, в молекуле ДНК выделяют ген-регулятор, который отвечает за синтез особой РНК и в последующем за синтез особого белка репрессора. На удалении от этого участка находятся ген-оператор и струрктурные гены. Структурные гены (цистроны) служат матрицей для синтеза иРНК, а в последующем белков. Белки в процессе обмена образуют метаболиты. Метаболиты связываются с репрессором. Репрессор регулирует активность гена оператора, который, в свою очередь, влияет на структурные гены.
Глава 13. ОБМЕН СЛОЖНЫХ БЕЛКОВ
ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты составляют существенную небелковую часть сложного класса органических веществ, получивших название нуклеопротеинов (см. главу 2); последние являются основой наследственного аппарата клетки хромосом. Белковые компоненты нуклеопротеинов подвергаются многообразным превращениям, аналогичным метаболизму белков и продуктов их распада – аминокислот, подробно рассмотренному в главе 12. О нуклеиновых кислотах, их структуре и функциях в живых организмах в последнее время накоплен огромный фактический материал, подробно рассмотренный в ряде специальных руководств и монографий. Помимо уникальной роли нуклеиновых кислот в хранении и реализации наследственной информации, промежуточные продукты их обмена, в частности моно-, ди- и трифосфатнуклеозиды, выполняют важные регуляторные функции, контролируя биоэнергетику клетки и скорость метаболических процессов. В то же время нуклеиновые кислоты не являются незаменимыми пищевыми факторами и не играют существенной роли в качестве энергетического материала. Далее детально рассматриваются (помимо краткого изложения вопросов переваривания) проблемы метаболизма нуклеиновых кислот и их производных, в частности пути биосинтеза и распада пуриновых и пиримидиновых нуклеотидов, современные представления о биогенезе ДНК и РНК и их роли в синтезе белка.
Переваривание нуклеопротеинов и всасывание продуктов их распада осуществляются в пищеварительном тракте. Под влиянием ферментов желудка, частично соляной кислоты, нуклеопротеины пищи распадаются на полипептиды и нуклеиновые кислоты; первые в кишечнике подвергаются гидролитическому расщеплению до свободных аминокислот. Распад нуклеиновых кислот происходит в тонкой кишке в основном гидролитическим путем под действием ДНК- и РНКазы панкреатического сока. Продуктами реакции при действии РНКазы являются пуриновые и пи-римидиновые мононуклеотиды, смесь ди- и тринуклеотидов и резистентные к действию РНКазы олигонуклеотиды. В результате действия ДНКазы образуются в основном динуклеотиды, олигонуклеотиды и небольшое количество мононуклеотидов. Полный гидролиз нуклеиновых кислот до стадии мононуклеотидов осуществляется, очевидно, другими, менее изученными ферментами (фосфодиэстеразами) слизистой оболочки кишечника.
В отношении дальнейшей судьбы мононуклеотидов существует два предположения. Считают, что мононуклеотиды в кишечнике под действием неспецифических фосфатаз (кислой и щелочной), которые гидролизируют фосфоэфирную связь мононуклеотида («нуклеотидазное» действие), расщепляются с образованием нуклеозидов и фосфорной кислоты и в таком виде всасываются. Согласно второму предположению, мононуклеотиды всасываются, а распад их происходит в клетках слизистой оболочки кишечника. Имеются также доказательства существования в стенке кишечника нуклеотидаз, катализирующих гидролитический распад моно-нуклеотидов. Дальнейший распад образовавшихся нуклеозидов осуществляется внутри клеток слизистой оболочки преимущественно фосфороли-тическим, а не гидролитическим путем.
Всасываются преимущественно нуклеозиды, и в таком виде часть азотистых оснований может быть использована для синтеза нуклеиновых кислот организма. Если происходит дальнейший распад нуклеозидов до свободных пуриновых и пиримидиновых оснований, то гуанин не используется для синтетических целей. Другие основания, как показывают опыты с меченными по азоту аденином и урацилом, в тканях могут включаться в состав нуклеиновых кислот. Однако экспериментальные данные свидетельствуют, что биосинтез азотистых оснований, входящих в состав нуклеиновых кислот органов и тканей, протекает преимущественно, если не целиком, de novo из низкомолекулярных азотистых и безазотистых предшественников.
Таким образом, синтез нуклеиновых кислот, мономерными единицами которых являются мононуклеотиды, будет определяться скоростью синтеза пуриновых и пиримидиновых нуклеотидов; синтез последних в свою очередь зависит от наличия всех составляющих из трех компонентов. Источником рибозы и дезоксирибозы служат продукты превращения глюкозы в пентозофосфатном цикле. Пока не получены доказательства существенной роли пищевых пентоз в синтезе нуклеиновых кислот. Фосфорная кислота также не является лимитирующим фактором, поскольку она поступает в достаточном количестве с пищей. Следовательно, биосинтез нуклеиновых кислот начинается с синтеза азотистых оснований (точнее, мономерных молекул – мононуклеотидов).
Обмен нуклеотидов
Нуклеотиды являются вездесущими компонентами жизни, участвуя в большинстве биохимических реакций. АТФ является энергетической валютой клетки, производные аденина служат коферментами, циклические нуклеотиды цAMФ и цГМФ играют роль вторичных мессенджеров. Наконец, нуклеотиды — это мономерные звенья РНК и ДНК.
Пути биосинтеза нуклеотидов служат мишенью для противоопухолевых и некоторых антибактериальных препаратов, а нарушения в путях их катаболизма ловят ступни в капкан.
Строение нуклеотидов
Нуклеотиды состоят из трех компонентов: азотистого основания, пентозы и фосфата. Нуклеотид без фосфата называется нуклеозидом. Азотистые основания — это производные пурина и пиримидина (рис. 1).
Рисунок 1. | Главные азотистые основания. Некоторые названия отражают историю открытия этих соединений. Гуанин был выделен из перуанского гуано (птичьего помета), тимин — из тимуса быка, аденин — из поджелудочной железы. Урацил получил свое название от мочевой кислоты, из которой его пытались синтезировать. Б. Структурная формула нуклеотидов. В дезоксирибонуклеотидах OH-группа при 2’-углероде замещена на H.
В ДНК и РНК пуриновые основания одинаковые — аденин и гуанин, а пиримидиновые разные: в ДНК тимин, в РНК урацил и в обеих цитозин. Дезоксирибонуклеотиды, образующие ДНК, содержат 2’-дезокси-D-рибозу, а рибонуклеотиды РНК — D-рибозу. Термин «нуклеотид» может обозначать как рибо-, так и дезоксирибоформы.
Биосинтез пуринов
Синтез пуринов de novo сложен и энергозатратен, поэтому в физиологических условиях пул пуринов поддерживается в основном за счет путей их реутилизации (исключение составляют быстроделящиеся клетки). Всасывание нуклеотидов из пищи мало, так как почти все остатки нуклеиновых кислот катаболизируются эпителием тонкой кишки.
Аденин и гуанин образуются из общего предшественника — инозината (IMP). Пуриновое ядро постепенно собирается на остатке 5-Фосфорибозил-1-пирофосфата (PRPP). Все четыре атома азота происходят из аминокислот: два из глутамина, один из аспартата и один из глицина (рис. 2–4).
Рисунок 2. | Синтез пуриновых нуклеотидов de novo: часть 1, образование пуринового кольца инозината. После стадии ③ R обозначает 5-фосфо-D-рибозильную группу. Снизу изображено происхождение атомов пуринового кольца.
Зависимость синтеза пуринов от фолатов на стадиях 3 и 9 означает, что ингибиторы метаболизма фолиевой кислоты являются непрямыми ингибиторами синтеза пуринов, а значит, и ингибиторами деления клетки.
Рисунок 3. | Биосинтез AMP и GMP из IMP.
Регуляция этого пути сложна и мало изучена. Известно, что AMP, GMP и IMP ингибируют его по механизму отрицательной обратной связи. В недавних исследованиях [1] было показано, что шесть ферментов биосинтеза пуринов собираются в пуриносому, являющую собой новый уровень организации ферментов.
Рисунок 4. | Обзорная схема синтеза пуриновых нуклеотидов.
Реутилизация пуринов
Свободные пуриновые основания постоянно высвобождаются в клетке в процессе катаболизма нуклеотидов, и их большая часть повторно используется для синтеза нуклеотидов в более простом пути, нежели синтез de novo.
Один из таких путей настолько прост, что состоит из одной реакции, катализируемой аденозинфосфорибозилтрансферазой: Аденин + PRPP → AMP + PPi
Свободный гуанин и гипоксантин реутилизируются в похожем пути под действием гипоксантин-гуанин-фосфорибозилтрансферазы. Мутация гена вышеназванного фермента вызывает синдром Лёша — Нихена. Это сцепленное с мужским полом заболевание, манифестирующее в раннем возрасте и характеризующееся деформирующим артритом и неврологическими нарушениями. Мальчики с синдромом Лёша — Нихена плохо ориентируются в пространстве, очень враждебны и склонны к саморазрушению вплоть до откусывания себе пальцев.
Биосинтез пиримидинов
Если при синтезе пуриновых нуклеотидов азотистое основание кусочек за кусочком собирается на остатке рибозилфосфата, то при синтезе пиримидинов к рибозе оно присоединяется уже в готовом виде (рис. 5).
Рисунок 5. | Синтез пиримидиновых нуклеотидов. Стадия 1: Синтез карбамоилфосфата. 2: Конденсация аспартата и карбамоилфосфата с образованием N-карбамоиласпартата. 3: Внутримолекулярная конденсация, катализируемая дигидрооротазой с образованием шестичленного гетероцикла (дигидрооротата). 4: Окисление дигидрооротата до оротата. 5: присоединение к оротату рибозо-5-фосфата (PRPP). 6: Декарбоксилирование оротодилата до уридилата. Ферменты 5 и 6 стадий образуют комплекс и называются УМФ-синтазой.
Источник: Campbell M. K., Farell S. O. Biochemistry
Мутации гена UMPS, кодирующего УМФ-синтазу вызывают оротацидурию — редкое (описано лишь 20 случаев) аутосомно-рецессивное заболевание, проявляющееся тяжелой мегалобластной анемией, задержкой развития вследствие дефицита пиримидиновых нуклеотидов и повышенным содержанием оротовой кислоты в моче.
Нуклеозидмонофосфаты превращаются в нуклеозидтрифосфаты под действием нуклеозидмонофосфаткиназ и нуклеозиддифосфаткиназ. Последние необычны тем, что являются неспецифичными ни по основанию, ни по пентозе.
Цитидилатсинтетаза образует цитидилат из UTP.
Прежде чем описать синтез тимидилата, необходимо упомянуть об образовании дезоксирибонуклеотидов, так как его синтез de novo возможен только из дезоксирибонуклеотидного предшественника.
Образование дезоксирибонуклеотидов
Строительные блоки ДНК образуются из соответствующих рибонуклеотидов непосредственным восстановлением 2’-углеродного атома рибозы с образованием 2’-дезоксипроизводного. Реакция катализируется рибонуклеотидредуктазой, ее субстраты — нуклеозиддифосфаты, в ней также участвуют тиоредоксин и тиоредоксинредуктаза.
Рисунок 6. | Восстановление рибонуклеотидов до дезоксирибунклеотидов.
Регуляция рибонуклеотидредуктазы весьма необычна и служит для поддержания баланса четырех нуклеотидов, необходимых для синтеза ДНК. Каждая субъединица имеет 2 типа регуляторных центров: один центр регулирует активность (ATP +, dATP-), второй влияет на субстратную специфичность. Например, если со вторым центром связывается ATP или dATP, фермент начинает отдавать предпочтение восстановлению UDP или CDP, а когда UTP и СTP становится слишком много, возвращается к ADP. ATP выступает главным стимулятором восстановления всех рибонуклеотидов, а dATP в больших концентрациях выключает фермент.
Биосинтез тимидилата
Непосредственный предшественник тимидилата — dUMP. Превращение катализируется тимидилатсинтазой и сопряжено с окислением метилентетрагидрофолата до дигидрофолата (рис. 7).
Рисунок 7. | Синтез тимидилата.
Источник: Campbell M. K., Farell S. O. Biochemistry
Синтез тимидилата является мишенью некоторых противоопухолевых препаратов. Так, в химиотерапии используется ингибитор тимидилатсинтазы — фторурацил (вернее, его метаболит FdUMP), ингибитор дигидрофолатредуктазы — аминоптерин и структурный аналог фолата — метотрексат. Потребность раковых клеток в нуклеотидах гораздо выше, чем у нормальных клеток, поэтому они более чувствительны к ингибиторам биосинтеза тимидилата.
Катаболизм нуклеотидов
Катаболизм пиримидинов
С помощью нуклеотидазы и фосфорилазы от пиримидиновых нуклеотидов отщепляются фосфаты и рибоза, а оставшиеся свободные азотистые основания подвергаются дезаминированию и гидрированию (рис. 8).
Рисунок 8. | Катаболизм пиримидинов. Источник: Campbell M. K., Farell S. O. Biochemistry
Пути распада пиримидинов ведут главным образом к NH4+ и далее к мочевине.
Катаболизм пуринов
Пуриновые нуклеотиды теряют свои фосфаты под действием 5’-нуклеотидазы.
Аденилат превращается в аденозин, который дезаминируется аденозиндезаминазой (ADA) с образованием инозина, который гидролизуется нуклеозидазой до гипоксантина и рибозы. Ксантиноксидаза окисляет гипоксантин до ксантина и затем до мочевой кислоты. (рис. 9)
Рисунок 9. | Катаболизм пуриновых нуклеотидов. Общий метаболит катаболизма пуринов — ксантин. Превращение ксантина в мочевую кислоту катализирует ксантиноксидаза. В правом верхнем углу изображена аденозиндезаминаза (ADA)
У большинства млекопитающих мочевая кислота окисляется до более растворимого соединения — аллантоина, однако у человека, далматинов, приматов и птиц она является конечным экскретируемым продуктом катаболизма пуринов, и здесь время поговорить о подагре.
Заболевания, связанные с катаболизмом пуринов
1. Гиперурикемия и подагра.
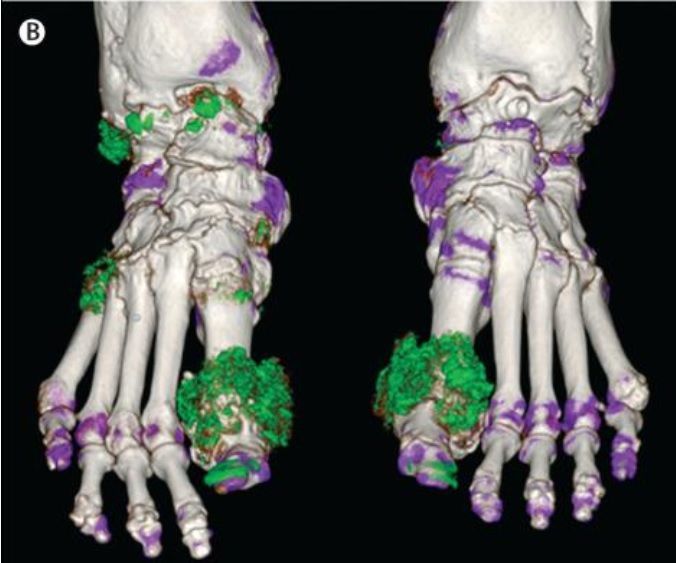
Повышенное содержание мочевой кислоты в крови называется гиперурикемией (> 360 мкмоль/л для женщин и > 400 мкмоль/л для мужчин). У этого состояния может быть множество причин: дефект генов, отвечающих за экскрецию уратов почками и кишечником, богатая пуринами и/или фруктозой диета, низкоуглеводная диета, голодание, синдром лизиса опухоли, прием препаратов (диуретиков, аспирина, никотиновой кислоты и др.), синдром Лёша-Нихена, большие дозы алкоголя и другие, но всех их можно поделить на два типа: гиперпродукция уратов и снижение их экскреции. Гиперурикемия далеко не всегда сопровождается подагрой, но подагра гиперурикемией — всегда. Подагра — это метаболическое заболевание, характеризующееся отложением кристаллов уратов натрия преимущественно в плюснефаланговых суставах, поражением почек и приступами острого подагрического артрита.
Рисунок 10. | Двухэнергетическая КТ стоп пациента с тофусной подагрой. Депозиты урата показаны зеленым цветом ( на ногтях – артефакт)
Этиология, патогенез и терапия подагры заслуживают отдельной статьи. Здесь я упомяну только о препаратах, влияющих на катаболизм пуриновых нуклеотидов, — ингибиторах ксантиноксидазы (фермента, превращающего ксантин в мочевую кислоту, см. рис. 9). Один из них — аллопуринол, структурный аналог гипоксантина, конкурентный ингибитор ксантиноксидазы. К неконкурентным ингибиторам относится фебуксостат. Оба препарата снижают уровень мочевой кислоты в крови и используются для предотвращения приступов подагры.
2. Дефицит аденозиндезаминазы ведет к одному из типов тяжёлого комбинированного иммунодефицита (SCID, синдром Глянцмана — Риникера, в 30 % случаев вызывается дефицитом ADA), характеризующемуся неспособностью T- и B- лимфоцитов к пролиферации и продукции антител.
Отсутствие аденозиндезаминазы ведет к значительному накоплению dATP, который ингибирует нуклеотидредуктазу, в результате чего возникает дефицит всех дезоксирибонуклеотидов (рис. 11). ADA является Zn-зависимым ферментом, поэтому нарушения в делении лимфоцитов возможны и при дефиците в организме цинка.
Рисунок 11. | Недостаточность аденозиндезаминазы приводит к нарушениям репликации ДНК