Что такое нуклид в химии
Нуклид
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения. [1]
Содержание
Общее описание
Из определения следует, что нуклид — это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов ( Z ) и нейтронов ( N ), и которое находится в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний).
Число протонов Z представляет собой атомный номер элемента, а сумма A = Z + N — массовое число. Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов), называются изотопами, одинаковое массовое число — изобарами, одинаковое число нейтронов — изотонами. Применение термина изотоп в единственном числе вместо термина нуклид хотя и, строго говоря, неверно, однако широко распространено. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Классификация
Нуклиды делятся на стабильные и радиоактивные (радионуклиды, радиоактивные изотопы). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват, позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад, протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими, или примордиальными радионуклидами; такие нуклиды имеют период полураспада, превышающий 5·10 8 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с атомным номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — по 34 — обладают платина и осмий (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (так называемые моноизотопные элементы, например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Каждому массовому числу соответствует от 0 до 3 стабильных нуклидов, числу нейтронов — от 0 до 7. Общее число всех известных нуклидов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
История и этимология
Химия. 11 класс
Конспект урока
Урок № 1. Химический элемент. Нуклиды. Изотопы. Законы сохранения массы и энергии в химии
Перечень вопросов, рассматриваемых в теме
Урок посвящён изучению основных понятий химии (химический элемент, изотоп, нуклид) и двум важнейшим законам природы – закону сохранения массы и закону сохранения энергии. Учащиеся узнают о важнейших характеристиках химического элемента, смогут назвать различие между понятиями «химический элемент», «нуклид», «изотоп» и научатся применять закон сохранения массы веществ при составлении уравнений химических реакций.
Атом – это наименьшая частица химического элемента, которая несет все его свойства.
Изотопы – это нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов
Нейтрон – это незаряженная элементарная частица.
Нуклиды – это различные виды ядер, которые отличаются зарядом или массовым числом.
Протон – это положительно заряженная элементарная частица.
Элементарная частица – это объект, который нельзя разделить на более мелкие составляющие.
Радиоактивный распад – это превращение ядер нуклидов, сопровождающиеся изменением числа протонов или нейтронов в ядре и испусканием элементарных частиц, гамма-квантов или кластеров.
Химический элемент – это вид атомов с определенным зарядом ядра.
Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра.
Ядро – это положительно заряженная центральная часть атома.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Одним из основных понятий химии является атом. Атом – это наименьшая частица химического элемента, которая несет все его свойства. Согласно планетарной модели, атом состоит из ядра и электронов. Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра. Ядро – это положительно заряженная центральная часть атома. Ядра атомов превращаются друг в друга в ходе ядерных реакций.
Ядро состоит из двух типов элементарных частиц: протонов (Z) и нейтронов (N). Заряд нейтронов равен нулю. Протоны обладают зарядом +1. Общее число нейтронов и протонов в ядре называется массовым числом (А). Оно близко, но не равно по значению к атомной массе элемента, указанной в Периодической таблице. Заряд ядра равен числу протонов и порядковому номеру элемента в Периодической системе.
Вид атомов с определенным зарядом ядра называется химическим элементом. Химический элемент существует в виде простого вещества (металла или неметалла) или соединений с другими элементами. К характеристикам химического элемента относятся: атомный номер, относительная атомная масса, изотопный состав, положение в Периодической системе, строение атома, электроотрицательность, степени окисления, валентность, энергия ионизации, сродство к электрону, распространенность в природе.
Нуклидами называют различные виды ядер, которые отличаются зарядом или массовым числом. Они обозначаются следующим образом: вверху перед символом нуклида пишется массовое число, внизу – порядковый номер элемента. Нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов называются изотопами. Изотопы одного элемента обладают одинаковыми химическими свойствами и почти не отличаются по физическим свойствам. Элементы представляют собой совокупность изотопов с разными массовыми числами, поэтому атомные массы многих элементов представлены дробными числами.
Химические реакции подчиняются законам сохранения массы и энергии. Закон сохранения массы веществ впервые сформулировал великий ученый М.В. Ломоносов. Экспериментально его доказал А.Л. Лавуазье. Формулируется закон следующим образом: масса исходных веществ, вступивших в химическую реакцию, равна массе продуктов реакции. В ходе реакции атомы веществ только перегруппировываются.
В двадцатом веке ученые обнаружили, что закон сохранения массы не соблюдается в случае ядерных реакций. После того, как А. Эйнштейн открыл взаимосвязь между массой и энергией, выраженную в его знаменитой формуле E=mc2, стало понятно, что закон сохранения массы лишь частный случай закона сохранения энергии. Закон сохранения энергии гласит: в изолированной системе энергия системы не исчезает и не появляется, а только переходит из одного вида в другой. Для составления ядерных реакций важно помнить, что суммарный заряд ядер и массовое число сохраняются.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на работу с Периодической системой.
Условие задачи: Введите формулу простого вещества, при бета-распаде которого образуется висмут.
Решение: Висмут – элемент с порядковым номером 83. При бета распаде один из нейтронов превращается в протон, таким образом заряд ядра атома увеличивается на единицу. Следовательно, химический элемент, образующий исходное вещество, находится на одну клетку левее висмута. Это свинец.
2.Решение задачи на закон сохранения массы или закон сохранения числа атомов.
Условие задачи: Расставьте коэффициенты в реакции и выберите правильное значение их суммы.
Решение: Составим электронный баланс. Каждый атом алюминия присоединил 3 электрона, а каждый атом серы отдал два электрона. Тогда коэффициенты 2Al + 3S = Al2S3
Нуклиды
Нукли́д (лат. nucleus — «ядро») — вид атомов, характеризующийся определёнными массовым числом, атомным номером и энергетическим состоянием их ядер, и имеющий время жизни, достаточное для наблюдения. Официальное рекомендуемое определение термина по IUPAC Compendium of Chemical Terminology, 2nd Edition, 1997 (Краткий справочник терминов ИЮПАК, 2-е издание): A species of atom, characterized by its mass number, atomic number and nuclear energy state, provided that the mean life in that state is long enough to be observable.
Содержание
Общее описание
Из определения нуклида следует, что это совокупность одинаковых атомов с определённым числом протонов (Z) и нейтронов (N), с ядром, находящимся в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний). Сумма A = Z + N представляет собой массовое число, а число протонов Z — атомный номер. Для обозначения нуклида элемента (E) используют запись вида: 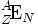
Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов) называются изотопами. Применение термина изотоп в единственном числе вместо термина нуклид хотя и, строго говоря, неверно, однако широко распространено. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Классификация
Нуклиды делятся на стабильные и радиоактивные (радионуклиды). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват, позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад, протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими; такие нуклиды имеют период полураспада, превышающий 5·10 8 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — по 34 — обладают платина и осмий (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Общее число известных нуклидов всех элементов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
Слово нуклид был придуман Трумэн П. Кохман в 1947 г. [2] [3] Кохман определил нуклид как «разновидность атома, характеризующаяся строением ядра», содержащая определенное количество нейтронов и протонов. Таким образом, термин первоначально был сосредоточен на ядре.
Содержание
Нуклиды против изотопов
Типы нуклидов
Хотя слова «нуклид» и «изотоп» часто используются как синонимы, быть изотопами на самом деле является лишь одной связью между нуклидами. В следующей таблице перечислены некоторые другие отношения.
Нуклид и его альфа-распад продукт изодиафер. [4]
но с разными энергетическими состояниями
Увидеть Изотоп # Обозначение для объяснения обозначений, используемых для различных типов нуклидов или изотопов.
В природе существует 252 нуклида, распад которых никогда не наблюдался. Они встречаются среди 80 различных элементов, которые имеют один или несколько стабильных изотопов. Увидеть стабильный нуклид и первичный нуклид. Нестабильные нуклиды радиоактивный и называются радионуклиды. Их продукты распада («дочерние» продукты) называются радиогенные нуклиды. 252 стабильных и около 87 нестабильных (радиоактивных) нуклидов существуют в природе на Земле, в общей сложности около 339 природных нуклидов на Земле. [6]
Происхождение естественных радионуклидов
Природные радионуклиды можно условно разделить на три типа. [7] Во-первых, те, чьи период полураспада т1/2 составляют не менее 2% до возраста Земля (для практических целей их трудно обнаружить с периодом полураспада менее 10% от возраста Земли) ( 4.6 × 10 9 лет ). Это остатки нуклеосинтез это происходило в звездах до образования Солнечная система. Например, изотоп 238
U
(т1/2 = 4.5 × 10 9 лет ) из уран все еще довольно распространен в природе, но короткоживущий изотоп 235
U
(т1/2 = 0.7 × 10 9 лет ) встречается в 138 раз реже. Было обнаружено около 34 из этих нуклидов (см. Список нуклидов и Первородный нуклид подробнее).
Вторая группа радионуклидов, которые существуют в природе, состоит из радиогенные нуклиды такие как 226
Ра
(т1/2 = 1602 года ), изотоп радий, которые образованы радиоактивный распад. Они встречаются в цепочках распада первичных изотопов урана или тория. Некоторые из этих нуклидов очень недолговечны, например изотопы франция. Существует около 51 из этих дочерних нуклидов, период полураспада которых слишком короткий, чтобы быть первичными, и которые существуют в природе исключительно за счет распада более долгоживущих радиоактивных первичных нуклидов.
Пример нуклидов, образованных в результате ядерных реакций, космогенных 14
C
(радиоуглерод), который сделан космический луч бомбардировка другими элементами и нуклеогенными 239
Пу
который до сих пор создается нейтронной бомбардировкой естественного 238
U
в результате естественного деления урановых руд. Космогенные нуклиды могут быть стабильными или радиоактивными. Если они стабильны, их существование должно быть выведено на фоне стабильных нуклидов, поскольку каждый известный стабильный нуклид присутствует на Земле изначально.
Искусственно произведенные нуклиды
Помимо 339 природных нуклидов, более 3000 радионуклидов с различным периодом полураспада были искусственно произведены и охарактеризованы.
Известные нуклиды показаны в Таблица нуклидов. Список первичных нуклидов дается отсортированный по элементам, по адресу Список элементов по стабильности изотопов. Список нуклидов сортируется по периоду полураспада для 905 нуклидов с периодом полураспада более одного часа.
Сводная таблица количества нуклидов каждого класса
Это сводная таблица [8] для нуклидов 905 с периодом полураспада более одного часа, приведенных в список нуклидов. Обратите внимание, что числа неточные и могут немного измениться в будущем, если некоторые «стабильные» нуклиды будут радиоактивными с очень большим периодом полураспада.
