Что такое нуклиды простыми словами
§10. Нуклиды и изотопы. Понятие о радиоактивности
Д. И. Менделеев, размещая химические элементы в периодической системе, вынужден был поставить некоторые из них не в порядке возрастания атомных масс.
В то время этому факту не было объяснения, и Д. И. Менделеев руководствовался только принципом периодичности, согласно которому эти элементы должны были занимать места в соответствии с химическими свойствами их атомов.
НУКЛИДЫ
Исследованиями начала XX веке было установлено, что атомы одного и того же элемента могут иметь разные массы. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом атома (А):
Массовое число практически определяет массу ядра, а следовательно, и массу всего атома, так как масса электронов составляет ничтожную часть общей массы атома. Т.е. массовое число приблизительно равно относительной атомной массе элемента.
Заряд ядра атома Z (т. е. число протонов) и его массовое число A указывают числовыми индексами слева от символа химического элемента:
Вид атомов с определенным значением атомного номера и массового числа называется нуклидом. Т.е. нуклид – это химический элемент с указанием массового числа.
Например, углерод-12, или 12 С; кислород-16, или 16 O; сера-35, или 35 S. Число нейтронов N у любого нуклида легко подсчитать по разности
Еще один вопрос стоял перед учеными: почему относительные атомные массы большинства элементов не являются целочисленными величинами, хотя массовые числа их нуклидов выражаются целыми числами?
Открытие изотопов позволило дать ответ на этот вопрос.
ИЗОТОПЫ
В начале XX в. было доказано, что большинство химических элементов в природе существует в виде нескольких нуклидов. Так, природный литий (Z = 3), кроме нуклидов, в ядрах которых находится 4 нейтрона, имеет нуклиды с числим нейтронов 3. Массовые числа таких нуклидов равны соответственно 6 и 7: 3 6 Li и 3 7 Li.
Нуклиды такого типа назвали изотопами.
Изотопами называются нуклиды, имеющие одинаковый атомный номер (т.е. одинаковое число протонов в ядре), но различные массовые числа
Следовательно, нуклиды 3 6 Li и 3 7 Li — изотопы лития. Другими словами, изотопы — это разновидности атомов одного и того же эле мента, в ядрах которых содержится разное число нейтронов.
Следовательно, атомы данного химического элемента — это нуклиды с одинаковым зарядом ядра (атомным номером).
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
В природе большинство химических элементов существуют в виде смеси нуклидов, каждый из которых характеризуется своим собственным значением массового числа. Поэтому относительная атомная масса данного элемента является усредненной величиной относительных атомных масс его нуклидов. Конечно, при этом учитывается содержание каждого нуклида в природной смеси.
Теперь понятно, почему относительная атомная масса калия меньше, чем аргона. У калия более 93 % его природных атомов имеет массовое число 39, а у аргона 99 % природной смеси приходится на долю нуклида аргон-40. Поэтому относительная атомная масса калия ближе к 39, а аргона — к 40. Однако заряд ядра атомов калия равен 19+, а аргона 18+, и поэтому в таблице они размещаются согласно этой главной характеристике химического элемента.
Относительная атомная масса элемента — физическая величина, которая показывает, во сколько раз средняя масса атомов данного химического элемента больше 1/12 части массы нуклида углерода-12 ( 12 С).
ЯВЛЕНИЕ РАДИОАКТИВНОСТИ
Все нуклиды можно разделить на два типа: стабильные и радиоактивные. Само название «стабильный» говорит об устойчивости данного нуклида, т. е. его способности существовать без изменения состава ядра сколь угодно долго. Стабильность этих нуклидов определяется прежде всего устойчивостью их ядер.
Устойчивость ядра зависит только от соотношения между числом протонов и нейтронов (для каждого элемента оно свое). Если это соотношение выходит за определенные пределы, ядро (а вместе с ним и атом) становится неустойчивым.
Оно самопроизвольно распадается, превращаясь в ядра атомов других элементов. При этом происходит испускание различных частиц. Это явление и есть радиоактивность.
Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Нуклид
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения. [1]
Содержание
Общее описание
Из определения следует, что нуклид — это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов ( Z ) и нейтронов ( N ), и которое находится в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний).
Число протонов Z представляет собой атомный номер элемента, а сумма A = Z + N — массовое число. Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов), называются изотопами, одинаковое массовое число — изобарами, одинаковое число нейтронов — изотонами. Применение термина изотоп в единственном числе вместо термина нуклид хотя и, строго говоря, неверно, однако широко распространено. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Классификация
Нуклиды делятся на стабильные и радиоактивные (радионуклиды, радиоактивные изотопы). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват, позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад, протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими, или примордиальными радионуклидами; такие нуклиды имеют период полураспада, превышающий 5·10 8 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с атомным номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — по 34 — обладают платина и осмий (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (так называемые моноизотопные элементы, например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Каждому массовому числу соответствует от 0 до 3 стабильных нуклидов, числу нейтронов — от 0 до 7. Общее число всех известных нуклидов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
История и этимология
Нуклиды
Нукли́д (лат. nucleus — «ядро») — вид атомов, характеризующийся определёнными массовым числом, атомным номером и энергетическим состоянием их ядер, и имеющий время жизни, достаточное для наблюдения. Официальное рекомендуемое определение термина по IUPAC Compendium of Chemical Terminology, 2nd Edition, 1997 (Краткий справочник терминов ИЮПАК, 2-е издание): A species of atom, characterized by its mass number, atomic number and nuclear energy state, provided that the mean life in that state is long enough to be observable.
Содержание
Общее описание
Из определения нуклида следует, что это совокупность одинаковых атомов с определённым числом протонов (Z) и нейтронов (N), с ядром, находящимся в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний). Сумма A = Z + N представляет собой массовое число, а число протонов Z — атомный номер. Для обозначения нуклида элемента (E) используют запись вида: 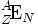
Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов) называются изотопами. Применение термина изотоп в единственном числе вместо термина нуклид хотя и, строго говоря, неверно, однако широко распространено. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Классификация
Нуклиды делятся на стабильные и радиоактивные (радионуклиды). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват, позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад, протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими; такие нуклиды имеют период полураспада, превышающий 5·10 8 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — по 34 — обладают платина и осмий (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Общее число известных нуклидов всех элементов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
Значение слова «нуклид»
нукли́д
1. физ. вид атомов, характеризующийся определёнными массовым числом, атомным номером и энергетическим состоянием их ядер, и имеющий время жизни, достаточное для его наблюдения ◆ В таблице нуклидов на сегодня содержится более 3000 стабильных и радиоактивных нуклидов.
Делаем Карту слов лучше вместе

Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: пошипеть — это что-то нейтральное, положительное или отрицательное?
Синонимы к слову «нуклид»
Предложения со словом «нуклид»
Понятия со словом «нуклид»
Отправить комментарий
Дополнительно
Предложения со словом «нуклид»
Современные данные о распространенностинуклидов представлены на рисунке графической зависимостью содержания нуклидов до последних устойчивых изотопов Pb и Bi и иллюстрирует многие особенности, отражающие характерные свойства различных процессов нуклеосинтеза.
Распространённость нуклидов в первичной солнечной туманности по отношению к содержанию кремния, принятого за 106.
Исследования показали, что основной вклад в активность дают отнюдь не долгоживущие нуклиды, а короткоживущая фракция.
Слово нуклид было придумано Трумэном П. Кохманом в 1947 году. Кохман определил нуклид как «разновидность атома, характеризующаяся строением его ядра», содержащая определенное количество нейтронов и протонов. Таким образом, термин первоначально был сосредоточен на ядре.
СОДЕРЖАНИЕ
Нуклиды против изотопов
Типы нуклидов
Хотя слова «нуклид» и «изотоп» часто используются как синонимы, быть изотопами на самом деле является лишь одной связью между нуклидами. В следующей таблице перечислены некоторые другие отношения.
Нуклид и продукт его альфа-распада являются изодиаферами.
но с разными энергетическими состояниями
См. Раздел « Обозначение изотопов» для объяснения обозначений, используемых для различных типов нуклидов или изотопов.
Происхождение естественных радионуклидов
Пример нуклидов, образующихся в результате ядерных реакций, космогенных. 14
C
( радиоуглерод ), который образуется при бомбардировке космическими лучами других элементов, и нуклеогенный 239
Пу
который до сих пор создается нейтронной бомбардировкой естественного 238
U
в результате естественного деления урановых руд. Космогенные нуклиды могут быть стабильными или радиоактивными. Если они стабильны, их существование должно быть выведено на фоне стабильных нуклидов, поскольку каждый известный стабильный нуклид присутствует на Земле изначально.
Искусственно произведенные нуклиды
Помимо 339 естественных нуклидов, более 3000 радионуклидов с различным периодом полураспада были искусственно произведены и охарактеризованы.



