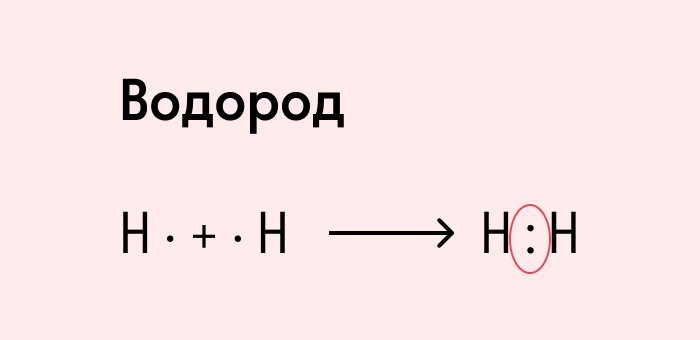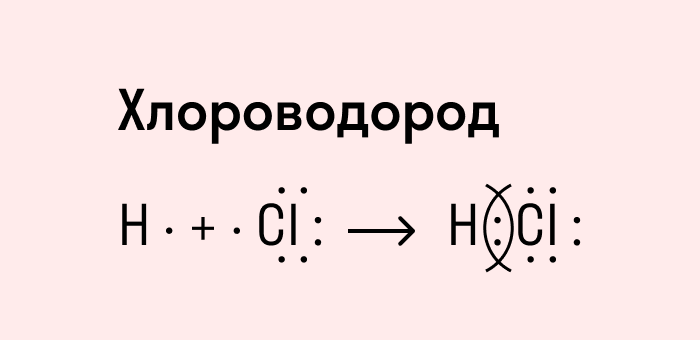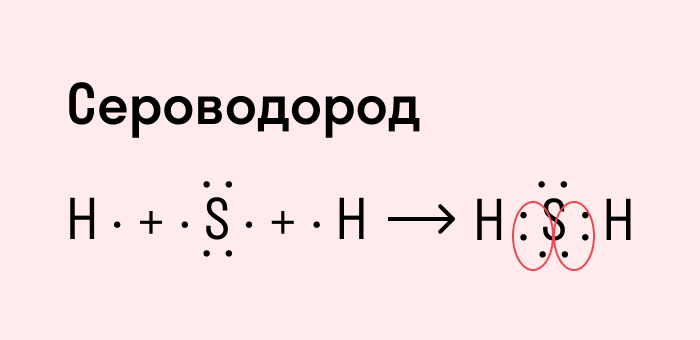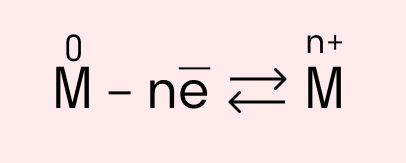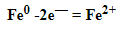Что такое образование веществ кратко
§ 23. Обмен веществ — главный признак жизни
1. Чем отличается живой организм от неживых тел? 2. Что вам известно об энергии?
Организмы растут, развиваются, размножаются, если получают из окружающей среды воздух, воду, свет, тепло, пищу. В окружающую среду организмы выделяют ненужные продукты жизнедеятельности. В результате между организмом и средой непрерывно происходит обмен веществ.
Обмен веществ — взаимосвязанные процессы образования и разрушения веществ, протекающие в организме и обеспечивающие его связь с окружающей средой.
Процессы обмена веществ происходят в клетках организма. В них сложные органические вещества при участии кислорода расщепляются до более простых веществ. При этом освобождается энергия. Она необходима каждому живому организму, каждой живой клетке.
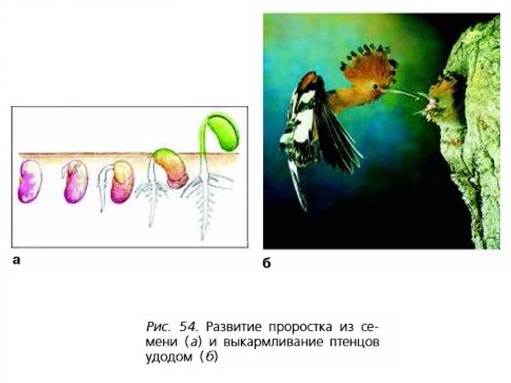
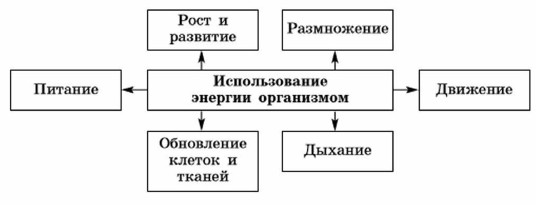
Энергия используется организмом на построение новых клеток, работу органов, поддержание температуры тела и осуществление всех процессов жизнедеятельности. Растения используют энергию на образование органических веществ, их передвижение, рост, развитие (рис. 54, а). Животные расходуют много энергии при активном передвижении (беге, прыжках, машущем полёте, плавании), ориентировании в пространстве. Птицы, например, тратят большое количество энергии на выкармливание своего потомства (рис. 54, б).
Составной частью обмена веществ является питание — потребление организмом необходимых веществ (органических и минеральных) и заключённой в них энергии. Благодаря питанию организмы получают вещества, которые используются на рост, процессы жизнедеятельности, воспроизведение. Различные процессы поступления, превращения и выделения веществ и энергии из организма тонко согласованы и в совокупности обозначаются как обмен веществ и энергии.
Обмен веществ. Образование веществ. Разрушение веществ. Использование энергии организмами
Ответьте на вопросы
1. Что такое обмен веществ?
2. Откуда организмы получают питательные вещества, необходимые для обмена веществ?
3. Как живые организмы используют энергию?
4. Почему обмен веществ является основой жизни?
5. Чем отличается питание растений от питания грибов и животных?
Какая существует связь между обменом веществ и обменом энергии?
Образование химических элементов и веществ

Всего получено оценок: 152.
Всего получено оценок: 152.
Химический элемент – совокупность атомов с одинаковым зарядом. Как же образуются простые и сложные химические элементы?
Химический элемент
Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов.
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве «элементов» рассматривали четыре «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В середине века к этим началам добавились соль, сера и ртуть. В XVIII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.

В настоящее время понятие «химический элемент» установлено точно. Химический элемент – это вид атомов с одинаковым положительным зарядом ядра. Последний равен порядковому номеру элемента в таблице Менделеева.
В настоящее время известно 118 элементов. Примерно 90 из них существуют в природе. Остальные получены искусственно с помощью ядерных реакций.
104-107 элементы были синтезированы учеными-физиками. В настоящее время продолжаются исследования по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы делятся на металлы и неметаллы. К неметаллам относятся такие элементы, как: гелий, неон, аргон, криптон, фтор, хлор, бром, йод, астат, кислород, сера, селен, азот, телур, фосфор, мышьяк, кремний, бор, водород. Однако деление на металлы и неметаллы условное. При определенных условиях некоторые металлы могут приобретать неметаллические свойства, а некоторые неметаллы – металлические.
Образование химических элементов и веществ
Химические элементы могут существовать в виде одиночных атомов, в виде одиночных свободных ионов, но обычно входят в состав простых и сложных веществ.
Простые вещества состоят из атомов одного вида и образуются в результате соединения атомов в молекулы и кристаллы. Большинство химических элементов относятся к металлическим, потому что образованные ими простые вещества является металлами. Металлы имеют общие физические свойства: все они твердые (кроме ртути), непрозрачные, имеют металлический блеск, тепло- и электропроводность, ковкость. Металлы образуют такие химические элементы, как, например, магний, кальций, железо, медь.
Неметаллические элементы образуют простые вещества, относящиеся к неметаллам. Они не имеют характерных металлических свойств, бывают газами (кислород, азот), жидкостями (бром), и твердыми веществами (сера, йод).
Один и тот же элемент может образовывать несколько разных простых веществ, обладающих разными физическими и химическими свойствами. Они называются аллотропными формами, а явление их существования называется аллотропией. Примерами могут быть алмаз, графит и карбин – простые вещества, являющиеся аллотропными формами элемента углерода.
Сложные вещества состоят из атомов элементов разного вида. Например, сульфид железа состоит из атомов химического элемента железа и химического элемента серы. При этом сложное вещество ни в коей мере не сохраняет свойств простых веществ железа и серы: их там нет, а есть атомы соответствующих элементов.
Что мы узнали?
В настоящее время известно 118 химических элементов, которые подразделяются на металлы и неметаллы. Все элементы можно разделить на простые и сложные вещества. первые состоят из атомов одного вида, а вторые – из атомов разных видов.
Биология. 6 класс
Конспект урока
Урок 1. Обмен веществ – главный признак жизни
Перечень вопросов, рассматриваемых на уроке
Обмен веществ – это процессы поступления нужных организму веществ, их сложных превращений внутри и выведения ненужных веществ в окружающую среду. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.
Гетеротрофы – (др.-греч. heteros – «различный» и trophos – «питание») – организмы, которые питаются готовыми органическими веществами и не способны синтезировать органические вещества из неорганических путём фотосинтеза или хемосинтеза.
Основная и дополнительная литература по теме урока
Теоретический материал для самостоятельного изучения
С момента рождения и до смерти в организме происходит обмен веществ и энергии. Для этого из окружающей среды в любой живой организм какие – то вещества должны поступать, а какие – то должны выделяться. Но за счёт каких процессов это возможно? Сегодня на уроке мы будем искать ответ на этот вопрос.
Мы восхищаемся великим разнообразием живых существ. Все они отличаются друг от друга цветом, формой, величиной, строением. Но объединяет всех их одно – жизнь.
Проникнуть в тайны жизни человек пытался давно. Было доказано, что различие между живой и неживой природой заключается в особом строении живого существа и в специфических химических процессах, постоянно происходящих между организмом и внешней средой. Совокупность этих процессов и представляет собой основу жизни.
Примеры и разбор решения заданий тренировочного модуля
Задание 1. Распределите живые организмы по типам питания.
Большая Энциклопедия Нефти и Газа
Образование веществ также происходит в результате либо экзо-либо эндотермических реакций. [1]
Образование вещества в единице объема Ri происходит за счет гомогенных химических реакций в глубине раствора, но не электродных реакций, протекающих на границах раствора. [3]
Образование веществ в природе не протекает по какой-либо определенной, раз навсегда установленной форме. Явления природы, процессы, протекающие в ней, весьма разнообразны. Часто протекающие в природе процессы, на первый взгляд не имеющие между собой ничего общего, ведут к возникновению сходных веществ, одинаковых минералов, одинаковых полезных ископаемых. В настоящее время известно не менее пяти путей образования его в природе. Пирит возникает магматическим путем, выкристаллизовываясь из средних и кислых магм, образуется в фумаролах под действием горячей воды с H2S, а также путем выпадения из горячих растворов при образовании жил на различной глубине. Кроме того, он образуется в осадочных породах, выпадая из холодных растворов, путем восстановления окислов железа в восстановительной среде, например, при взаимодействии их с органическим веществом в породах. Наконец, известно образование пирита, связанного с метаморфизмом при возникновении гнейсов и кристаллических сланцев. Этот пример говорит о том множестве условий, в которых может возникнуть такой относительно простой минерал, как пирит. С более-сложными веществами, к которым следует отнести каустобиолиты, дело-обстоит еще сложней. [4]
Образование вещества в единице объема Кг происходит за счет гомогенных химических реакций в глубине раствора, но не электродных реакций, протекающих на границах раствора. [7]
Образование веществ с системой сопряженных связей сопровождается выделением большого количества тепла и уменьшением свободной энергии, благодаря чему они обладают значительной стойкостью. Большая концентрация л-сопряжений в углеродных волокнах придает им исключительно высокую теплостойкость. Кроме того, развитая система сетчатых связей препятствует протеканию процессов термической деструкции. Если для деструкции линейного полимера достаточно разрыва одной связи между атомами основной цепи, то деструкции сетчатого полимера должен предшествовать разрыв большого числа связей, что мало вероятно. [11]
Образование вещества В в адсорбированном состоянии Вадс лимитировано площадью ртутного капающего электрода. [12]
Образование вещества V является частным случаем общей реакции и будет рассмотрено ниже вместе с аналогичными процессами. [14]
Химическая связь
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
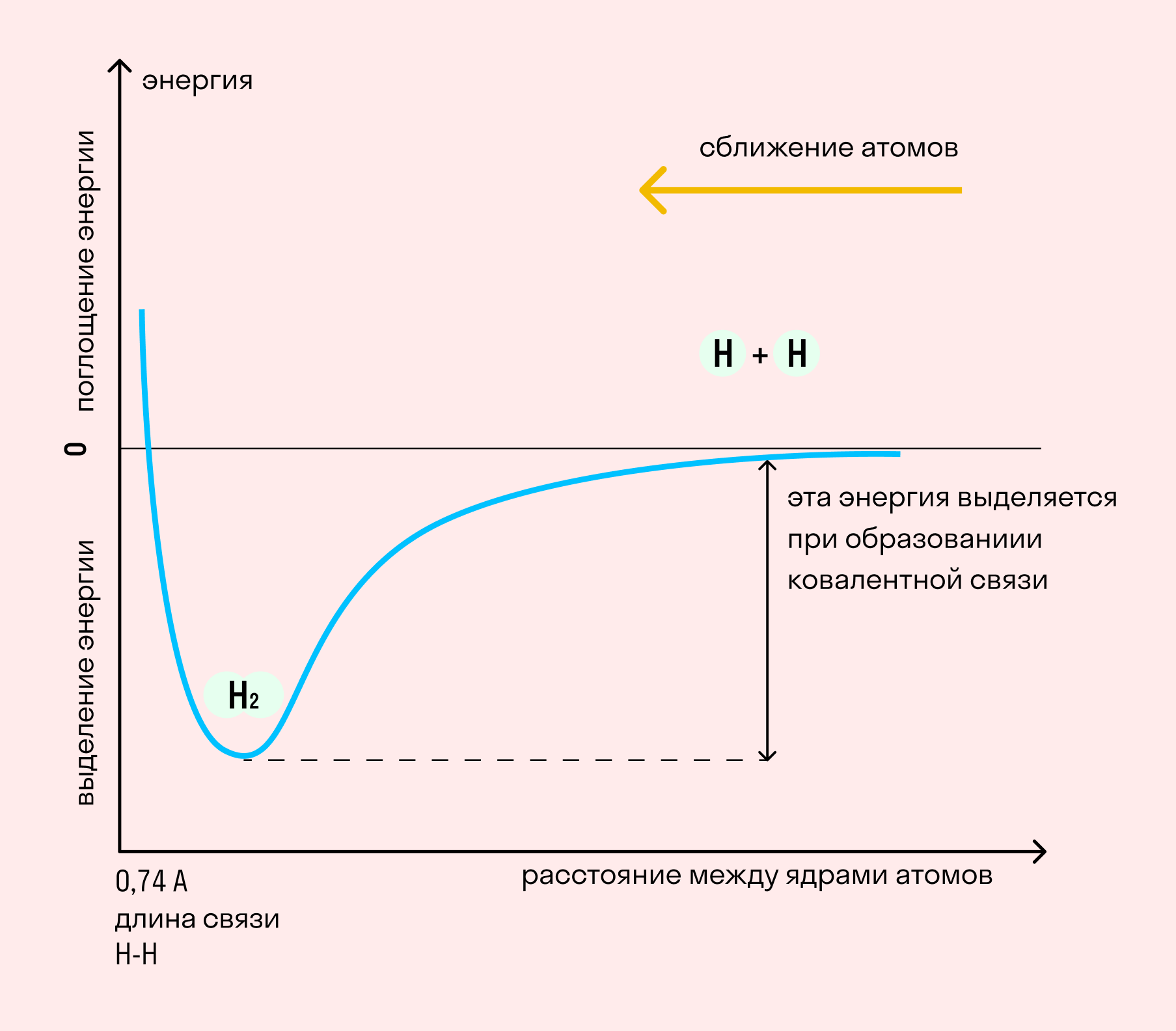
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
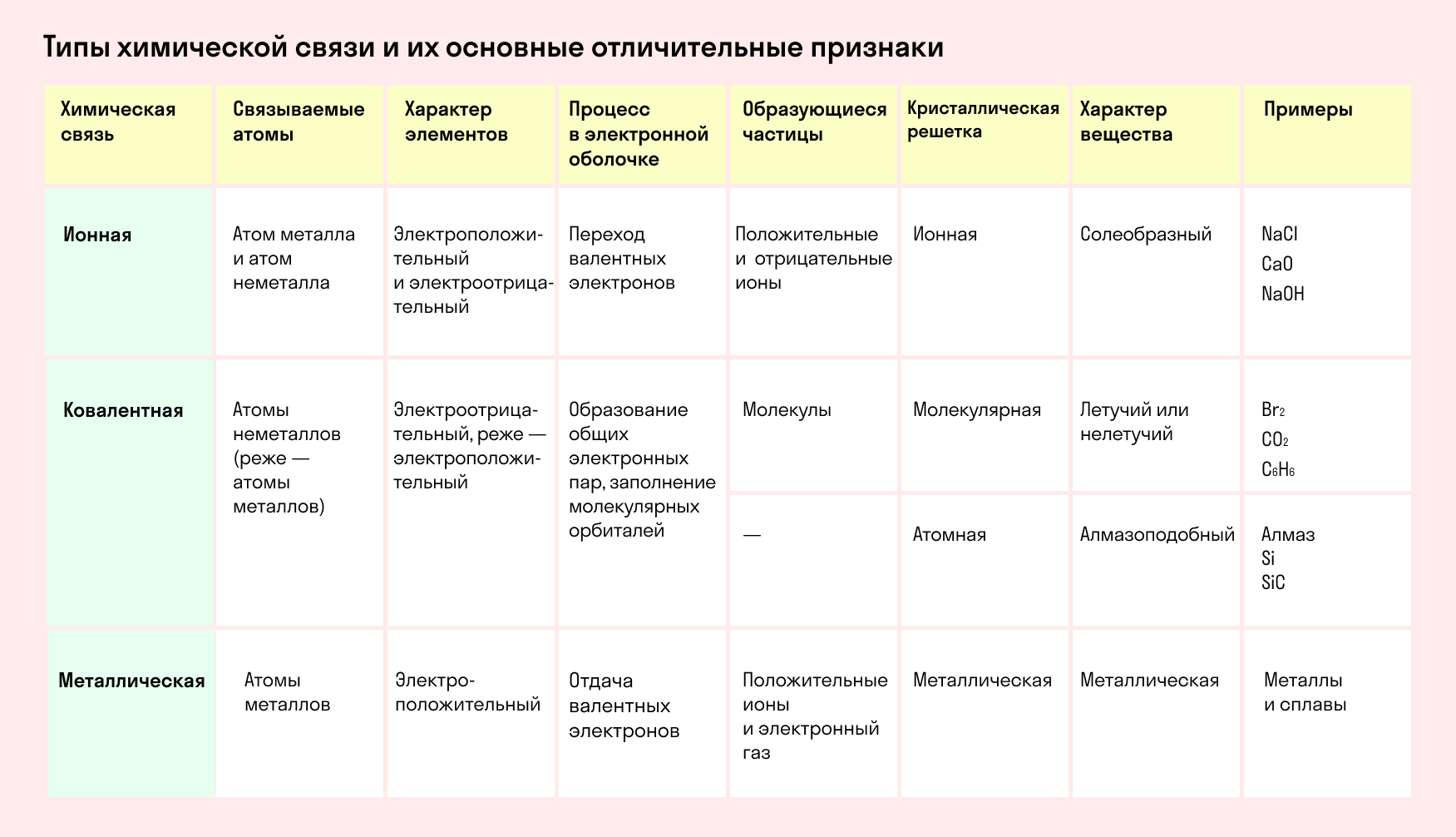
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
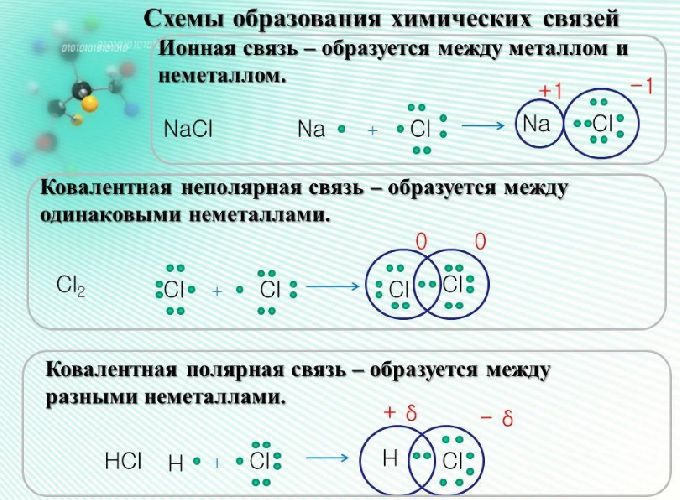
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
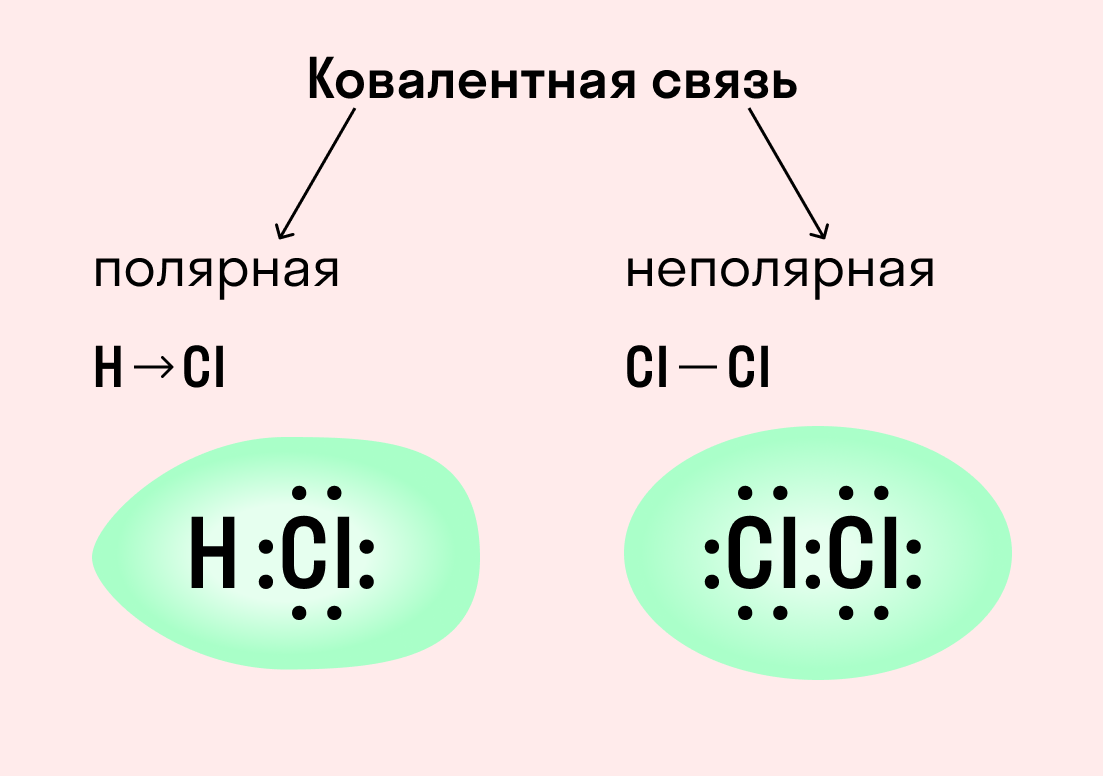
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
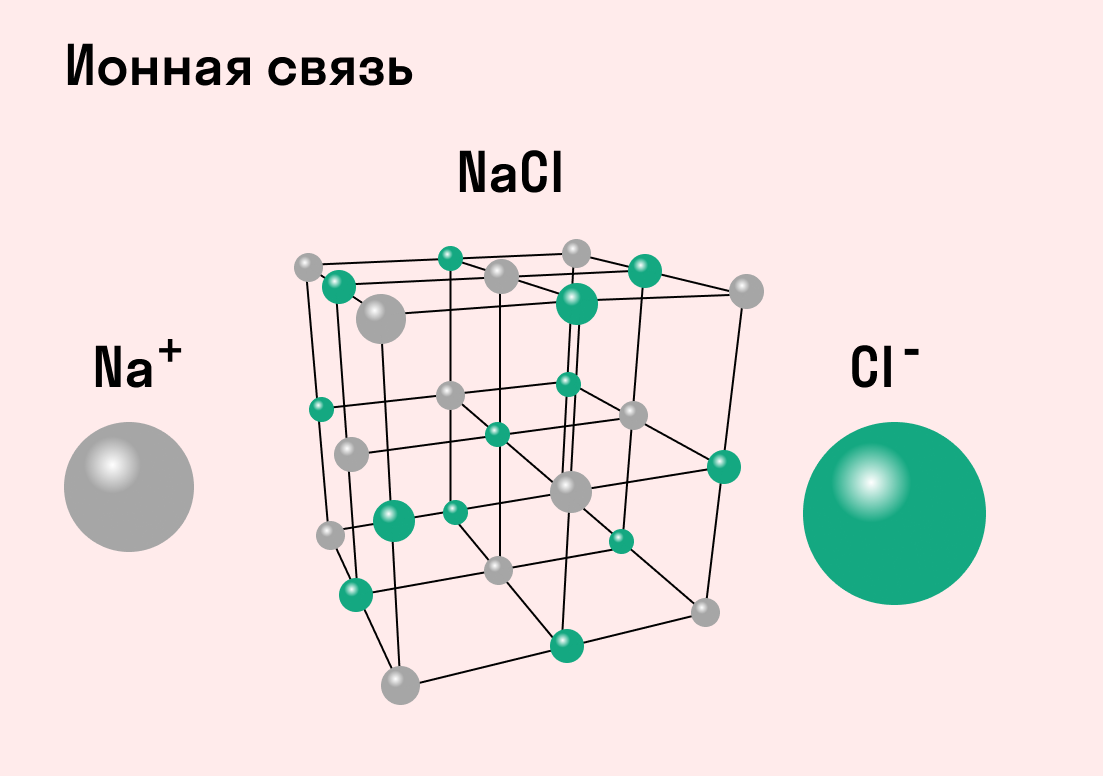
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
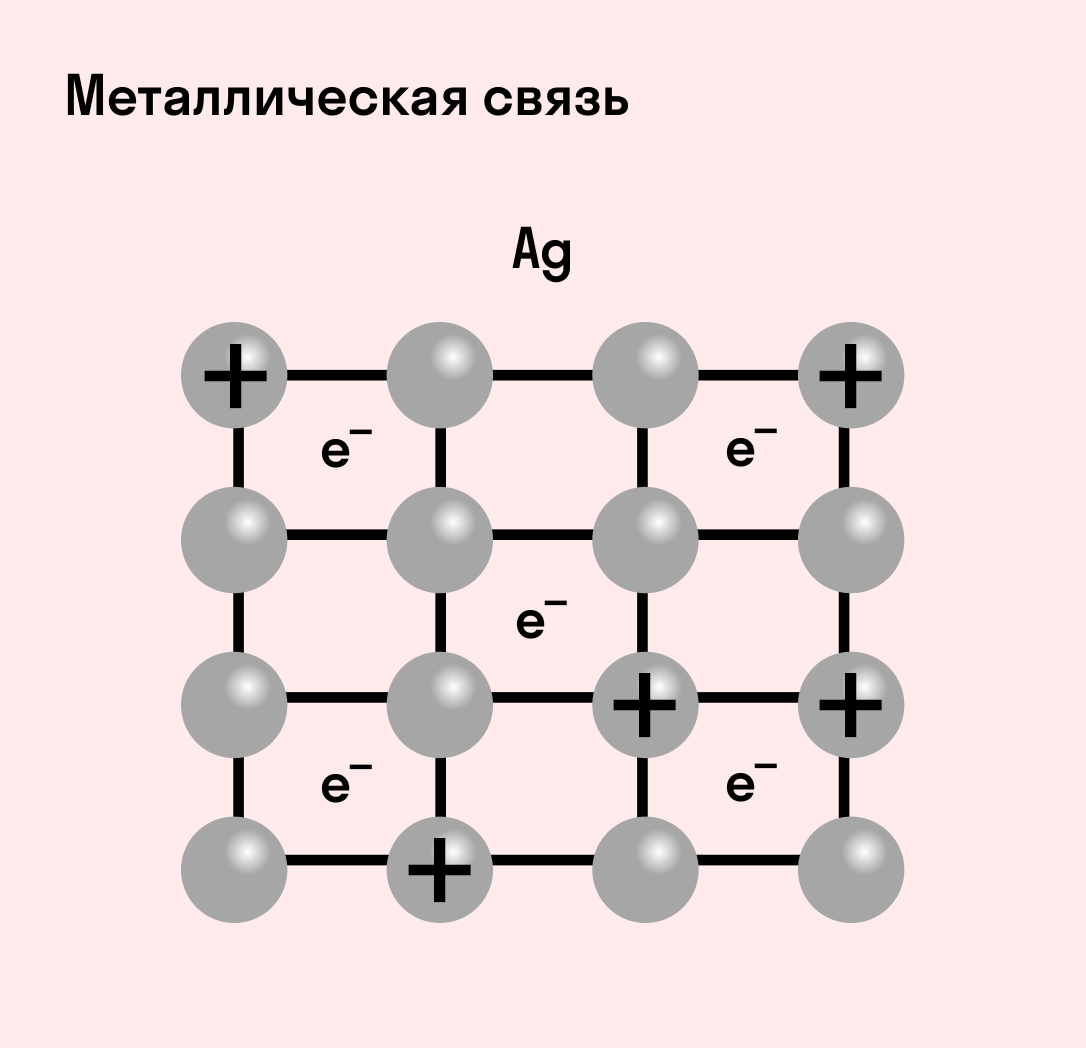
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
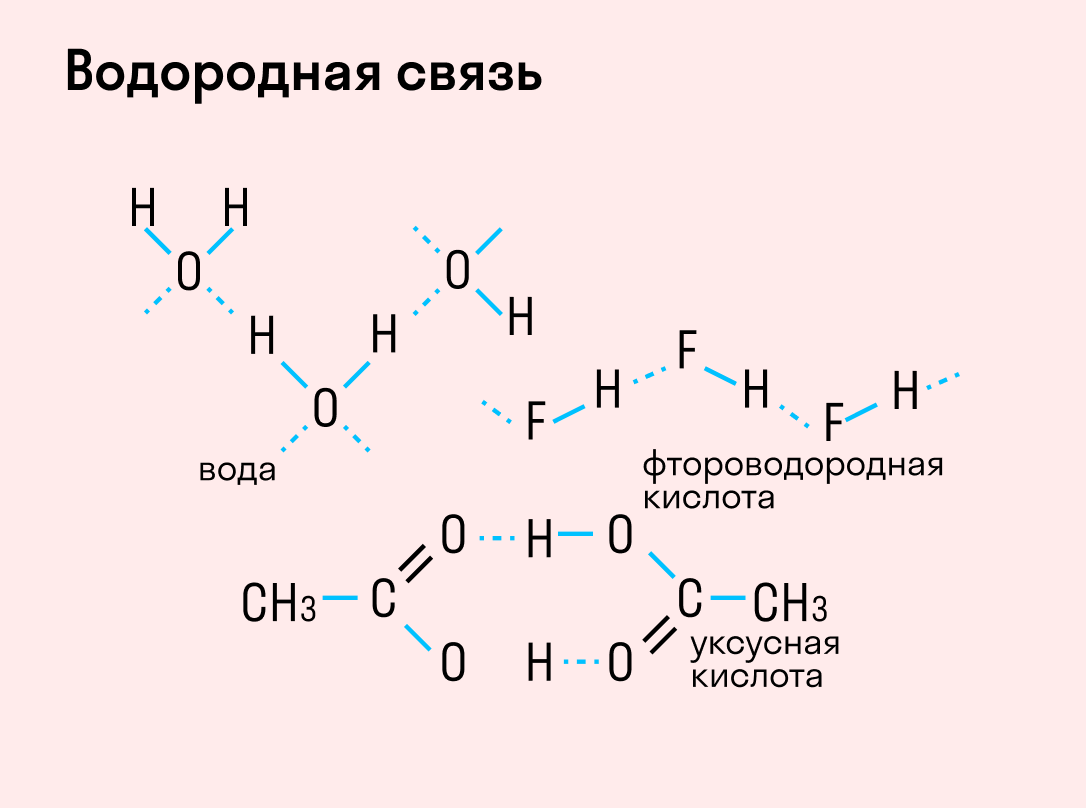
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
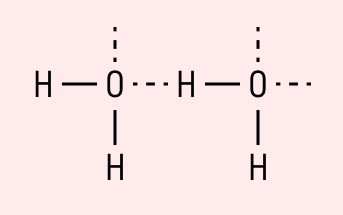
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.