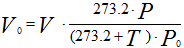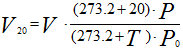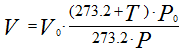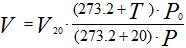Что такое обычные условия в химии
Нормальные и стандартные условия
При нормальных условиях объём одного моля идеального газа составляет 22,413 996(39) дм³ [2] (следствие из закона Авогадро), а количество молекул в 1 см³ составляет 2,6867774(47)×10 19 [3] (постоянная Лошмидта).
Содержание
Другие области
Авиация
Она используется при расчётах движения летательных аппаратов.
Газовое хозяйство
Газовая отрасль Российской Федерации при расчётах с потребителями использует атмосферные условия по ГОСТ 2939—63:
Таким образом, масса кубометра газа по ГОСТ 2939—63 несколько меньше, чем при «химических» нормальных условиях.
Иногда путают нормальные условия со стандартными, полагая, что ГОСТ определяет нормальные условия, и делается вывод о неоднозначности термина «нормальные условия». На самом деле ГОСТ 2939—63 никак не определяет и не упоминает нормальные условия, поэтому «н.у.» определяются однозначно.
См. также
Примечания
Полезное
Смотреть что такое «Нормальные и стандартные условия» в других словарях:
Стандартные условия — Необходимо перенести в эту статью содержимое статьи Нормальные и стандартные условия и поставить оттуда перенаправление. Вы можете помочь проекту, объединив статьи (cм. инструкцию по объединению). В случае необходимости обсуждения… … Википедия
Стандартные условия (СУ), нормальные условия (НУ), легочные условия (ЛУ) — физические условия состояния объемов газов. Источник … Словарь-справочник терминов нормативно-технической документации
стандартные условия — 1.3.2.22 стандартные условия: Температура окружающей среды 15 °С, атмосферное давление 101,3 кПа. Источник: ГОСТ Р 51983 2002: Устройства многофункцио … Словарь-справочник терминов нормативно-технической документации
Стандартные состояния — Стандартные состояния в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин. Необходимость введения «стандартных состояний» связана с тем, что… … Википедия
условия — (см. раздел 1) d) Может ли машина представлять опасности при создании или потреблении определенных материалов? Нет Источник: ГОСТ Р МЭК 60204 1 2007: Безопасность машин. Электрооборудование машин и механизмов. Часть 1. Общие требования … Словарь-справочник терминов нормативно-технической документации
Нормальные условия — стандартные физические условия, с которыми обычно соотносят свойства веществ (при нормальных условиях, при н. у., англ. Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом чистой и прикладной химии)… … Википедия
НОРМАЛЬНЫЕ УСЛОВИЯ — стандартные физ. условия, определяемые давлением р = 101 325 Па (760 мм рт. ст.) и термодинамич. темп рой Т = 273,15 К (t = О °С) … Большой энциклопедический политехнический словарь
НОРМАЛЬНЫЕ УСЛОВИЯ — стандартные физические условия, определяемые давлением 101 325 Па (760 мм рт. ст.) и абсолютной температурой 273,15 К (0°С) … Металлургический словарь
ГОСТ Р 51847-2001: Аппараты водонагревательные проточные газовые бытовые типа А и С. Общие технические условия — Терминология ГОСТ Р 51847 2001: Аппараты водонагревательные проточные газовые бытовые типа А и С. Общие технические условия оригинал документа: 3.2 аппарат с пропорциональной подачей газа: Аппарат, в котором расход газа изменяется пропорционально … Словарь-справочник терминов нормативно-технической документации
Агрегатное состояние — Агрегатное состояние состояние вещества, характеризующееся определёнными качественными свойствами: способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими. Изменение… … Википедия
Что такое обычные условия в химии
Нормальными условиями принято считать давление газа P0 =101.325 кПа и его температуру T0 =0 ºС или T0 =273.2 К.
ГОСТы на топливные газы принято утверждать при температуре T20 =+20 ºС и P0 101.325 кПа (760 мм рт.ст.), в связи с этим эти условия называют стандартными.
Нормальные и стандартные условия введены для сравнения объёмных количеств различных газов.
Приведение газа к нормальным условиям осуществляется по следующему уравнению:
Рисунок 235. (1)
Аналогично для приведения газа к стандартным условиям:
Рисунок 236. (2)
Иногда приходится газ, находящийся при нормальных и стандартных условиях, приводить к заданным условиям температуры и давления. Приведенные выше соотношения примут следующий вид:
Рисунок 237. (3)
Рисунок 238. (4)
P0 – нормальное давление газа, P0 =101.325 кПа = 0.101325 МПа, (760 мм рт.ст.);
Формулировка и определение закона Авогадро
Закон Авогадро в химии — история открытия
Известно, что вещества бывают в твердом, жидком и газообразном состоянии. Частицы жидкости и твердого вещества расположены близко по отношению друг к другу. Это объясняется взаимным притяжением молекул. Можно сделать вывод о существовании сил, удерживающих молекулы жидкости или твердого вещества вместе. Такие силы носят название сил межмолекулярного взаимодействия.
Молекулы газов существенно удалены друг от друга, что отличает подобные вещества от жидкостей и твердых. На таком расстоянии взаимодействие между молекулами почти отсутствует. В связи с этим, для трансформации вещества из жидкого или твердого агрегатного состояния в газообразное требуется преодолеть силы межмолекулярного взаимодействия, отдалив молекулы друг от друга.
Переход в газообразное состояние реализуется в результате повышения температуры веществ, которые находятся в виде жидкости или твердого:
Исходя из того, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, — это, по существу, объем свободного пространства между хаотично перемещающимися молекулами газа. Величина данного пространства определяется условиями, при которых находится газ:
Такая величина приблизительно одинакова для всех газообразных веществ при одинаковых температуре и давлении. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Отсюда вытекает закон Авогадро.
Согласно закону Авогадро, если объемы различных газов равны и взяты при одинаковых температурах и давлении, то они содержат одинаковое число молекул. Гипотезу выдвинул в 1811 году в Турине профессор физики Амедео Авогадро. Данная закономерность нашла подтверждение в многочисленных экспериментальных исследованиях и в дальнейшем получила название закона Авогадро.
Спустя полвека после открытия, на съезде химиков в Карлсруэ признали значение этого закона и приняли его за количественную основу современной химии (стехиометрии). Закон Авогадро в точности выполняется в случае идеального газа. Точность расчетов повышается с увеличением степени разреженности газообразного вещества.
Впервые количественные исследования взаимодействия газов между собой провел французский ученый Гей-Люссак. Ученому принадлежит авторство законов о тепловом расширении газов и закона объемных отношений. Теоретическое объяснение данных постулатов было представлено в 1811 году итальянским физиком Амедео Авогадро.
Интересным является тот факт, что при жизни открытие Авогадро осталось незамеченным по причине критических отзывов со стороны авторитетных химиков той эпохи — Йенса Якоба Берцелиуса и Джона Дальтона, которые утверждали, что возможность существования двухатомных молекул простых веществ отсутствует. Лишь в 1858 году труды Авогадро были по случайному стечению обстоятельств обнаружены итальянским химиком Станислао Канниццаро и обнародованы в 1860 году на Первом международном химическом конгрессе в Карлсруэ (Германия).
Формулировка закона, основная формула
Закон Авогадро: в равных объемах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул.
В химии можно встретить другую формулировку, которая следует из закона: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условиях равный 22,4 л.
Нормальные условия предполагают температурный режим в 273,15 К (0 °C). Давление при этом составляет 1 атм.
В формулировке закона речь идет о равных объемах. При наличии, к примеру, 1 м³ кислорода и 2 м³ азота соотношение Авогадро выполняться не будет. Закон выполняется точно в случае сравнения идеальных газов. Чем сильнее газ отличается от идеального, тем больше отклонение от закона Авогадро.
Идеальными называют газы, частицы которых не взаимодействуют, а их размеры пренебрежимо малы.
Для выполнения закона давление и температура должны быть одинаковы. В противном случае — при разных температурах и давлениях — плотности газов будет отличаться и равенство выполняться не будет.
Пусть температура и давление газа постоянны T=const, p=const, объем не меняется V=const, тогда N — число частиц (молекул) любого идеального газа, является величиной неизменной. Данное утверждение является формулировкой закона Авогадро.
В равных объемах газов V при одинаковых условиях (температуре Т и давлении Р) содержится одинаковое число молекул. Предпосылкой к открытию закона стало правило кратных отношений: при одинаковых условиях объемы газов, которые взаимодействуют между собой, находятся в простых соотношениях, к примеру, 1:1, 1:2, 1:3.
Закон объемных отношений: объемы газов, которые участвуют в химической реакции, при одинаковых условиях (температуре и давлении) относятся друг к другу, как простые целые числа.
В качестве примера можно привести следующие реакции:
Реальные газообразные системы в распространенных случаях представляют собой смесь чистых газов, в том числе, кислорода, водорода, азота, гелия и других. К примеру, в состав воздуха входят (в % по объему):
Каждый из перечисленных газов оказывает давление на стенки сосуда, в котором он заключен. Исходя из этого, можно ввести еще одно важное определение.
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
Закон Авогадро, с другой стороны, является следствием основного уравнения молекулярно-кинетической теории:
С учетом концентрации:
Последняя запись позволяет сделать вывод о количестве молекул газа:
Таким образом, можно заключить, что при одинаковых условиях (одинаковых давлении и температуре) в равных объемах различных газов число молекул будет одинаковым.
Первое и второе следствия из закона Авогадро
Парциальное давление — такое, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем.
где V μ — является молярным объемом газообразного вещества (размерность л/моль);
V — объем вещества системы;
n — определяет количество вещества системы.
Можно записать следующее справедливое равенство:
V μ газа (н.у.) = 22,4 л/моль.
Второе следствие из закона Авогадро: отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов.
Величина, описанная во втором следствии закона Авогадро, то есть отношение масс одинаковых объемов двух газов, является относительной плотностью D.
D = m 1 m 2 = μ 1 μ 2
где μ 1 и μ 2 — молярные массы двух газов.
Параметр D рассчитывается по результатам экспериментальных опытов как отношение масс одинаковых объемов рассматриваемого газообразного вещества m 1 и эталонного газа, молекулярная масса которого известна ( m 2 ). В зависимости от величины D и μ 2 определяют молярную массу исследуемого газа:
Относительную плотность в распространенных случаях определяют по отношению к воздуху или водороду, зная, что молярные массы водорода и воздуха известны и равны, соответственно:
Концентрация молекул идеального газа при нормальных условиях:
Данная величина носит название числа Лошмидта.
Особенности применения, примеры решения задач
При этом учитывается плотность его пара, которая в 5,85 раз превышает плотность воздуха. Таким образом, молекулярная масса рассматриваемого вещества равна:
ρ′C = 5,85 · 28,9 а.е.м. = 169,06 а.е.м.
Газообразные вещества, молярная масса которых меньше 29, легче, чем воздух. В том случае, когда молекулярная масса газа больше 29, вещество тяжелее воздуха.
В задачах по химии можно встретить заданные относительные плотности неизвестного газа по азоту, кислороду и другим газам. Тогда, чтобы найти молярную массу неизвестного газообразного вещества, следует умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро нашел широкое применение в расчетах в химии. В связи с тем, что для газов объемы пропорциональны количествам (моль) веществ, коэффициенты в уравнении реакции между газообразными веществами, которые отражают количественное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Измерения объемов проводят при одинаковых условиях.
Имеется газообразное вещество с относительной плотностью по водороду, равной 8. Нужно найти молярную массу этого газа.
М ( Х ) = М ( Н 2 ) ∙ D = 2 ∙ 8 = 16 г/моль
Газ с соответствующей молярной массой является метаном C H 4
Некий газообразный углеводород обладает относительной плотностью по воздуху, равной 2. Требуется рассчитать молярную массу этого углеводорода.
Средняя молярная масса воздуха составляет 29 г/моль
М(Х) = М(возд.) ∙ D = 29 ∙ 2 = 58 г/моль
Необходимо вычислить объем кислорода, который нужен, чтобы сжечь 2 дм³ пропана. Измерения объемов проводились при нормальных условиях.
Следует записать уравнение химической реакции:
С 3 Н 8 + 5 О 2 → 3 С О 2 + 4 Н 2 О
1 дм 3 С 3 Н 8 — 5 дм 3 O 2
2 дм 3 С 3 Н 8 — 10 дм 3 O 2
Ответ: V ( О 2 ) = 10 дм 3
Требуется вычислить объем, занимаемый 0,5 моль C l 2 при нормальных условиях, и объем, который займут 142 гр хлора при нормальных условиях.
По условиям задачи величины представлены в СИ, поэтому можно выполнить расчеты:
Вторая часть задания решается с помощью уравнения для количества вещества:
Определить молярную массу хлора можно по таблице Менделеева:
Путем подстановки первого выражения во второе, получим:
Ответ: Объем 0,5 молей хлора займут объем 11,2 л. Объем 142 гр хлора — 44,8 л.
D = m 1 m 2 = μ x μ H 2 → μ x = 23 · 2 = 46 г м о л ь
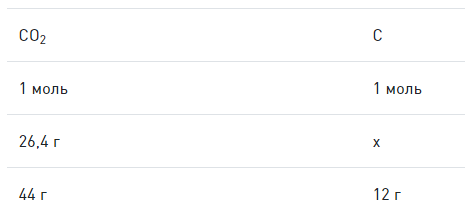
Далее необходимо вычислить массу углерода путем составления пропорции:
Аналогичным способом можно определить массу водорода:
Согласно закону сохранения массы, масса кислорода составит:
Далее нужно определить количество молей атомов элементов:
Согласно закону отношений:
После деления чисел из последнего выражения на 0,3, получим:
Таким образом, получается простейшая формула:
μ C 2 H 6 O = 24 + 6 + 16 = 46 г м о л ь
Необходимо вычислить, какой объем занимает 0,2 моль N 2 при нормальных условиях.
ν ( N 2 ) = V ( N 2 ) / V m
V ( N 2 ) = ν ( N 2 ) · V m = 0,2 моль · 22,4 л / моль = 4,48 л
Нужно определить объем, занимаемый 56 г газа СО при н.у.
ν ( C O ) = V ( C O ) / V m
V ( C O ) = ν ( C O ) · V m
Неизвестное количество вещества можно рассчитать по формуле:
M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль
ν (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO ) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Требуется рассчитать объем, занимаемый 8 г газа O 2 при нормальных условиях.
В первую очередь следует определить количество молей в заданной массе кислорода:
Объем газа составит:
Молярная масса кислорода O 2 :
Таким образом, можно определить:
Газообразное вещество массой 1 г при нормальных условиях занимает объем 1,32 л. Необходимо вычислить, какова относительная плотность этого газа по хлору.
Количество вещества данного газа составляет:
Можно записать другую формулу для расчета количества вещества:
В результате, правые части уравнений допустимо приравнять и определить молярную массу газа:
Относительная плотность газа по хлору:
D = μ μ C l = m V μ μ C l V
Молярная масса хлора:
После перевода единиц в систему СИ получим:
Далее можно рассчитать относительную плотность:
Один моль вещества содержит число Авогадро молекул:
Количество молей углекислого газа:
Объем, который занимает газообразное вещество, составит:
V = ν V μ = N N A V μ
Количество молекул, содержащееся в массе m вещества, можно найти с помощью следующего отношения:
Молярная масса фтористого водорода:
После перевода в СИ, получим, что масса фтористого водорода:
Объем, который занимает газообразный фтор с аналогичным количеством молекул, равен:
V = ν V μ = N N A V μ
Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
pV = νRT
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.