Что такое обызвествление мягких тканей коленного сустава
Что за патология обызвествление связок коленного сустав?
Содержание:

Петрификаты в коленных суставах преимущественно скапливаются в менисках, важных компонентах крупного сустава организма, а также незаменимых амортизаторахпри движении человека. Остеоартроз коленных сочленений имеет начало непосредственно с развития дегенеративного процесса и кальцинирования. В случае прогрессирования патпроцесса в них развивается уменьшение артрощели и ухудшается состояние самого артрсоединения и больного. Повреждение кальцификатами менисковых структур и крестовидных связочных волокон понижает устойчивость сустава и выступает непосредственной причиной запуска остеоартрозного процесса.
Этиологические сведения
Причинные факторы до настоящего времени не выяснены. Но несомненен тот факт, что откладывание кальция случается в областях с недостаточным кровоснабжением, вследствие изнашивания сухожильных волокон, их травматизации и возрастных трансформаций, в т.ч. системных патологий соединительной ткани.
Обызвествления связочного аппарата травматической природы достаточно известны в травматологической практике. Преимущественно они развиваются вследствие острого травмирования (ушиба, растяжения) и представлены на рентгенснимке в виде парасуставных теней. Параартикулярные ткани колена зачастую подвергаются прямому действию травмы, разрывам вследствие чрезмерного насильственного двигательного акта в сочленении.
С таким происхождением обызвествления в основном развиваются спустя 3-4 недели после травмирования, в некоторых случаях и позднее. Достаточно часто развиваются кальциевые депозиты в образовавшихся гематомах.
Симптоматические проявления
Началом заболевания следует считать возникновение неинтенсивных болевых ощущений в суставной области. В последующем болевой синдром интиенсифицируется, ограничивается амплитуда активных двигательных актов в артрсоединении. Характерным признаком выступает усиление болевого ощущения в суставном сочленении при поднятии конечности и ночью.
Болезнь Пеллегрини-Штида
Это заболевание представляет собой обызвествление либо оссификация у медиального мыщелка бедра. Оно первоначально опсывалось Пеллегрини и Штид в 1905-1908 г.г. Это кальциевое депо на рентгенснимке представляется по типу костной плотности треугольной, крючкоподобной тени, которая располагается преимущественно параллельно контуру метафиза. Тень отделяется от костной структуры светлой прослойкой, размеры ее — от 6 до 20 мм.
Такое обызвествление располагается в сухожильной ткани большой приводящей мышцы у медиального мыщелка бедра. Иногда оно не ограничивается сухожильными волокнами, а генерирует на боковую большеберцовую связку и бурсу. Кальцинаты отделены от костной структуры мембраной, которая покрывает мыщелок.
Причиной возникновения кальциевых депозитов у медиального мыщелка бедра в большей части выступает непосредственное одномоментное травмирование (удар, ушиб), либо повторное, опосредованное и слабое — растяжение связочного аппарата и др. В определенных вариантах исключается травматическое воздействие и часть исследователей считают причинным фактором такого образования дегенеративные трансформации в сухожильных волокнах, которые возникают в результате хронического микротравмирования – постоянных растяжений и др.
Тень у медиального бедренного мыщелка — это локализованный процесс травматической природы, который представляет собой либо обызвествление, либо оссификацию сухожилия большой приводящей бедренной мышцы, с незначительной симптоматической картиной.
Диагностирование
Постановка соответствующего диагноза осуществляется на основе анамнестических сведений и результатов физикального осмотра коленного сустава, при котором особое внимание уделяют наличию болезненности при пальпировании и ограниченности в совершении двигательных актов.
Обязательно проводится рентгенологическое обследование сустава, позволяющее визулизировать кальциноз в сухожильных волокнах колена. На начальных этапах патологического процесса видны кальциевые депозиты. В случае необходимости проводится МРТ суставного сочленения.
Терапевтический подход

Рекомендации по лечению болезней депонирования ПФК
Применение лекпрепаратов группы НПВС в соответствии с преморбидным фоном больного (в соответствии с наличием сопутствующих патологий).
Что такое обызвествление мягких тканей коленного сустава
а) Определение:
• Группа заболеваний, при которых отложения кристаллов могут проявляться изолированными объемными образованиями, имитирующими мягкотканные опухоли
1. Общая характеристика:
• Лучший диагностический критерий:
о Изменения в прилежащих костях и суставах, а также данные лабораторного анализа облегчают дифференциальную диагностику
2. Рекомендации по визуализации:
• Лучший метод визуализации:
о Для оценки обызвествленных объемных образований и сопутствующих изменений в прилежащих костях лучше использовать рентгенографию и КТ
о В некоторых случаях при сомнительных результатах вышеупомянутых исследований МРТ с контрастным усилением может облегчить дифференциальную диагностику с опухолями
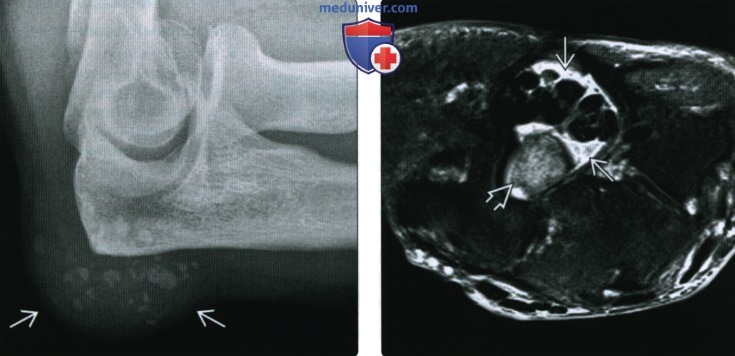
(Справа) При МРТ запястья в аксиальной плоскости на ППВИ в режиме FS визуализируется жидкость вокруг синовиального влагалища сухожилий ладонной поверхности кисти. Зона аморфной структуры может быть ошибочно расценена, как мягкотканное новообразование. Однако она соответствует скоплению кристаллов кальция пирофосфата дигидрата. 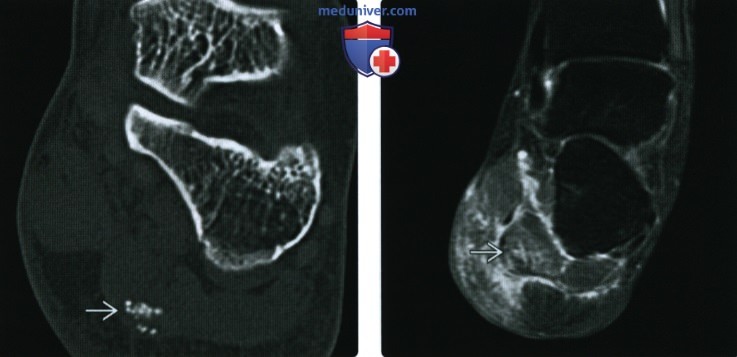
(Справа) У этого же пациента при МРТ в коронарной плоскости на ППВИ в режиме FS в коротком сгибателе пальцев визуализируются гипоинтенсивные кальцификаты. В прилежащих отделах мышцы, фасции и подкожной жировой клетчатки также выявляется негомогенно гиперинтенсивный сигнал. МРТ позволяет подтвердить отсутствие объемных образований. При биопсии было выявлено, что эти изменения соответствуют отложению кристаллов кальция пирофосфата дигидрата. 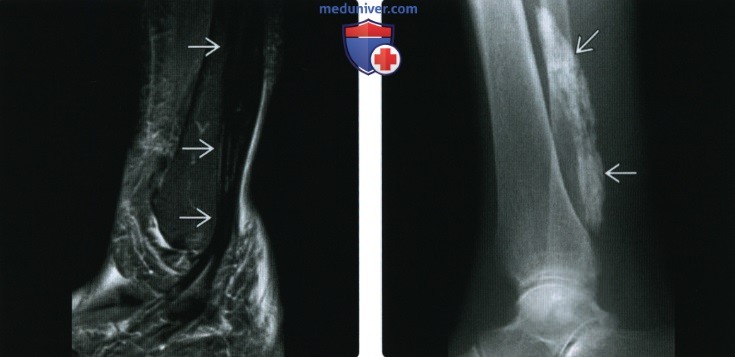
(Справа) Рентгенография в боковой проекции, этот же пациент: в области ожидаемого расположения сухожилия длинной малоберцовой мышцы визуализируется плотное гомогенное обызвествление, служащее при МРТ источником гипоинтенсивного сигнала. Обызвествление обусловлено отложением в сухожилии гидроксиапатита.
в) Дифференциальная диагностика болезней отложения кристаллов, симулирующей опухоль мягких тканей:
1. Подагра:
• Метаболическое заболевание, характеризующееся гиперурикемией
• Отложения мононатрия урата в мягких тканях = тофусы
• Стопы, кисти, лодыжки, локти, колени и позвоночник
• Рентгенография: объемное образование в мягких тканях юкстаартикулярной локализации ± кальцификаты:
о Признаки сопутствующей артропатии
• КТ: облегчает визуализацию кальцификатов в тофусах:
о Узурация прилежащих костей от давления
• МРТ: объемное образование с интенсивностью сигнала от средней до низкой на Т1 ВИ и Т2 ВИ:
о При чувствительных к жидкости последовательностях может характеризоваться гиперинтенсивным сигналом
о Вследствие интенсивного гомогенного или гетерогенного контрастирования может имитировать опухоль
2. Болезнь отложения кристаллов кальция пирофосфата дигидрата:
• Также известна, кактофусная псевдоподагра
• Отложение кристаллов кальция пирофосфата дигидрата в мягких тканях сустава и вокруг него
• Имитирует опухоль, если проявляется обызвествленным объемным образованием в одном суставе
• Рентгенография: обызвествленное объемное образование с четким контуром ± узурация кости
• МРТ: объемное образование с интенсивностью сигнала от средней до низкой на Т1 ВИ и Т2 ВИ
3. Болезнь отложения гидроксиапатита:
• Также известна, как гидроксиапатитная артропатия, кальцифицирующий тендинит, кальцифицирующий бурсит
• Изолированные отложения кальцинатов в сухожилии, синовиальной сумке и периартикулярных мягких тканях:
о Чаще всего в плечевом и тазобедренном суставах
• Рентгенография: зернистые кальцификаты с четким контуром склонные к слиянию:
о ± форма хвоста кометы
• КТ: может выявляться выраженная узурация кости:
о Поражение проксимальных отелов плечевой кости (особенно области прикрепления большой грудной мышцы) и диафиза бедренной кости
о Крайне выражено поражение верхних шейных позвонков
о Отсутствие уровней жидкости
• МРТ: при всех последовательностях отложения кальция характеризуются гипоинтенсивным сигналом:
о В острой фазе наблюдается периферический отек
• Остеосцинтиграфия: повышенный уровень накопления РФП
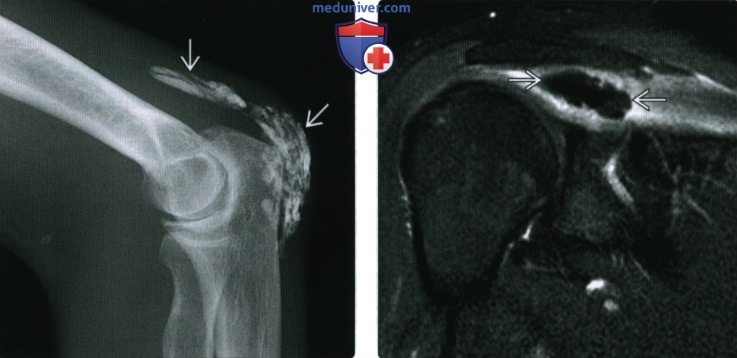
(Справа) При МРТ с контрастным усилением в коронарной плоскости на Т1ВИ в режиме FS в надостной мышце и ее сухожилии визуализируется гипоинтенсивная зона зернистой структуры. Выраженное контрастирование по периферии свидетельствует об интенсивном воспалительном процессе. Гипоинтенсивная зона соответствует отложению гидроксиапатита. 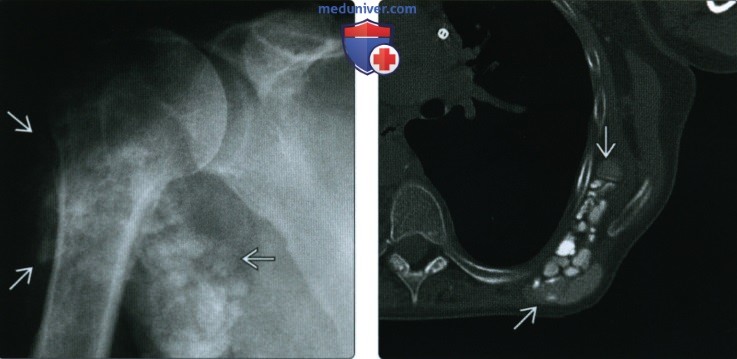
(Справа) Пациент, которому в течение длительного времени проводят гемодиализ. При КТ в аксиальной плоскости между лопаткой и ребрами визуализируется мультикистозное объемное образование. Кисты в различной степени обызвествлены. Такие изменения соответствуют кальцинозу при хронической почечной недостаточности. 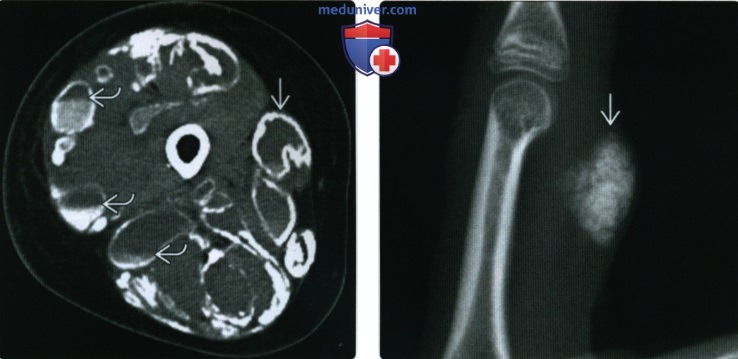
(Справа) Рентгенография указательною пальца в боковой проекции: в поверхностных мягких тканях визуализируется узловое обызвествление. Этот тип отложения кальция, встречающийся при склеродермии, получил название «ограниченный кальциноз». Отложение кальция, обусловленное нарушением метаболизма, может проявляться сходной лучевой картиной.
5. Кальциноз при хронической почечной недостаточности:
• Также известен, как метастатическое обызвествление, вторичный опухолевый кальциноз
• Дистрофическое и метаболическое обызвествление, обусловленное хронической почечной недостаточностью:
о Патологический уровень кальция и фосфатов в сыворотке крови
о Низкая скорость клубочковой фильтрации
о Пациенты, которым проводят гемодиализ
• Аналогичная лучевая картина, как и при опухолевом кальцинозе
6. Системный кальциноз:
• Слоистые отложения кальцинатов в мышцах, фасциях и подкожной клетчатке
• Встречается при полимиозите, дерматомиозите и реже при системной красной волчанке
7. Ограниченный кальциноз:
• Узловые отложения кальцинатов в дерме или подкожной клетчатке
• Встречается при заболеваниях соединительной ткани и метаболическом обызвествлении любой этиологии
г) Диагностическая памятка. Советы по интерпретации изображений:
• Данные лабораторного анализа и анамнеза позволяют сузить дифференциальный ряд
д) Список использованной литературы:
1. McKenzie G et al: Pictorial review: Non-neoplastic soft-tissue masses. Br J Radiol. 82(981):775-85, 2009
2. Kransdorf MJ et al: Masses that may mimic soft tissue tumors. In Kransdorf MJ et al: Imaging of Soft Tissue Tumors. 2nd ed. Philadelphia: Lippincott Williams & Wilkins. 524-9, 2006
3. Olsen KM et al: Tumoral calcinosis: pearls, polemics, and alternative possibilities. Radiographics. 26(3):871-85, 2006
4. Flemming DJ et al: Osseous involvement in calcific tendinitis: a retrospective review of 50 cases. AIR Am J Roentgenol. 181(4):965-72, 2003
Редактор: Искандер Милевски. Дата публикации: 28.5.2021
Поражение суставов и мягких тканей при депонировании кристаллов кальция
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Научно-практический интерес к кристаллам кальция связан с их участием в патогенезе остеоартроза (ОА) и хронического периартикулярного поражения. Кристаллы кальция – постоянная находка при ОА в хряще и синовиальной жидкости. При гонартрозе они идентифицируются у 65% больных и являются главным критерием диагноза болезни депонирования кристаллов пирофосфата кальция (ПФК).
ПФК представляет собой важнейший промежуточный метаболит в синтезе протеогликанов и коллагена. Он в большом количестве образуется хондроцитами, но быстро разрушается неорганической пирофосфатазой (КФ. 3.6.1.1). Полагают, что при болезни депонирования ПФК в суставном хряще локально нарушается обмен пирофосфата: повышается его образование или снижается активность пирофосфатазы. В результате формируются кристаллы дигидрата ПФК, которые откладываются первоначально в толще суставного хряща, затем на его поверхности, а в последующем – в синовиальной оболочке и периартикулярно. Считается, что ингибирование пирофосфатазы при некоторых указанных патологических процессах может быть обусловлено повышенным содержанием железа и меди, которые служат ядрами кристаллизации.
Свободные кристаллы ПФК активируют систему комплемента и как хемотаксический фактор в нейтрофилах вызывают их приток в синовиальную оболочку и суставную полость. При фагоцитозе кристаллов нейтрофилами они выделяют лизосомные ферменты и медиаторы воспаления, резко усиливается и секреция ими кислородных радикалов. В результате в синовиальной оболочке возникает воспалительная реакция. Кроме того, в развитии синовита принимают участие продукты разрушения дегенеративно измененного хряща и фрагменты известковых отложений, выходящие в синовиальную жидкость при травме, хронической микротравматизации. Не исключается также возможная роль отложений кристаллов ПФК в синовиальной оболочке, которые иногда наблюдаются при хондрокальцинозе (ХК). Инкрустация хряща кристаллами ПФК постепенно приводит к разрушению его матрикса, гибели хондроцитов, дегенеративным изменениям хряща и формированию вторичного ОА. Наряду с этим при длительном течении и частых рецидивах артрита развивается фиброз синовиальной оболочки и околосуставных мягких тканей.
По данным исследования in vitro, кристаллы ПФК оказывают провоспалительное и катаболическое действие на культуру хондроцитов и синовиоцитов больных ОА, судя по индукции в пробах оксида азота (NO), матричной металлопротеиназы-13 (MMP-13) и простагландина E2 (PGE2) [1]. Те же самые процессы наблюдали при помещении в клеточные культуры синтетических дигидрофосфата и ПФК. Авторы полагают, что кристаллы кальция могут непосредственно вызывать деградацию хряща и синовит при ОА.
Диагностика
При подозрении на отложение кристаллов ПФК следует анализировать у пациента факторы риска и сопутствующие болезни, включая ОА и травмы суставов в анамнезе. В возрасте до 60 лет необходимо диагностировать метаболические болезни с нарушением кальциевого обмена (первичный гиперпаратиреоидизм, гипомагниемия, гемохроматоз) и семейную предрасположенность, особенно в случаях полиартикулярного поражения.
Подтверждают депозицию ПФК поляризационной световой микроскопией в виде характерных кристаллов (в форме параллелепипеда, преимущественно внутриклеточных, со слабым светоотражением или его отсутствием) в синовиальной жидкости. Следует учитывать, что при исследовании в поляризованном свете определяется только примерно 1/5 часть всех кристаллов ПФК. Для визуализации кристаллов ПФК в синовиальной жидкости применяются ализариновый красный краситель и набор для окраски по Коссу, но чувствительность данных методов вызывает сомнение. В последнее время для детекции кристаллов кальция предлагается использовать люминесцентную микроскопию с применением кальцийчувствительного флуоресцентного зонда Fluo-4. Данный метод позволяет проводить и проточную цитометрию для быстрого полуколичественного анализа.
Рентгенологически выявляемый ХК подтверждает наличие депозитов ПФК, но его отсутствие не исключает их. Рентгенограммы соответствующего качества являются легким способом возможного обнаружения депозитов ПФК как в суставных, так и в периартикулярных тканях. Рентгенологическая картина ХК напоминает деформирующий ОА, но с другой локализацией изменений. Отличительный признак ХК – обызвествление хряща как крупных опорных, так и мелких суставов, а также суставной капсулы и мягких тканей. Как правило, в начале болезни наблюдаются поражение одного или обоих (медиального и латерального) бедренно-большеберцовых сочленений и тяжелое поражение бедренно-надколенникового сочленения (иногда бывает изолированным). Заподозрить ХК позволяет слабовыраженное обызвествление суставов запястья и кисти и суставного диска лучезапястного сустава.
Рентгенологические признаки ХК: обызвествление связок, сухожилий, суставной капсулы, синовиальной оболочки и околосуставных мягких тканей, выраженное симметричное сужение суставной щели, непропорционально крупные субхондральные кисты, субхондральный остеосклероз, мелкие остеофиты (их размер не соответствует выраженному сужению суставной щели и изменению субхондральной кости), двустороннее поражение суставов – системный процесс, снимок таза в прямой проекции позволяет определить начинающееся обызвествление хряща в верхнебоковых отделах головки бедренных костей, крестцово-подвздошных суставах и лобковом симфизе, типичная картина поражения позвоночника – обызвествление фиброзного кольца и студенистого ядра многих дисков. Эти изменения напоминают спондилоартроз, однако они более выраженные и распространенные.
Сцинтиграфия и магнитно-резонансная томография (МРТ) в диагностике ХК больше не применяются, поскольку обызвествление дисков и связок лучше видно при компьютерной томографии (КТ). Предварительный диагноз, как правило, ставят на основании рентгенологических изменений и подтверждают наличием кристаллов в синовиальной жидкости.
Ультразвуковое исследование на аппаратах высокого разрешения может визуализировать депозиты кристаллов ПФК, обычно в виде гиперэхогенной ленты внутри гиалинового хряща и гиперэхогенных включений в фиброзной части хряща, в 68,7% случаев ХК.
Клинические формы болезни депонирования ПФК
Отложение кристаллов ПФК характеризуется большим спектром клинических фенотипов – от бессимптомной формы до острой (псевдоподагра) и хронической (ОА с депозицией кристаллов ПФК, хронический артрит с кристаллами ПФК, ХК).
Острый артрит, или псевдоподагра, составляет 25% случаев болезни депонирования ПФК. Распространенность среди пациентов 40–79 лет достигает 2,4–4,5%. Острый артрит – результат образования и депонирования кристаллов ПФК в суставах с развивающимся в этой связи воспалением иммунного характера. Псевдоподагра характеризуется болью, гиперемией и отеком сустава, достигающими пика за 12–36 ч. Встречается с равной частотой у мужчин и женщин. Приступ псевдоподагры характеризуется менее выраженным болевым синдромом и медленнее достигает пика клинических проявлений по сравнению с подагрой. Как правило, поражается 1 сустав (в 50% случаев коленный), хотя описаны случаи олиго- и полиартритических атак псевдоподагры. Острая атака псевдоподагры с поражением лучезапястного сустава может привести к развитию запястного туннельного синдрома. Приступ псевдоподагры проходит самостоятельно (без лечения) в течение 1 мес., в период между атаками клинически не проявляется.
Идиопатическая псевдоподагра отмечается у пациентов в возрасте, как правило, старше 55–60 лет. Важную роль в возникновении острой атаки играют изменения электролитного баланса с колебаниями концентрации кальция в сыворотке крови. Как и при истинной подагре, провоцирующими факторами могут быть травма, хирургическое вмешательство, нарушение мозгового кровообращения и инфаркт миокарда. Отмечена сезонность – приступы достоверно чаще возникают весной.
Хронический артрит с кристаллами ПФК составляет 5% болезней депонирования ПФК. Он предполагает наличие суставного синдрома с системным воспалением (подъем уровня С-реактивного белка и увеличение скорости оседания эритроцитов), утренней скованности, семейного артрологического анамнеза. Суставной синдром проявляется симметричным поражением пястно-фаланговых (обычно II–III пальцев), коленных, лучезапястных и локтевых суставов. Воспалительный процесс вялотекущий, может длиться недели и месяцы. При осмотре обнаруживают ограничение подвижности сустава и сгибательную контрактуру (псевдоревматоидная деформация). У 10% больных, как и у здоровых пожилых людей, определяется ревматоидный фактор в низком титре.
ОА с депозитами ПФК возникает у пациентов с уже имеющимися клиническими и рентгенологическими признаками ОА, однако, в отличие от него, рентгенологически обычно обнаруживают ХК. При этом, в отличие от ОА без кристаллов ПФК, наблюдаются больше воспалительных признаков и атипичное поражение (лучезапястный или среднезапястный, плечевой, суставы средней части стопы), менее выраженный остеофитоз и кистовидная перестройка.
При ОА с депозитами ПФК развиваются выраженные дегенеративные изменения в пястно-фаланговых, лучезапястных, локтевых, плечевых и коленных суставах. Чаще поражается латеральная часть коленного сустава, с двусторонней или односторонней вальгусной деформацией или «стучащими коленями». Нередко наблюдается также изолированный пателлофеморальный ОА. Характерные признаки ОА с депонированием ПФК – сгибательная контрактура пораженных суставов и симметричность процесса. Более чем у 50% больных периодически наблюдаются приступы псевдоподагры.
Значение депонирования ПФК
в менисках коленных суставов
Излюбленная локализация депозитов кристаллов ПФК – мениски коленных суставов. Последние играют жизненно важную роль в передаче нагрузки, амортизации и стабильности сустава. Дегенерация и кальцификация менисков – ключевые особенности ОА коленных суставов. Появляется все больше данных, что мениски коленных суставов не остаются пассивными в процессе развития ОА. Дегенерация менисков способствует сужению межсуставной щели. Кальцификация менисков нарастает с возрастом и коррелирует с поражением хряща у лиц без симптомов артрита в анамнезе. Высказывается предположение, что кальцификация менисков и крестовидных связок с провокацией воспаления и потерей стабилизирующей сустав функции может первично инициировать ОА коленных суставов. Тем не менее следует отметить, что больным с ОА и депозитами кристаллов ПФК не требовалась более ранняя артропластика по сравнению с пациентами без ПФК.
Болезнь депозитов ПФК другой локализации
Кристаллы ПФК могут откладываться и в позвоночнике. Депозиты кристаллов обнаруживаются при КТ или МРТ и часто интерпретируются как спондилодисцит или остеомиелит. Клинически проявляется, как правило, ригидностью позвоночника, иногда вместе с костным анкилозом или диффузным идиопатическим гиперостозом. Может быть люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска. Описываются клинические проявления депозитов ПФК в шейном отделе позвоночника, височно-нижнечелюстном суставе, лобковом симфизе.
Хондрокальциноз – кальцификация суставного хряща, которая чаще не сопровождается клиническими проявлениями. Старение – главный фактор риска спорадического ХК. В возрасте около 60 лет распространенность ХК составляет 7–10%, у лиц в возрасте 70 лет – около 15%. Ко вторичному ХК предрасполагают гемохроматоз, гиперпаратиреоидизм и гипомагниемия. ХК выявляется рентгенологически, но достоверный диагноз должен быть подтвержден наличием кристаллов ПФК. Присутствие кристаллов ПФК коррелирует с рентгенологическими признаками дегенерации гиалинового хряща. Но большее патогенетическое значение при ОА, как полагают, имеют депозиты кристаллов ПФК в менисках.
Артроскопия при ХК позволяет определить отсутствие депозитов ПФК в синовиальной оболочке, морфологические признаки воспаления при этом менее выражены, но участки атрофии обширны. Мелкоточечные депозиты ПФК обнаруживаются в суставном хряще у всех больных с ХК. У большинства обследованных старше 40 лет имелись также признаки ОА.
Болезнь депонирования кристаллов основного фосфата кальция (ОФК) – это комплекс патологических процессов, обусловленных эктопическим отложением ортофосфатов кальция.
Отложение в тканях кристаллов ОФК описывается при многих состояниях, в т.ч. при хронической почечной недостаточности, у пациентов на длительном гемодиализе. Кристаллы ОФК присутствуют в мягких тканях при системной склеродермии, дерматомиозите. С ними связывают обызвествление сухожильно-связочного аппарата при болезни Форестье и спондилоартрите. Кальцификации подвергаются, как правило, часто травмирующиеся и плохо васкуляризованные участки сухожилий, иногда с очагами некроза. Кальцификация околосуставных тканей наблюдается как следствие предшествующих внутрисуставных инъекций глюкокортикоидов.
Значение кристаллов ОФК при ОА
Кристаллам ОФК отводится решающая роль в энхондральной оссификации. По данным исследования, на рентгенограммах 120 больных с ОА IV стадии (кандидаты на артропластику) отмечена минерализация во всех случаях [2]. Ее степень не коррелировала с возрастом пациентов, но присутствовала и высокая корреляция степени минерализации на рентгенограммах и способности хондроцитов синтезировать кристаллы ОФК in vitro. Экспериментальная индукция гипертрофии хондроцитов у здоровых людей сопровождается очевидной минерализацией внеклеточного матрикса. Значит, минерализация суставного хряща кристаллами ОФК – патогномоничный признак ОА, а не проявление болезни у определенной категории больных. Следует, однако, отметить, что физиологическая минерализация хрящевой ткани происходит во время продольного роста костей при энхондральном окостенении пластинок роста с дифференциацией хондроцитов, когда последние быстро размножаются, формируя модель костной структуры, и выделяют основные белки внеклеточного матрикса, такие как коллаген II типа и агрекан. По мере завершения структуризации хондроциты прекращают делиться и резко увеличиваются в объеме. В рамках гипертрофической дифференциации изменения затрагивают секрецию коллагена Х типа, который, наряду с другими факторами, способствует минерализации матрицы и оccификации хряща.
Роль кристаллов ОФК при тендините
Клинически болезнь отложения кристаллов ОФК проявляется главным образом кальцифицирующим тендинитом и бурситом, преимущественно у женщин в 4–5-й декаде жизни.
Наиболее клинически значимая кальцификация связок – тендинит надостной мышцы и других связок манжеты ротаторов, тендинит сухожилий в области большого вертела бедренной кости, эпикондилит, тендинит в области коленного сустава. Для скрининговой диагностики кристаллов ОФК рекомендована окраска ализариновым красным, однако чувствительность и специфичность метода невысоки.
Частота рентгенологической диагностики депозитов кристаллов ОФК варьирует в пределах 2,7–20%.
Из сухожилий манжеты ротаторов плеча чаще всего поражается сухожилие надостной мышцы. Острая, усиливающаяся ночью боль во время резорбции приводит к нарушению трудоспособности. Как правило, эти симптомы разрешаются в короткое время. Терапия во время этой фазы направлена только на устранение боли. В ряде случаев заболевание приобретает хронический характер. Если боль становится клинически значимой, то к традиционному лечению кальцифицирующего тендинита надостной мышцы можно добавить низкоэнергетическую экстракорпоральную ударно-волновую терапию.
Особой формой болезни депонирования ОФК является синдром Милуоки – тяжелое дегенеративное поражение крупных, обычно плечевых, суставов, напоминающее нейроартропатию Шарко, чаще развивается у женщин после 70 лет. Боль обычно усиливается в ночное время и при нагрузке на сустав. Деструктивные изменения затрагивают все суставные структуры: периартикулярную ткань, связки, хрящ, кость.
Пока рано говорить о лечебном вмешательстве, препятствующем минерализации хряща, однако средства, уменьшающие рост кристаллов кальция, такие как кальция фосфоцитрат или бисфосфонаты I поколения, можно теоретически рассматривать в качестве возможной новой стратегии для подавления дальнейшего образования кристаллов ОФК и уменьшения клинической симптоматики.
Лечение
EULAR были сформулированы рекомендации по профилактике и лечению болезней, связанных с депозитом ПФК [3]. Так, в случае острого артрита с кристаллами ПФК оптимальное лечение включает холодовые аппликации, покой, аспирацию синовиальной жидкости и внутрисуставное введение длительно действующих глюкокортикоидов. Эффективны нестероидные противовоспалительные препараты (НПВП) перорально и низкие дозы колхицина (0,5 мг 3–4 р./сут с начальной дозой в 2 мг или без нее), но применение лимитируется их токсичностью и наличием коморбидности.
ОА с пирофосфатной кальцификацией протекает с упорным болевым и воспалительным синдромом, обусловливая почти постоянную потребность в НПВП, который должен обладать достаточно выраженной противовоспалительной активностью (не только подавляя синтез провоспалительных цитокинов (IL-1b, IL-6, TNF-α, PGЕ2) в синовии, но и ингибируя фагоцитарную и хемотаксическую активность моноцитарных макрофагов), а также не оказывать негативного воздействия на метаболизм хондроцитов. Учитывая пожилой возраст этих больных, следует назначать НПВП, обладающий доказанным в клинических исследованиях профилем безопасности и не увеличивающим риск сердечно-сосудистых осложнений.
Таким препаратом зарекомендовал себя кетопрофен. Это традиционный НПВП, который широко используется в мировой клинической практике с 1971 г. По литературным данным, это один из препаратов с наилучшим сбалансированным профилем терапевтического действия и относительной безопасности, основной препарат для лечения острой и хронической боли при различной патологии. Анализ европейских продаж НПВП, в т.ч. и кетопрофена, например, в Италии, показал, что за период с 2006 по 2009 г. его популярность выросла на 93% [4].
Кетопрофен имеет короткий период распада, быстро метаболизируется и выводится организмом, как продемонстрировано в клинике и эксперименте, что позволяет избегать его кумуляции. Это свойство препарата особенно важно при лечении суставного синдрома у пожилых пациентов. Анальгетический эффект кетопрофена используют при ургентной патологии, в т.ч. при острой послеоперационной боли, ортопедических и стоматологических операциях и манипуляциях, снижая дозозависимый эффект наркотических средств. Препарат эффективен при купировании приступов мигрени. Данные приведенных исследований анальгетического эффекта весьма убедительны [5–7]. Как показала мировая практика, кетопрофен широко применяется в качестве патогенетического средства в ревматологии для лечения пациентов с острым и хроническим суставным синдромом.
Учитывая характер обсуждаемой нами патологии, а именно пирофосфатную артропатию в структуре микрокристаллического артрита, помимо анальгетического эффекта кетопрофена необходимо отметить и его противовоспалительное действие. Прием кетопрофена патогенетически оправдан в первую очередь для купирования острейшего подагрического артрита. У 92% пациентов из 59% с острым подагрическим артритом, которые применяли кетопрофен по 300 мг/сут в течение 7 дней, значительное облегчение отмечено уже к концу первого дня [8].
В европейском проспективном открытом исследовании (20 тыс. больных в основном пожилого возраста с костно-мышечной патологией, из которых около 80 пациентов были с ОА) эффект приема кетопрофена по 200 мг/сут в течение 1 мес. был оценен пациентами как хороший и очень хороший. Осложнения со стороны желудочно-кишечного тракта (ЖКТ) зафиксированы суммарно у 13,5%, а язва и кровотечение – у 0,03%, что не превышает показатели подобных осложнений при применении других препаратов этой группы [9].
Врачу и пациенту следует помнить, что использование препаратов данной группы требует постоянного внимания и контроля самочувствия. Как европейские, так и российские исследования и типичная практика использования кетопрофена показали хорошее лечебное действие и высокий уровень безопасности [10, 11].
Обобщенные результаты, указанные в этих последних статьях и многих других исследованиях, позволили выделить клинические достоинства современных лекарственных форм кетопрофена, благодаря чему его можно использовать как для ургентного обезболивания, так и для терапии остро возникшего суставного синдрома, при остром приступе подагры и длительной терапии хронических болевых синдромов, наблюдающихся при хронических ревматических болезнях, в т.ч. при болезни депонирования кристаллов ПФК и др. Риск серьезных ЖКТ-осложнений при использовании кетопрофена не превышает аналогичный показатель для диклофенака, мелоксикама и нимесулида (по данным масштабного эпидемиологического исследования, Финляндия). Кетопрофен в минимальной степени влияет на вероятность кардиоваскулярной катастрофы.
При неэффективности терапии острого или хронического артрита с кристаллами ПФК может быть использован короткий курс глюкокортикоидов внутрь, а также адренокортикотропный гормон перорально или парентерально (по 40–80 ЕД внутримышечно через 12 ч по необходимости, обычно 1–3 инъекции).
Профилактику частых атак артрита с кристаллами ПФК можно проводить низкими дозами колхицина (0,5–1 мг ежедневно) или низкими дозами НПВП, в т.ч. кетопрофена, с гастропротекцией при необходимости.
Ведение и лечение больных ОА с кристаллами ПФК такое же, как и больных ОА без кристаллов. При хроническом воспалительном артрите – НПВП (при необходимости гастропротекторная терапия), колхицин (0,5–1 мг в сутки), низкие дозы глюкокортикоидов, метотрексат и гидроксихлорохин. Предполагается, что метотрексат как противовоспалительный препарат может быть эффективен в дозе 10–20 мг/нед. при неуспехе других методов лечения.
В настоящее время не созданы препараты, модифицирующие формирование кристаллов ПФК или позволяющие их растворять. Бессимптомные депозиты ПФК не являются показанием для терапии. Теоретически ингибировать кальцификацию можно воздействием либо на отложение кальция (физическая цель), либо на клетки (биологическая мишень). Ориентация терапии на клеточный, эпигенетический или генетический уровень не только будет препятствовать образованию и росту отложений кальция, но и конвертировать измененные при ОА клетки хряща и мениска в более физиологически функционирующее состояние.
Учитывая патогенез болезней депонирования ПФК, представляется перспективным исследование широкого спектра локальной антифлогистической (противовоспалительной) терапии, начиная с таких известных средств, как препараты гиалуроновой кислоты и метотрексат.
Представленные данные позволяют по-новому взглянуть на такую клиническую ситуацию, как болезнь депонирования кристаллов ПФК. Во второй части разбираются рекомендации EULAR по лечению, особый акцент сделан на высокий терапевтический потенциал кетопрофена в качестве патогенетического средства для купирования воспаления при суставном синдроме.