Что такое очаговый фиброз желудка
Хронический атрофический гастрит (K29.4)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
I. По локализации:
— антральный гастрит;
— гастрит (преимущественно или только) тела желудка;
— мультифокальный гастрит.
II. По морфологии.
Для морфологической оценки хронического гастрита российские авторы (Аруин Л.И., Капуллер Л.Л., Исаков В.А., 1998) предлагают использовать визуально-аналоговую шкалу. При ХПГ данная шкала позволяет оценить степень выраженности воспаления с помощью полуколичественных критериев.
Визуальная аналоговая шкала морфологической оценки хронического гастрита
| Признак | Норма | Слабая | Умеренная | Выраженная |
| Обсеменение H.pylori | ||||
| Инфильтрация нейтрофилами | ||||
| Хроническое воспаление | ||||
| Атрофия привратника | ||||
| Атрофия тела желудка | ||||
| Кишечная метаплазия |
Примечание к таблице. В данной таблице отмечается наличие морфологических признаков согласно прилагаемому ниже изображению.
Хроническое воспаление, вызванное Н. pylori: в настоящее время считается, что при исследовании (объектив Х40) СОЖ содержит в норме не более 2-5 лимфоцитов, плазматических клеток и макрофагов в поле зрения или 2-3 мононуклеара в одном валике. Наличие 1-2 плазмоцитов в поле зрения уже свидетельствует о хроническом воспалении.
Не требуют полуколичественной оценки, но указываются следующие признаки: потеря муцина, наличие лимфатических узелков, фовеолярная гиперплазия, пилорическая метаплазия, панкреатическая метаплазия, гиперплазия эндокринных клеток.
В зависимости от степени распространенности дистрофически измененных клеток среди «нормальных» клеток поверхностного эпителия в поле зрения, а также от глубины проникновения воспалительной инфильтрации в толщину слизистой оболочки, среди поверхностных гастритов выделяют:
— слабо выраженный (первая стадия воспалительной активности);
— умеренно выраженный (вторая стадия воспалительной активности);
— сильно выраженный (третья стадия воспалительной активности).
В классификации ХАГ по выраженности атрофии и ее виду выделены три категории изменений слизистой оболочки желудка (СОЖ).
3. Атрофия желудочных желез. Подразделяется на два главных типа:
3.1 Метапластический тип атрофии характеризуется утратой желудочных желез, свойственных данному отделу, с замещением их кишечными, а применительно к слизистой оболочке тела желудка – пилорическими железами.
3.2 Неметапластический тип атрофии: в слизистой оболочке сохраняются железы, характерные для соответствующего отдела желудка, но наблюдается уменьшение объема железистой ткани. Железы становятся редкими и неглубокими. Наблюдается фиброз и фибромускулярная пролиферация собственной пластинки слизистой оболочки.
В данной классификации сохранена полуколичественная оценка степени тяжести атрофии: слабая, умеренная и тяжелая.
При практическом использовании эта классификация показала очень высокий уровень согласованности в интерпретации гистологической картины (до 78%) между разными морфологами. По критериям данной классификации большинство патологоанатомов одинаково оценивали состояние СОЖ.
При слабой неметапластической атрофии в антральном отделе уменьшается количество и глубина пилорических желез, разделенных фиброзным матриксом, а при тяжелой – пилорические железы практически полностью замещены соединительной тканью.
Умеренная неметапластическая атрофия слизистой оболочки тела желудка сопровождается уменьшением количества главных желез, отмечается углубление желудочных ямок и разрастание соединительной ткани в собственной пластинке слизистой оболочки.
При тяжелой неметапластической атрофии слизистой оболочки тела желудка главные железы полностью отсутствуют.
При тяжелой метапластической атрофии в антральном отделе пилорические железы, а в слизистой оболочке тела желудка – главные железы полностью замещены железами кишечного типа.
Раздельная оценка атрофических изменений в антральном и фундальном отделах желудка имеет высокую клиническую значимость, однако затрудняет интегративное восприятие общего состояния СОЖ. Помимо этого, в категорию неопределенных атрофий попадает большое количество случаев с продолжающейся воспалительной реакцией, а также изолированная атрофия СОЖ без воспаления встречается очень редко.
IV. По степени и стадии хронического гастрита (ХГ).
А
Н
Т
Р
У
М
Хронический атрофический гастрит: что пишет патологоанатом, что должен понять и сделать клиницист
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Пришло время для выступления Алексея Владимировича Кононова из Омска.
Алексей Владимирович Кононов, профессор:
– Дорогие коллеги, мы сегодня поговорим с вами о взаимоотношениях специалистов в таком сложном деле, как канцерпревенция и курации пациентов с предраковыми состояниями и предраковыми изменениями. Центральной проблемой канцерпревенции стоит проблема атрофии слизистой оболочки, которая является феноменом, располагающимся между собственно воспалительными изменениями слизистой оболочки желудка и предраковыми изменениями, которые вот Сергей Владимирович Кашин блестяще демонстрировал и называл дисплазией эпителия. Мне больше нравится термин «неоплазия», который подчеркивает необратимость этих процессов даже в виде низкой степени градации неоплазии. Таким образом, и у патологоанатома, и у клинициста встает один вопрос – это идентификация, детекция атрофии слизистой оболочки желудка и интерпретация этого заключения.
Что делать, когда термин «атрофия», «атрофический гастрит» появляется в патологоанатомическом заключении? На сегодняшний день как будто бы проблем с этим нет. Существует основной классификационный вариант для оценки атрофии слизистой оболочки – это модифицированная сиднейская система, где в визуально-аналоговой шкале эти состояния ранжированы на уровни: нет атрофии, слабая, умеренная, выраженная, как в теле, так и в антральном отделе желудка. Но проблема состоит вот в чем. Проблема состоит в том, что для точной идентификации атрофии даже по модифицированной сиднейской системе необходим не один фрагмент слизистой оболочки, не два фрагмента, а 5 фрагментов, взятых по протоколу: по большой и малой кривизне тела желудка, в области угла желудка и по большой и малой кривизне в антральном отделе желудка. Больше того, когда в 2008 году мы получили новую классификацию хронического гастрита, где атрофия и воспаления оцениваются как интегральные понятия на уровне целого органа, то это взятие биоптата из 5 точек является просто необходимой процедурой, без которой система, которая получила название OLGIM, просто не работает.
Вот это визуально-аналоговая шкала, отечественный вариант ее. По уровню абсцисс и ординат пиктограммы изменения слизистой оболочки – слабая, выраженная, умеренная атрофия в теле, в антральном отделе, а на перекрестии стадия, выраженность на уровне целого органа атрофических изменений. Точно так же построена шкала для оценки воспалительных изменений, которые называются степенью гастрита, там тоже пиктограммы. Смотрите, вот это воспалительный инфильтрат, причем здесь интегрально и нейтрофильные лейкоциты, и мононуклеары, которые, по сути, собой представляют воспалительный ответ слизистой оболочки, и мукозальный иммунитет одновременно. Проблема состоит в том, что появилось новое понимание атрофии слизистой оболочки. Это не просто уменьшение объема желез в теле и антральном отделе, но и замена их метаплазированным эпителием. Это так называемая метапластическая атрофия, и вот ее место в каскаде Пелайо Корреа. Причем сам, кстати, Пелайо Корреа очень положительно относится к этому термину и идентификации кишечной метаплазии с оценкой вместе с атрофией слизистой оболочки. Проблема возникает в другом. Иногда воспалительный инфильтрат настолько раздвигает желудочные железы, что возникает феномен так называемой неопределенной атрофии.
Вот давайте полечим больного, воспалительный инфильтрат рассосется частично в результате апоптоза воспалительных клеток, частично в результате миграции по лимфатическим сосудам, межтканевым щелям и так далее, а потом мы посмотрим. Но если выраженная кишечная метаплазия, то она никуда не исчезнет. Эксперты Маастрихт-4 считают, что метаплазия не подвергается обратному развитию, поэтому вот понимание кишечной метаплазии приобрело некоторое такое мистическое направление. Вдобавок она еще разработана по типам – полная, неполная метаплазия, тонкокишечная, толстокишечная, тип IIA, IIВ и так далее. Все это приводит к тому, что появляются мысли: а не является ли собственно кишечная метаплазия прекурсором, предшественником рака желудка кишечного типа? Ну, по этому поводу написаны горы статей и сломаны многочисленные копья, на сегодняшний день все упирается в Кохрановский обзор от сентября прошлого года. Доказательных, совершенно выстроенных по критериям медицины, основанной на доказательствах, исследований в отношении того, что кишечная метаплазия предрак, нет, поэтому давайте прислушаемся к личному мнению Дэвида Грэхема, который высказывается, как всегда, четко, ясно и совершенно понятно: кишечная метаплазия на сегодняшний день – это надежный показатель атрофии слизистой оболочки. Есть кишечная метаплазия – значит, есть атрофия слизистой оболочки.
Кстати говоря, вот наши прибалтийские коллеги опубликовали в январском номере этого года «Вирховского архива» – уважаемый, авторитетнейший патологоанатомический журнал Европы – такую статью, где они сравнили кишечную метаплазию, взятую в качестве детекции атрофии, и систему OLGIM. Оказалось, что критерий согласия экспертов выше там, где в качестве маркера атрофии применяли кишечную метаплазию. Правда, деликатно замечают наши коллеги, есть стадии атрофического гастрита, когда только кишечной метаплазии для детекции собственно атрофии недостаточно. Что еще пишут про кишечную метаплазию и атрофию? Оказывается, мы можем очень тесно сотрудничать с врачами эндоскопической диагностики. Мы можем говорить об уровне выраженности атрофических изменений, определяя стадию, а врачи эндоскопической диагностики определяют площадь очагов кишечной метаплазии, как это блестяще показал сегодня Сергей Владимирович, и вот это сочетание дает более точный прогноз канцерогенеза у конкретного пациента. Неопластические изменения, собственно, опухолевые уже изменения, когда эпителиальная клетка встала на опухолевый путь. Началось все с падуанских вопросов почти 20 лет назад, все это закончилось хорошо известной вам, уважаемые коллеги, Венской классификацией неоплазии пищеварительного тракта, которая построена, наверное, как образец для всех последующих патологоанатомических и параклинических классификаций.
Вот здесь вот слева обозначены изменения, которые находит врач эндоскопической диагностики и патологоанатом в своем заключении, а справа написано, что должен делать клиницист с пациентом. Определены дефиниции, что такое неоплазия, что такое неоплазия низкой степени, что такое неоплазия высокой степени. Мы можем просто посмотреть, пока я говорю, следующие слайды. Пожалуйста, следующий, еще следующий слайд. Неопределенная неоплазия. Вот так же, как неопределенная атрофия, так и неопределенная неоплазия – то ли это изменения регенеративные, то ли это уже действительно опухолевый процесс. А вот здесь интересная работа, которая опубликована в прошлом году в американском журнале «Клинические патологии», которая нас призывает интегрировать два этих представления – атрофию слизистой оболочки и неопластические изменения. Вот когда мы сумеем интегрировать оба этих понятия в своих заключениях, мы сможем дать точный прогноз. Я хотел бы подчеркнуть, что опухолевые изменения клеток слизистой оболочки желудка возникают не в воздухе, они возникают на фоне и в сочетании с атрофическими изменениями слизистой оболочки вообще.
Какие возможны утешения? Только ли наблюдать? Только ли брать биопсии и ставить диагноз? Сегодня мы знаем новые молекулярные клеточные мишени, открывшиеся сравнительно недавно для хорошо известного препарата на основе ионов висмута. Ну, во-первых, антиоксидантное свойство висмута. Свободные радикалы нейтрофильных лейкоцитов, возникающие при кислородном взрыве в них, нарушают ДНК стволовых клеток слизистой оболочки желудка до уровня двунитевых разрывов. Эти двунитевые разрывы подвергаются репарации, но при этом возникают мутации, накопление которых может закончиться канцерогенезом. Таким образом, препараты висмута в условиях воспалительной инфильтрации слизистой оболочки защищают ДНК, предотвращают процесс маргинализации. Это вторичная профилактика. Опять же, ионный эффект висмута великолепно продемонстрирован в попытке создания нового препарата, где висмут будет в составе растворимого соединения, и ионная активность его будет повышаться.
2 года назад Нобелевскую премию получили молекулярные биологи за изучение серпантинных рецепторов и G-белков, которые являются регуляторными путями клетки. Оказывается, в них вмешивается висмут и запускает в стволовых клетках пролиферативный стимул, и проводя эрадикацию с помощью солей висмута мы попутно решаем и вторую задачу – мы мобилизируем и стимулируем местные стволовые клетки в слизистой оболочке желудка, и если не устраняем атрофию, то по крайней мере препятствуем ее обратному развитию. Что еще появилось нового в отношении ионов висмута как фармакопрепаратов? Появились следующие результаты. Это работа, которая известна пока еще только в препринте, январский номер, она еще не вышла. О чем говорит препринт? Культура ткани и ионы висмута. Оказывается, ионы висмута обладают меньшей степенью повреждения бактериальной клетки Helicobacter рylori, нежели висмут металлический, который нанесен в виде монослоя, атомарный висмут, на носители, которые взаимодействуют с бактериальной клеткой. Нанотехнологии и антибактериальный эффект препаратов висмута – это новое.
Давайте обсудим клинический пример. Пациенту 55 лет, с диспептическими жалобами, выполнена эндоскопическая биопсия слизистой оболочки желудка. Что получил патологоанатом и что он написал? «Два фрагмента слизистой оболочки – тело и антральный отдел». Я хочу обратить ваше внимание – два фрагмента. Дальше патологоанатом по классификационной схеме, модифицированной сиднейской системе описывает ситуацию. Все очень правильно, в каждом кусочке, и он определяет изменения в теле и антральном отделе желудка. Что должен делать клиницист, получив такое заключение? Ну, прежде всего, принять, что верифицирован Helicobacter-ассоциированный атрофический гастрит. Очень хорошо. Затем он должен отметить про себя, что идентифицировать стадию по системе OLGA и. соответственно, риск рака желудка невозможно. О чем еще должен подумать клиницист? Он должен подумать, что, конечно, риск рака желудка есть, особенно если это атрофия у пациента старше 50 лет, но риск не определен. Затем он должен выполнить наверняка эрадикационную терапию, а вот уже когда он будет выполнять контрольное эндоскопическое исследование через 4 недели после окончания эрадикационной терапии, то тут необходимо, просто необходимо взять 5 биоптатов из совершенно точно по протоколу указанных точек и определить стадию атрофии по системе OLGA. Вот так это все выглядит в идеале, а вот так это выглядит в только что рассматриваемом примере, причем это обычная практика.
Давайте посмотрим, как это выглядит вообще на популяционном уровне. Вот посмотрите, 20 тысяч гастробиоптатов от 9 тысяч пациентов, и только 4% исследований могут быть оценены с позиции определения риска рака желудка 3-й, 4-й стадии по классификации OLGA. Давайте посмотрим, что в Америке происходит. Роберт Максимилиан Гента, известный патологоанатом-гастроэнтеролог, эксперт ВОЗ по опухолям пищеварительного тракта, проделал точно такое же исследование, что проделали мы, только в 20 раз больше, там было 400 тысяч биоптатов. Но он получил тот же самый процент: только 4% пригодны для оценки риска рака желудка по современной классификации. Второй клинический пример. У пациента 45 лет при эндоскопическом исследовании верифицирован видимый участок изменений в виде площадки 0,5х0,7 см, из которого взят биоптат. Что пишет патологоанатом? Один биоптат. Патологоанатом пишет: «Морфологические признаки очаговой эпителиальной дисплазии/неоплазии, – ну, «дисплазия» и «неплазия», как мы с вами договорились, это термины-синонимы, – низкой степени (тубулярная аденома с неоплазией низкой степени)».
О чем должен думать клиницист? Не сговариваясь с Сергеем Владимировичем, мы обсудили эту ситуацию, поэтому я могу только прокомментировать. Ну, прежде всего, принять наличие у пациента предопухолевого состояния или даже предопухолевого заболевания. Затем необходимо отметить, что степень риска развития рака желудка определить невозможно. Во-первых, один фрагмент. Взятый рядышком фрагмент может показать дисплазию/неоплазию высокой степени, а еще третий может показать инвазивную карциному. Значит, весь объем образования должен быть представлен достаточно репрезентативно при повторных биопсиях, если нет возможности выполнить мукозальную резекцию так, как это написано в Европейских рекомендациях по предраковым состояниям. Ну, и, наконец, что делать врачу-гастроэнтерологу или терапевту в данной ситуации? Он должен, по крайней мере, заказать повторное исследование для того, чтобы взять биоптаты из визуально измененного участка, а также обязательно 5 биоптатов по системе OLGA для того, чтобы точно определить риск рака желудка у пациента.
Что же должен в ответ вот на эти замечания, которые сделал патологоанатом, выполнить клиницист? Как он должен интерпретировать эту ситуацию? Ну, прежде всего, констатировать успешную эрадикацию, но на этом отнюдь не успокоиться. Он должен отметить, что уровень атрофических изменений остался прежним – что, в общем, не удивительно – и это уровень, который говорит о риске рака желудка, в 5-6 раз большем, чем в популяции. Обратить особое внимание на инфильтрацию нейтрофильными лейкоцитами, то есть активность воспаления. Это скрытая угроза повреждения ДНК стволовых клеток, особенно атрофически измененной слизистой оболочки, опасность канцерогенных мутаций. А что же сделать с пациентом? А обратиться к рекомендациям Российской гастроэнтерологической ассоциации. И я хочу закончить теми же рекомендациями, которые уже цитировал глубокоуважаемый Сергей Владимирович. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута от 4 до 8 недель для обеспечения защиты слизистой оболочки желудка. Благодарю вас, уважаемые коллеги!
Особенности атрофических и дисрегенераторных изменений слизистой оболочки желудка у больных хроническим атрофическим гастритом различных возрастных групп
Клиника госпитальной терапии Военно-медицинской академии имени С.М. Кирова
Интерес исследователей к раннему раку желудка в значительной мере обусловлен тем, что он является своеобразной «переходной» формой между предраковыми изменениями слизистой оболочки желудка и развитым раком желудка, и его изучение позволяет точнее понять морфогенез опухоли и обосновать методы своевременной диагностики и профилактики [8].
Как показали исследования P. Correa, формирование интестинального рака желудка закономерно протекает через ряд последовательных дискретных морфологических стадий: неатрофический гастрит, атрофический гастрит, метаплазия эпителия кишечного типа, прогрессирующая дисплазия и рак insitu, завершающийся инвазивным раком (каскад Корреа). Указанный процесс охватывает обычно период от 20 до 30 лет [11].
Диагноз заболевания верифицировали на основании характерных жалоб, анамнеза, результатов объективного обследования, данных лабораторных и инструментальных исследований. Решающими в постановке окончательного диагноза были данные эзофагогастродуоденоскопии и морфологического исследования слизистой оболочки желудка.
В процессе эндоскопического исследования визуально оценивали наличие, выраженность, распространенность и локализацию воспалительной реакции, очагов атрофии. При воспалительных изменениях слизистой оболочки желудка наблюдали пятнистую гиперемию, отек, подслизистые кровоизлияния, гиперплазию складок. При атрофическом процессе наблюдали бледность, истонченность, повышенную ранимость, сглаженность слизистой оболочки в теле и антральном отделе желудка, просвечивание сосудов.
Прицельные биоптаты слизистой оболочки желудка, полученные при эндоскопическом исследовании, фиксировали в 10% растворе нейтрального формалина, обезвоживали, заливали в парафин, срезы толщиной в 5 мкм окрашивали гематоксилином и эозином и методом ШИК-реакции. Патоморфологические изменения слизистой оболочки желудка оценивали в соответствии с международной классификацией хронического гастрита (Dixon M. Et al., 1996). Оценку выраженности атрофического процесса, кишечной метаплазии и клеточной инфильтрации стромы слизистой оболочки проводили в соответствии с дополнениями к Сиднейской классификации.
Результаты. В работах различных авторов [3, 9, 10] неоднократно указывалась ценность эндоскопического метода исследования в возможности выполнения биопсии с последующим гистологическим исследованием полученного материала. Диагноз “хронический гастрит” должен быть исключительно клинико-морфологическим, а при постановке окончательного диагноза необходимо, прежде всего, ориентироваться на результаты гистологического анализа, поскольку данные эндоскопического и морфологического исследований нередко могут не совпадать. Однако часто в повседневной клинической практике врачи ориентируются только на данные эндоскопического исследования.
В нашем исследовании также проводился анализ эндоскопических и морфологических признаков атрофии слизистой оболочки желудка.
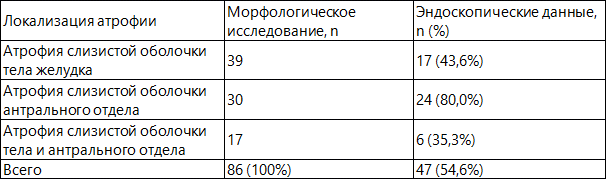
Данные по выявлению атрофических изменений слизистой оболочки желудка, полученные в процессе эндоскопического исследования, в сравнении с морфологическими данными представлены в табл. 1.
Таблица 1. Сравнительная оценка морфологических и эндоскопических данных в диагностике атрофии слизистой оболочки желудка.
Согласно полученным данным, можно утверждать, что при диагностике атрофических изменений слизистой оболочки желудка у больных хроническим гастритом в процессе эндоскопического исследования и морфологического анализа их результаты совпадают лишь в 54,6% случаев. Примерно у половины больных атрофические изменения слизистой оболочки желудка, выявленные морфологическим методом, остаются недоступными для адекватной эндоскопической оценки, что обосновывает необходимость гистологической верификации «гастритического» процесса.
Что такое очаговый фиброз желудка
Изучение заболеваний желудочно-кишечного тракта, в частности желудка и двенадцатиперстной кишки, является основой узкого направления медицины – гастроэнтерологии. Причин возникновения заболеваний желудка множество: неправильное питание, стрессы, нарушение режима труда и отдыха, воздействие вредных веществ, активность бактерий Helicobacter pylori и т.д. [1–3]. Желудок – важный орган, отвечающий за общее состояние организма, из-за желудочных состояний страдают все системы. Поэтому важно знать причины болезней желудка, основные его заболевания. Если рассматривать заболевания желудка с ракурса онкологии, то предвестниками данной патологии могут стать часто встречающиеся в повседневной практике гастроэнтерологов язвенная болезнь желудка, острый и хронический гастрит, дуоденогастральный рефлюкс, полипы, а также эрозия желудка. В ходе мониторинга пациентов стационарного и амбулаторного лечения данная группа заболеваний желудочно-кишечного тракта занимает лидирующее положение среди расстройств, которые в совокупности различных факторов окружающей среды, а также индивидуальных особенностей чаще других приводят к канцерогенной активности. Любое предраковое заболевание развивается поэтапно с нарастанием и углублением отрицательных изменений, происходящих в желудке. На некоторых стадиях любой процесс полностью обратим, то есть болезнь излечима. По мере углубления деструкции возможность обратимости снижается, наступает стойкая хронизация процесса, а болезнь становится неизлечимой. Переходу в предрак или рак способствуют наиболее глубокие стадии, когда болезнь развивается внутри клеток. Гастрит – это одно из наиболее распространенных желудочно-кишечных заболеваний воспалительного или воспалительно-дистрофического характера, поражающих слизистую оболочку желудка [4]. В связи со множеством разновидностей этой болезни термин «гастрит» является собирательным и служит для обозначения различных по происхождению воспалительных и дистрофических изменений в слизистой этого органа. Гастриты классифицируют по нескольким показателям – по типу, локализации воспалительного процесса, этиологическому фактору, эндоскопической картине, морфологическим изменениям слизистой оболочки желудка. Все эти показатели очень важны для диагностики и выбора способа лечения заболевания. Особого внимания заслуживает атрофический гастрит – длительно текущая форма хронического заболевания, при которой происходят деструктивные изменения в слизистой оболочке желудка. В результате патологического процесса ее площадь и количество функционирующих клеток резко уменьшаются. Многие специалисты считают [5–7], что этот подвид хронического гастрита является предраковым состоянием, как следствие угроза развития злокачественного процесса очень велика. При атрофическом гастрите запускается механизм перерождения нормальных клеток желудка; главные и добавочные клетки, принимающие участие в выработке пепсиногена и хлороводородной кислоты – основных составляющих желудочного сока, перестают функционировать в оптимальном режиме. Вместо него добавочные клетки желудка в большем объеме начинают продуцировать мукополисахариды – слизь. В результате резко снижается кислотность желудочного сока. То, что клетки меняют свою специализацию и перестают выполнять основную функцию, свидетельствует о том, что в организме есть сбой в системе гормональных, иммунных, ферментных и прочих регуляторов физиологических процессов. Язвенная болезнь желудка является одной из основных причин заболеваемости и смертности среди более семи миллионов ежегодно диагностируемых патологий желудочно-кишечного тракта [8]. Диагностика язвенной болезни желудка и двенадцатиперстной кишки предполагает наличие таких симптомов, как потеря веса, перенасыщенность, боли в эпигастральной области, чувство переполнения, вздутие живота, тошнота. К сожалению, наличие данных симптомов также вписывается в клиническую картину гастроэзофагеальной рефлюксной болезни, диспепсии и гастрита, в связи с чем диагностирование язвенной болезни желудка затруднено. Бессимптомное протекание данной патологии часто не позволяет провести диагностику на ранних стадиях развития болезни, заболевание остается незамеченным вплоть до клинических проявлений, а именно кровотечений желудочно-кишечного тракта [9]. Слизистая оболочка желудка выстлана одним слоем эпителиальных клеток, который поддерживается тонкими элементами рыхлой соединительной ткани, покрытой тонким слоем гладких мышечных волокон. У многих людей желудочный эпителий, помимо собственных кислых и ферментативных выделений желудка, подвергается воздействию Helicobacter pylori. Маленькие грамотрицательные палочки Helicobacter pylori обладают уникальной приспособленностью к колонизации желудка человека [10]. Наличие данных микроаэрофильных микроорганизмов приводит к возникновению ряда субклинических и клинических показателей, которые зависят от свойств заражающего штамма, хозяина и окружающей среды [11]. Ряду пациентов с язвенной болезнью желудка или развивающейся лимфомой желудка, которые ранее подвергались лечению с использованием нестероидных противовоспалительных препаратов, показана эрадикационная терапия. Но нельзя игнорировать тот факт, что данная терапия может ухудшить гастроэзофагеальную рефлюксную болезнь и увеличить риск развития рака пищевода [12]. Желудочные полипы представляют собой аномально растущую массу клеток, которые образуются на слизистой оболочке желудка. Наличие данной патологии является редкостью, и чаще всего заболевание протекает бессимптомно [13]. Большие полипы вызывают кровотечение, анемию, боль в животе или редко могут приводить к обструкции из-за своей локализации. Только определенные типы полипов способны обладать канцерогенной активностью и увеличивать риск развития онкологии в будущем, и в зависимости от этого выбирается дальнейшая стратегия лечения, которая может включать как хирургическое удаление полипа, так и мониторинг его изменений, и консервативное лечение [14].
Оценка морфологической структуры клеток возможна с помощью цитологического исследования, которое широко применяют в клинической практике как исключительно чувствительный, точный, эффективный метод диагностики злокачественных опухолей и ряда неопухолевых поражений всех органов пищеварительной трубки у больных с симптомами заболевания органов ЖКТ, а также при скрининге в группах высокого риска по развитию рака этих органов [15]. Микроскопически злокачественные клетки выстилают желудочные железы и крипты и представляют собой эпителиальные клетки, прорывающиеся через базальную мембрану и вторгающиеся в подслизистую оболочку и мышечный слой. Отдельные клетки теряют свою дифференцированность по отношению к соседним клеткам и представлены многочисленными митотическими фигурами [16]. Для предупреждения развития онкологических заболеваний важно раннее выявление таких состояний, а также их качественное обследование. Внедрение и максимальное использование современной эндоскопической техники значительно расширило возможности цитологической диагностики органов ЖКТ и, более того, открыло перспективы применения метода, поскольку цитологический материал пригоден для проведения имеющих неоценимое дифференциально-диагностическое значение иммуноморфологических, молекулярно-биологических и генетических исследований [17, 18].
Провести сравнительный анализ и выявить характерные морфологические цитологические признаки при различных доопухолевых заболеваниях желудка.
Материал и методы исследования
Результаты исследования и их обсуждение
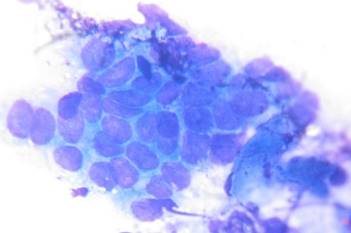
Рис. 1. Клетки покровно-ямочного эпителия с признаками гиперплазии
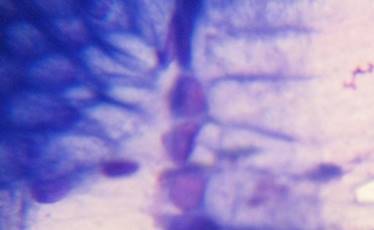
В случаях кишечной метаплазии в мазках-отпечатках обнаруживались высокие клетки цилиндрической, призматической или бокаловидной формы (рис. 2).
Рис. 2. Клетки покровно-ямочного эпителия с признаками кишечной метаплазии по тонкокишечному типу
Наблюдаются ядра больших и средних размеров, их расположение в клетках эксцентричное, окрашены интенсивно. Цитоплазма характеризуется базофильной окраской, у ядра и апикальной части почти прозрачная, широкая в апикальной части и узкая, более вытянутая в базальной. В исследуемых тканях имеются скопления лимфоидных элементов, а также плазматические клетки и сегментоядерные нейтрофилы. Эндоскопическая картина заживающей язвы характеризуется уменьшенной гиперемией слизистой оболочки, отсутствием некротических тканей и гнойных масс. Исчезает глубина язвы, воспаленные края язвы сглаживаются, формируется «красный рубец» – гиперемированная ткань слизистой оболочки, которая впоследствии после втяжения стенок формирует соединительнотканный «белый рубец» [23, 24]. Микроскопическое строение слизистой оболочки зависит от периода развития язвы. В цитологических мазках определяли десквамированные клетки эпителия, лейкоциты и эритроциты, фибробласты, гистиоциты, плазматические клетки и лимфоциты. Непосредственно по краю хронической язвы слизистая оболочка желудка подвергается значительному утолщению за счет интенсивной пролиферации ямочного эпителия. В цитологических препаратах можно найти все упомянутые выше клеточные элементы. В материале, полученном с краев хронической язвы, обычно обнаруживали полиморфные, различной степени зрелости клетки покровно-ямочного эпителия. Преобладание незрелых крупных клеток с большими ядрами и базофильной цитоплазмой может свидетельствовать об интенсивной пролиферации эпителия. В период обострения язвы в большом количестве встречаются дегенеративно измененные эпителиальные клетки без четких границ с укрупненными ядрами. Рисунок хроматина в них разреженный, в виде грубых волокон. В связи с большим клеточным распадом и явлениями цитолиза в материале, особенно полученном со дна язвы, можно видеть много «голых» ядер. В этих препаратах преобладали сегментоядерные лейкоциты и в значительном количестве встречаются элементы грануляционной ткани. В период рубцевания язвы в мазки попадают очень полиморфные клетки гистиоцитарного типа, которые бывает трудно отличить от атипических эпителиальных клеток [25]. В ходе эндоскопического исследования полипов оценивались количество, форма, размеры, поверхность, цвет, консистенция, воспалительные процессы и локализация новообразований. Цитологические препараты характеризовались большим количеством пластов и скоплений покровно-ямочного эпителия. При аденоматозных полипах встречаются также и железистоподобные структуры. По сравнению с цитологическими описаниями гастритов при этих заболеваниях отмечалось преимущество незрелых клеток, ядра светлые, укрупнены, рисунок хроматина нежно-сетчатый. Клетки эпителия желез и лимфоидные элементы определяются в небольшом количестве. В случаях грануляционных полипов с обильными воспалительными инфильтратами в их строме в цитологические препараты могут попадать в значительном количестве нейтрофильные лейкоциты.
В ходе проведенных исследований выявлены изменения в составе и морфологии клеток слизистой оболочки желудка, которые наблюдаются при гастрите, полипозе и язве, не являются строго специфическими. При всех этих заболеваниях может определяться различная степень пролиферации покровно-ямочного эпителия: в одних наблюдениях отмечается только незначительный полиморфизм эпителиальных клеток, в других – явно преобладают молодые элементы с некоторыми признаками атипии. Для установления диагноза необходимо применять дополнительные методы исследования, так как на основании только цитологических данных не представляется возможным диагностировать эти процессы.