Что такое опалесценция и флуоресценция в чем их сходство и различие
Разница между фосфоресценцией и флуоресценцией
Мы можем путать термины флуоресценция и фосфоресценция, но это две разные вещи, как по сути, так и в их проявлении в повседневной жизни.
Оба явления связаны с излучением так называемого «холодного» света.
Начнем с определения света: это волна, следовательно, распространение энергии. Далее материя: она состоит из атомов, сами состоящих из ядра и электронов.
Флуоресценция
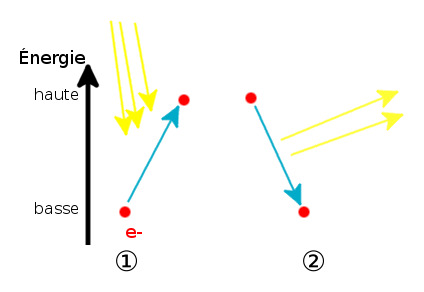
Это быстрое излучение света после поглощения энергии:
Эволюция энергетических уровней электрона во время флуоресценции.
В фазе 1 электрон освещается и переходит в возбужденное энергетическое состояние. В фазе 2 электрон теряет свою энергию в виде света.
Это явление происходит мгновенно: как только электрон захватывает энергию, он повторно излучает ее. Когда мы говорим «мгновенный», мы говорим о продолжительности в наносекундном диапазоне.
Это применение используется, например, «неоновыми» трубками (старыми, цветными) и «флуоресцентными» трубками (современными, белыми, без неона). Электричество возбуждает газ в трубке, который, в свою очередь, возбуждает отложения порошка на стенах: этот порошок будет излучать свет.
Вы можете попробовать: потрите люминесцентную лампу о шерстяной свитер в полной темноте, и вы увидите искры: статическое электрическое поле возбудит порошок, внутри которого будет незаметно светиться.
Это также флуоресценция, которая отвечает за блеск белой футболки при черном свете в ночных клубах или является причиной того, что определенные цвета называются «неоновыми цветами». В этих случаях невидимый ультрафиолетовый свет преобразуется в видимый свет флуоресцентными пигментами: поскольку падающий свет черный, а излучаемый свет является видимым, цвета кажутся яркими.
Фосфоресценция
Если флуоресценция быстрая, то фосфоресценция медленная: все объекты, которые продолжают светиться в темноте после воздействия света, функционируют по принципу фосфоресценции.
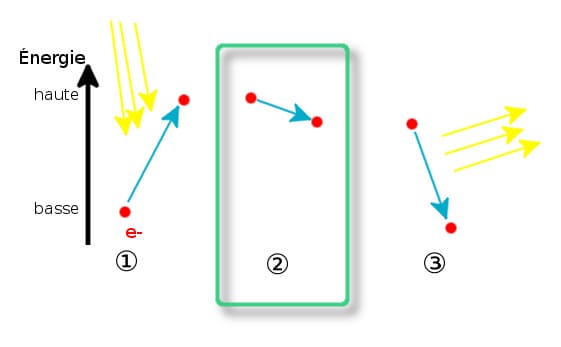
Разница заключается в снятии возбуждения: этап поглощения энергии такой же, но восстановление происходит через промежуточное состояние, называемое «триплетным состоянием»:
Перед возвращением в состояние покоя электрон проходит через промежуточное состояние. И именно этот отрывок занимает время. Попав в промежуточное состояние, он может вернуться в состояние покоя и испускать излучение, называемое фосфоресценцией.
Поскольку весь процесс занимает время, иногда несколько часов, фосфоресцирующие объекты могут светиться в темноте даже после выключения света.
Это случай со стрелками некоторых часов или светящийся игрушек, которые светятся в темноте. Кристаллы на фото в заголовке тоже являются примером фосфоресценции.
Нефосфоресцентные примеры
Обратите внимание, что некоторые старые предметы, такие как старые часы начала 20 века с фосфоресцирующими стрелками, использовались в качестве источника энергии не при воздействии света, а при радиоактивном распаде радия. Эти предметы сегодня больше не производятся, и их не рекомендуется носить с собой: радий радиоактивен и очень опасен.
Маленькие светящиеся палочки, которые нужно сложить пополам, разбить флакон и которые излучают химический свет в течение 8 часов, не фосфоресцируют, а флуоресцируют. Просто постепенно высвобождается энергия активации: медленная химическая реакция между несколькими соединениями, реакция которых называется хемилюминесценцией.
Вывод
Так что помните, что видимая разница со временем проявляется: флуоресценция короткая, а фосфоресценция длительная.
Это все из-за квантового поведения электронов и того, как медленно или быстро они избавляются от своей избыточной энергии.
Большинство фосфоресцирующих элементов, которые могут присутствовать в Вашем доме, содержат сульфид цинка, отвечающий за фосфоресценцию.
Техник форум
Меню навигации
Пользовательские ссылки
Информация о пользователе
термины
Сообщений 1 страница 11 из 11
Поделиться12013-06-28 13:14:41
добрый день. Кто что знает о таких терминах как: транслюцентность, транспаретность, флюоресценция, опалесценция, эффекты люстр и гало прошу помочь понять эти термины используемые в нашей работе.
Отредактировано Bogomol (2013-06-28 16:09:05)
Поделиться22013-06-28 18:08:14
добрый день. Кто что знает о таких терминах как: транслюцентность, транспаретность, флюоресценция, опалесценция, эффекты люстр и гало прошу помочь понять эти термины используемые в нашей работе.
Отредактировано Bogomol (Сегодня 16:09:05)
Транслюцентность, это способность материала абсорбировать в себя свет, но полностью не пропускать его через себя, то есть предметы находящиеся за этим материалом видны неотчетливо. Транспорентность, это когда материал полностью пропускает через себя свет и как бы предметы находящиеся за ним становятся полностью видимыми. Флюоресценция, это когда предмет ( зубы) в лучах ультрафиолетового света начинает светится, например на дискотеке у человека со вставленной керамической коронкой не содержащей ни каких флюоресцентных масс, рядом с живыми флюоресцирующими зубами она выглядит темным пятном. Дневной свет тоже содержит ультра фиолетовые лучи. Опалесценция, этот феномен связан с тем, что когда свет рассеивается внутри эмали зуба, то эмаль может меняться в цвете, от оранжево белого, до голубовато белого. Гало эффект связан с преломлением света на самой кромке режущего края, в виде образующейся беловато кремовой, или даже желтоватой полосочке, идущей по режущему краю.
Оптические свойства высокодисперсных систем



Осмос
При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации к большей, выравнивающий концентрацию. Этот процесс называется осмосом.

Существует еще и термодинамическое объяснение осмотического переноса. Химический потенциал чистой жидкости m2 превышает химический потенциал этой же жидкости в растворе μ1. Процесс идет самопроизвольно в сторону меньшего химического потенциала до тех пор, пока не произойдет выравнивание химических потенциалов, т.е. до достижения условия μ2 = μ2.
В результате перемещения жидкости в емкости 1 создается избыточное давление p, называемое осмотическим. Растворитель, проникающий в область раствора 1, поднимает уровень жидкости на высоту Н, что компенсирует давление чистого растворителя в сторону раствора. Наступает момент, когда вес столба жидкости в области раствора уравнивается давлением растворителя. Дальнейшего изменения уровня уже не произойдет, а вес столба жидкости над уровнем растворителя будет служить мерой осмотического давления.
Осмотическое давление возникает при движении чистого растворителя в сторону раствора или от более разбавленного раствора в сторону более концентрированного, а следовательно, связано с разностью концентраций растворенного вещества и растворителя. Осмотическое давление — это такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану.
Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор). Осмотическое давление не есть проявление какого-либо внешнего воздействия. Оно возникает самопроизвольно, как следствие молекулярно-кинетических свойств дисперсионной среды.
Высота подъема жидкости Н над первоначальным положением раствора количественно определяет осмотическое давление, которое обычно обозначают через π.
Для чистого растворителя и идеального раствора неэлектролитов осмотическое давление выразится формулой
где V — молярный объем растворителя; х — молярная доля растворенного вещества.
В случае разбавленных растворов неэлектролитов, когда x
Формула (9.11) является основной для определения осмотического давления. Она позволяет найти зависимость осмотического давления от размеров частиц растворенного вещества. Для этой цели массу дисперсной фазы можно представить в виде
M = mNA, m = (4 / 3)πr 3 ρ, (9.12)
где m, r — молекулярная масса и радиус частиц дисперсной фазы; ρ — плотность материала частиц.
Подставив в уравнение (9.11) значение М из формулы (9.12), получим
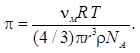
Формулу (9.13) используют для определения осмотического давления коллоидных растворов.
Осмотическое давление коллоидных растворов (высокодисперсных систем с жидкой дисперсионной средой) незначительно и составляет всего 1 мм водяного столба или даже меньше (1 мм водяного столба равен примерно 10 Па). Размеры и концентрация частиц в результате агрегации и других процессов могут изменяться. В связи с этим осмотическое давление для высокодисперсных систем непостоянно.
Из формулы (9.13) следует, что осмотическое давление прямо пропорционально концентрации дисперсной фазы и обратно пропорционально размеру частиц этой фазы в третьей степени. Чем меньше размер частиц, тем значительнее осмотическое давление. Если, например, для коллоидных растворов диаметр частиц составляет 100 нм, а размер молекул растворенного вещества — 1 нм, то осмотическое давление молекулярных растворов по сравнению с коллоидными будет в 10 6 раз больше. Осмотическое давление истинных растворов значительно превышает осмотическое давление коллоидных растворов и составляет для сока сахарной свеклы 35∙10 5 Па, экстракта кофе — 25∙10 5 Па, фруктовых соков — 1,5∙10 5 Па, 6%-го раствора сахара — 60∙10 5 Па.
Таким образом, осмос, как и все молекулярно-кинетические свойства, характерен для высокодисперсных систем, размеры частиц дисперсной фазы которых не превышают 0,1 мкм.
ОПТИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Оптические свойства дисперсных систем обусловлены взаимодействием электромагнитного излучения, обладающего определенной энергией, с частицами дисперсной фазы. Особенности оптических свойств дисперсных систем определяются природой частиц и их размерами, соотношением между длиной волны электромагнитного излучения и размерами частиц. Одним из наиболее характерных оптических свойств дисперсных систем является рассеяние света.
В зависимости от свойств частиц дисперсной фазы и их размеров свет, проходя через дисперсную систему, может поглощаться, отражаться или рассеиваться. Последствия воздействия света на дисперсные системы (интерференция, дифракция, поляризация, преломление и отражение света и др.) определяются законами геометрической оптики.
Дисперсные системы способны к рассеянию света. В результате рассеяния проходящий через коллоидный раствор луч света становится видимым (эффект Тиндаля). Этот вид рассеяния называют опалесценцией. Для молекулярных и ионных растворов подобный эффект не наблюдается.
Способностью к светорасceиванию обладают не только частицы, но и ассоциаты молекул, макромолекулы и включения, нарушающие однородность среды. Рассеяние заключается в преобразовании света веществом, которое сопровождается изменением направления света.
Схематически рассеяние света можно представить следующим образом:
| Падающий свет с частотой ν | + | Молекулы высокодисперсных частиц (атомы) | → | Поляризация молекул (атомов) и возникновение диополей с пере- менным моментом | → | Излучение кванта с частотой ν1 |
Световая волна вызывает поляризацию молекул не проводящих и не поглощающих свет частиц; возникающий при этом дипольный момент m определяется по уравнению
где α— поляризуемость; Е — напряженность возбужденного электрического поля, образованного падающим светом.
Oно реализуется в том случае, когда размеры частиц дисперсной фазы намного меньше длины волны света λ, а именно
а 3 /3; r — радиус частиц); λ — длина волны падающего света; n1, n2 — показатели преломления дисперсной фазы и дисперсионной среды.
Рэлеевское рассеяние света характерно для неэлектропроводных, оптически однородных и прозрачных частиц (белые золи). При этом размер частиц должен соответствовать условию (8.1), частицы иметь изомермическую форму, а расстояние между ними должно превышать длину волны падающего света.
В обычных условиях витающие мелкие частицы в воздухе не видны, но при прохождении солнечного луча в затемненной комнате он становится видимым. Фактически глаз человека воспринимает интенсивность света, рассеянного высокодисперсными частицами.
В соответствии с уравнением (8.2) интенсивность рассеянного света при прочих равных условиях зависит от размеров частиц и их численной концентрации:
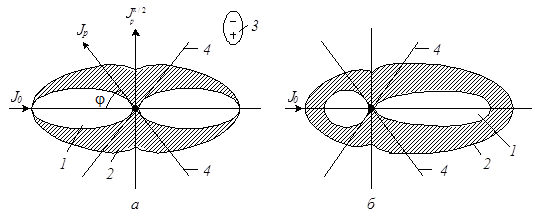
Рис. 8.1. Рассеяние света малой (а) и крупной (б) частицей:
1 и 2 — неполяризованная и поляризованная части света соответственно; 3 — полярная молекула (диполь).4 — направление максимальной интенсивности рассеяния поляризованной части света.
В формуле (8.3) коэффициент пропорциональности к1 означает, что другие члены уравнения Рэлея остаются неизменными. Поясним преобразование уравнения (8.2) в уравнение (8.3). Если числитель и знаменатель уравнения (8.2) умножить на ρ (плотность материала частиц дисперсной фазы), то произведение νчVp соответствует массе дисперсной фазы в единице объема, т.е. массовой концентрации νм. Это значит, что интенсивность рассеянного света пропорциональна при постоянной массовой концентрации размеру частиц дисперсной фазы в третьей степени.
Как следует из уравнения (8.2), интенсивность рассеянного света обратно пропорциональна длине волны падающего света в четвертой степени:
Cвет коротких волн рассеивается сильнее. Красный свет имеет наибольшую в видимой части спектра длину волны (620—760 нм) и рассеивается в меньшей степени. Поэтому запрещающие сигналы светофоров и других регулирующих устройств имеют красный свет, а бамперы электричек и электровозов, жилеты железнодорожных рабочих — красно-коричневую или оранжевую окраску.
Длина волны фиолетового света 380—450 нм; он рассеивается более интенсивно по сравнению с красным. Интенсивность рассеяния фиолетового света примерно в 16 раз выше интенсивности рассеяния красным, длина волны которого лишь в два раза превышает длину волны фиолетового света. Не случайно во время Великой Отечественной войны применялись синие лампочки для освещения затемненных объектов: значительное рассеяние света синими лампочками исключало возможность увидеть источник света даже на незначительном расстоянии.
Рассеянный солнечный свет, который образуется под действием аэрозольных частиц, ассоциатов молекул и других включений, нарушающих однородность среды, помимо фиолетового содержит и другие лучи спектра. Эти лучи ассимилируются и со стороны Земли придают небу голубую окраску. Со стороны Космоса, т.е. в направлении солнечных лучей, рассеяния не происходит: космонавты видят черное небо и голубой ореол Земли.
Заметим, что кроме особенности рассеянного света восприятие красного и фиолетового света зависит от специфики спектральной чувствительности глаза человека.
Интенсивность рассеянного света, согласно уравнению (8.2), зависит от показателей преломления вещества дисперсной фазы n1 и дисперсионной среды n2.
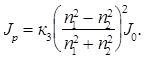
Если показатель преломления вещества, из которого формируется дисперсная фаза, равен показателю преломления дисперсионной среды (n1 = n2), то рассеяния не происходит. Так, в однородных средах светорассеяние не наблюдается.
Показатель преломления воздуха n1 равен 1,000, воды n2 — 1,333, поэтому капли воды в воздушной среде в соответствии с уравнением (8.5) способны к рассеянию света.
Свет рассеивается во всех направлениях, т.е. является векторной величиною. Однако, его интенсивность в различных направленных неодинакова. Интенсивность рассеянного света в пространстве может быть представлена в виде векторной диаграммы. Распределение интенсивности paссеянного света в одной плоскости можно представить при помощи рис. 8.1.
Рассеянный свет обычно поляризован. Поляризация заключается в поперечной анизотропии (неоднородности) световых лучей. Как следует из рис. 8.1, а рассеянный свет не поляризован в направлении падающего луча и полностью поляризован в плоскости, которая перпендикулярна падающему световому лучу. В этом направлении образуется седловина. Максимальная интенсивность поляризованного света достигается на краях седловины, прямые 4 рис. 8.1, когда угол между падающим и рассеянным светом (j) равен приближенно 55о. Если падающий свет не поляризован, то интенсивность рассеянного света, т.е. отношение между Jр/J0 пропорционально величине 1 + Cos 2 φ. При φ, равным нулю, рассеяние максимально, при φ = 90 o оно отсутствует (Jр π/2 ; рис. 8.1, а).
При значительной концентрации частиц, когда расстояние между частицами меньше длины волны падающего света, уравнение (8.2) теряет смысл.
Рассеяние света дисперсной системой, состоящей из множества частиц, существенно отличается от рассеяния света одиночными частицами. Это отличие обусловлено интерференцией волн, рассеянных отдельными частицами, и падающих волн; многократным рассеянием, которое наблюдается, когда свет, рассеянный одними частицами, повторно рассеивается другими; перемещением частиц.
В заключении отметим отличие между опалесценцией и флуоресценцией. Оба эти явления связаны со свечением растворов. При опалесценции свечение вызвано рассеянием света коллоидными растворами. Термин «опалесценция» широко используют как синоним видимого невооруженным глазом рассеяния света коллоидными растворами, которые по внешним признакам трудно отличить от истинных растворов.
Флуоресценция же характерна только для истинных растворов и связана с поглощением света одной длины волны и излучением света другой длины волны; в результате в отраженном свете раствор приобретает окраску. Кроме того, при опалесценции в отличие от флуоресценции рассеянный свет частично поляризован.
Оптические свойства и методы исследования дисперсных систем
Оптические свойства дисперсных систем обусловлены взаимодействием электромагнитного излучения, обладающего определенной энергией, с частицами дисперсной фазы. Особенности оптических свойств дисперсных систем определяются природой частиц, их размерами, соотношением между длиной волны электромагнитного излучения и размерами частиц. При прохождении луча света через дисперсную систему могут наблюдаться следующие явления:
1. Преломление света частицами дисперсной фазы;
2. Отражение света частицами дисперсной фазы;
3. Светорассеяние (опалесценция);
4. Поглощение света.
Одним из характерных оптических свойств дисперсных систем является рассеяние света. В результате рассеяния проходящий через коллоидный раствор луч света становится видимым (эффект Тиндаля – рис. 1.3.1.1.). Этот вид рассеяния называется опалесценцией (в молекулярных и ионных растворах этот эффект не наблюдается).
Р и с. 1.3.1.1. Иллюстрация эффекта Тиндаля
Способностью к светорассеянию обладают не только частицы, но и ассоциаты молекул, макромолекулы, включения, нарушающие однородность среды. Рассеяние заключается в преобразовании веществом света, которое сопровождается изменением направления света. Схематически процесс рассеяния света выглядит так:
| Падающий свет с частотой n |
| Молекулы высокодисперсных частиц (атомы) |
| Поляризация молекул (атомов) и возникновение диполей с переменным моментом |
| + |
| ® |
| Падающий свет с частотой n1 |
| ® |
а p /2
| — + |
| Р и с. 1.3.1.2. Рассеяние света малой (а) и крупной (б) частицей: 1 и 2 – неполяризованная и поляризованная части света соответственно; 3 – полярная молекула (диполь). 4 – направление максимальной интенсивности рассеяния поляризованной части света |
| I0 |
| j |
Светорассеяние наблюдается лишь тогда, когда длина световой волны больше размера частицы дисперсной фазы, т. е., lсв.в.>>ад.ф., а расстояние между частицами больше lсв.в. Если lсв.в.
Свет рассеивается во всех направлениях (свет – векторная величина). Но его интенсивность неодинакова по направлениям, и может быть представлена в виде векторной диаграммы Ми (рис. 1.3.1.2) [2].
В результате рассеяния интенсивность падающего света I0 изменяется и будет характеризоваться величиной Iр, которая определяется по уравнению Рэлея:

где vч – численная концентрация дисперсной фазы;
V – объем частиц (для шарообразной частицы равный 4pr 3 /3);
n1, n2 – показатели преломления дисперсной фазы и дисперсионной среды.
Рэлеевское светорассеяние характерно для неэлектропроводных, оптически однородных и прозрачных частиц («белые золи»). В соответствии с уравнением Рэлея, интенсивность рассеянного света при прочих равных условиях зависит от размеров частиц и их численной концентрации:

где k1 – коэффициент пропорциональности, означает, что другие члены уравнения неизменны.
Интенсивность рассеянного света пропорциональна при постоянной массовой концентрации размеру частиц дисперсной фазы в третьей степени. Из уравнения Рэлея: 
Интенсивность рассеянного света зависит от показателей преломления фазы (n1) и среды (n2): 
Если n1 = n2, рассеяния не происходит, в однородных средах светорассеяния не наблюдается.
При значительной концентрации частиц, когда расстояние между частицами меньше длины волны падающего света, уравнение Рэлея теряет смысл.
Различие опалесценции и флуоресценции: оба явления связаны со свечением растворов, но при опалесценции свечение вызвано рассеянием света коллоидным раствором. Флуоресценция же характерна только для истинных растворов и связана с поглощением света одной длины волны и излучением света другой длины волны; в результате чего в отраженном свете раствор приобретает окраску. При опалесценции в отличие от флуоресценции рассеянный свет частично поляризован.
Оптические методы являются наиболее распространенными методами определения размера, формы и структуры коллоидных частиц. Это объясняется быстротой и удобством этих методов и точностью получаемых результатов. Наиболее часто для исследования коллоидных растворов применяются:
 Рис. 1.3.1.4. Микрофото- графии живых клеток ме- тодом тёмного поля Рис. 1.3.1.4. Микрофото- графии живых клеток ме- тодом тёмного поля |  Рис. 1.3.1.5. Схема щелевого ультрамикроскопа Р. Зидентопфа и Р. Зигмонди (1903 г.). Образование темнопольного изображения: а – при прямом, б – при косом освещении объекта: 1 – осветитель; 2 – зеркало; 3 – затемняющая пластинка; 4 – объектив; 5 – темное поле Рис. 1.3.1.5. Схема щелевого ультрамикроскопа Р. Зидентопфа и Р. Зигмонди (1903 г.). Образование темнопольного изображения: а – при прямом, б – при косом освещении объекта: 1 – осветитель; 2 – зеркало; 3 – затемняющая пластинка; 4 – объектив; 5 – темное поле |
В 1903 г Зидентопф и Зигмонди сконструировали прибор иного типа – ультрамикроскоп, основанный на наблюдении светорассеяния в обычном оптическом микроскопе. При этом сплошная опалесценция, видимая невооруженным глазом, разрешается в отблески отдельных частиц. Каждый отблеск – это свечение светового пучка волн, рассеянных одной частицей под разными углами, оно значительно больше, чем проекция самой частицы и доступно для микроскопической регистрации. Прямая регистрация не позволяет судить о размерах и форме частицы, так как мы наблюдаем не сами частицы, а их отблески, но эти параметры могут быть определены косвенно.
Электронная микроскопия. В последние годы для наблюдения размеров и формы коллоидных частиц чаще всего пользуются электронным микроскопом, в котором вместо световых лучей применяются пучки электронов с длиной волны всего 0,02-0,05 А. Это резко увеличивает разрешающую способность микроскопа и дает возможность непосредственно видеть или фотографировать
| коллоидные частицы. Разрешающее расстояние с помощью электронного микроскопа может быть доведено до 5-10 А. Применение электронного микроскопа затруднено необходимостью тщательного высушивания образцов, так как внутри электронного микроскопа поддерживается высокий вакуум, необходимый для прохождения электронного пучка; кроме того, вследствие сильного поглощения электронов изучаемые образцы должны быть весьма тонкими (1-10 мк). При выпаривании капли раствора свойства системы могут существенно изменяться, в результате чего наблюдаемые параметры могут сильно отличаться от параметров частиц в коллоидном растворе. |  |
| Р и с. 1.3.1.6. Схема работы просвечивающего электронного микроскопа |
Нефелометрия.Методоснован на способности коллоидных систем рассеивать свет. Определяя светорассеяние данной системы, можно определять размер частиц или концентрацию дисперсной фазы, изучать различные процессы, происходящие в растворе. В основе нефелометрии лежит уравнение Рэлея, которое можно представить в виде:

где I, I0 – интенсивности рассеянного и падающего света;
c – концентрация дисперсной фазы;
Зная концентрацию золя с и измерив значения интенсивностей падающего и рассеянного излучения I, I0, можно вычислить средний объем частиц. Истинные значения I и I0 определить сложно. Поэтому распространение получили относительные измерения в нефелометрии. Опалесценцию исследуемого раствора с помощью нефелометра сравнивают с опалесценцией стандартного раствора Iст той же концентрации, объем частиц которого известен.
Турбидиметрия.Это метод исследования, основанный на измерении ослабления проходящего через коллоидную систему света в результате светорассеяния. Измерения производят с помощью обычных фотоэлектроколориметров или спектрофотометров.
Если интенсивность пучка света уменьшается от I0 для падающего света до I прошедшего света, то мутность определяется уравнением:

где l- расстояние, пройденное светом.