Что такое орбиталь какие вы знаете орбитали
Орбиталь
Из Википедии — свободной энциклопедии
Орбиталь — в многоэлектронной системе — не зависящая от спина математическая функция, описывающая движение электрона и используемая в построении полной электронной волновой функции [1] атома или молекулы.
В описании атомных и молекулярных многоэлектронных систем в уравнении Шрёдингера присутствует член, описывающий взаимодействие электронов между собой, который делает невозможным аналитическое решение и крайне затрудняет численное. Одним из первых подходов к поиску приближенной волновой функции был метод Хартри-Фока, в котором попарное взаимодействие электронов заменяется взаимодействием электрона с усредненным полем, создаваемым остальными электронами. Это позволяет перейти к описанию общей волновой функции как детерминанта, построенного из одноэлектронных волновых функций, называемых спин-орбиталями (Слэтеровского детерминанта). Компонента спин-орбитали, независимая от спина, называется орбиталью. Слэтеровский детерминант удобен в описании электронных систем, поскольку гарантирует, что итоговая волновая функция будет абсолютно антисимметричной относительно перестановок электронов (условие, накладываемое тем, что электроны являются фермионами). Поэтому описание полной электронной волновой функции в более поздних методах обычно строится с его использованием и наследует понятие орбитали, хотя оно и теряет наглядную интерпретацию как описание поведения отдельного электрона.
ОРБИТАЛЬ
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
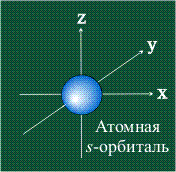
Электрон движется в атоме вокруг ядра не по фиксированной линии-орбите, а занимает некоторую область пространства. Например, электрон в атоме водорода может с определенной вероятностью оказаться либо весьма близко к ядру, либо на значительном удалении, однако существует определенная область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, иначе говоря, электронная плотность максимальна. У атома водорода орбиталь электрона имеет сферическую (шаровую) форму:
К настоящему моменту описано пять типов орбиталей: s, p, d, f и g. Названия первых трех сложились исторически, далее был выбран алфавитный принцип. Формы орбиталей вычислены методами квантовой химии.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним полученным на сегодня элементом, имеет полный набор всех орбиталей на всех электронных уровнях. Их заполнение электронами происходит по мере увеличения порядкового номера, то есть, заряда ядра.
s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
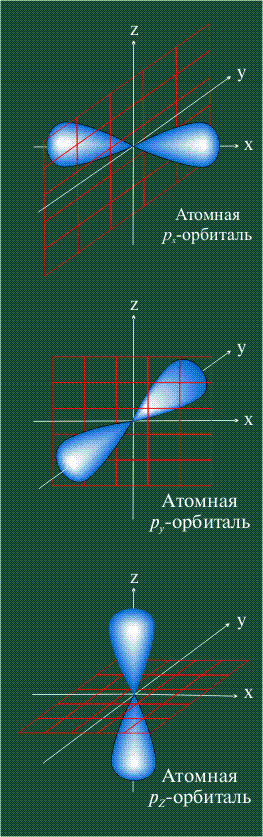
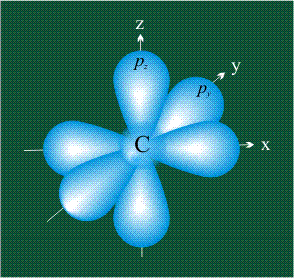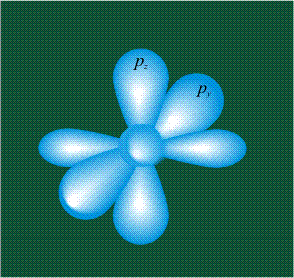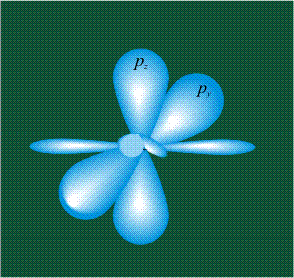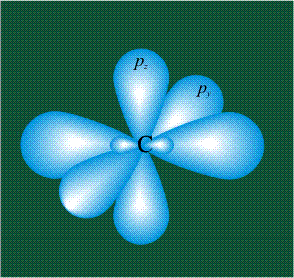
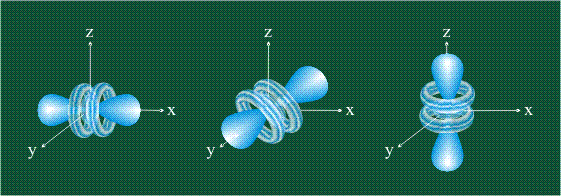
На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
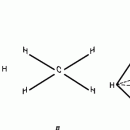
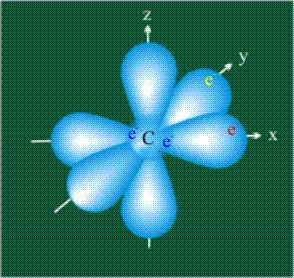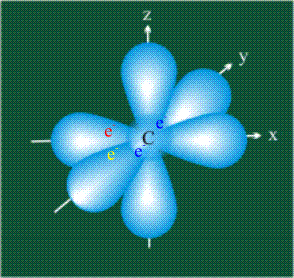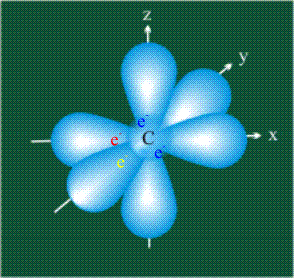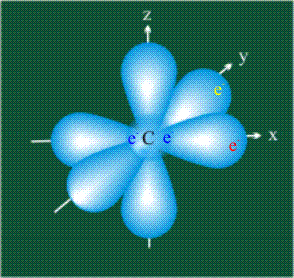
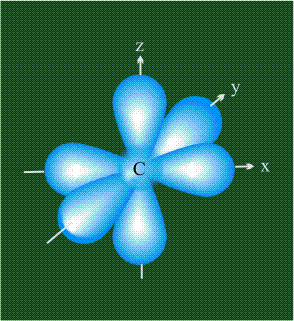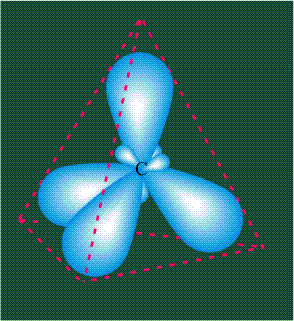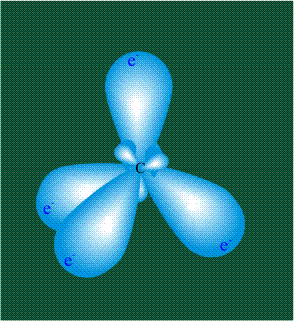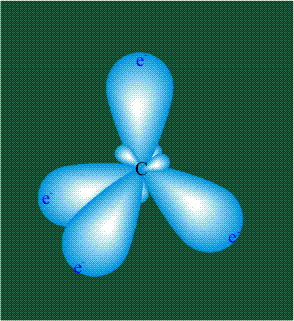
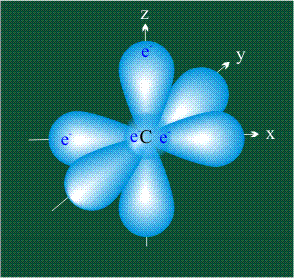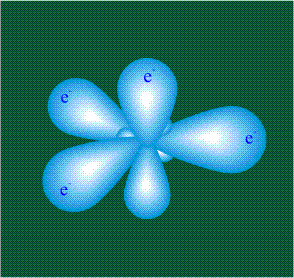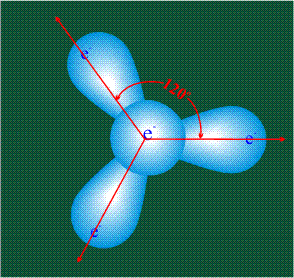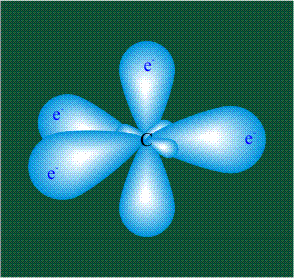
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали (отмечены синим цветом) и по одному электрону на двух р-орбиталях (отмечены красным и желтым цветом), третья орбиталь – рz-вакантная:
Гибридизация.
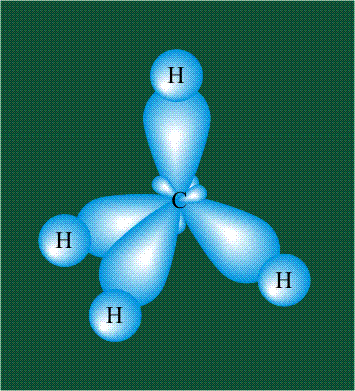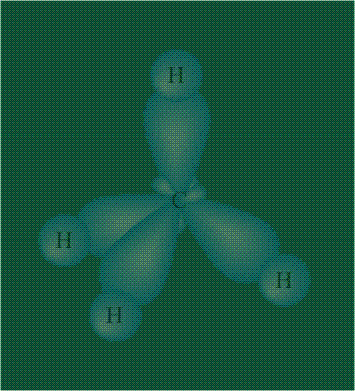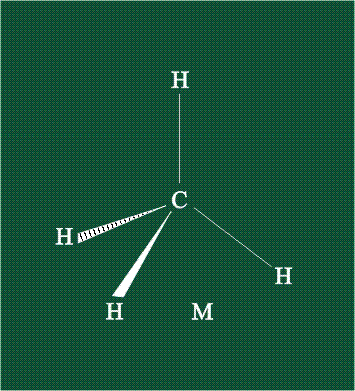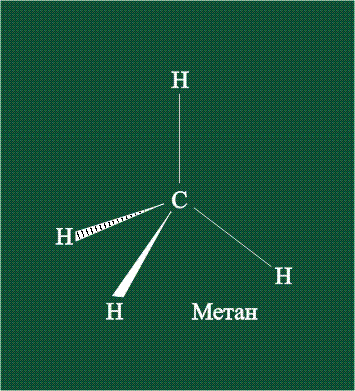
В том случае, когда атом углерода участвует в образовании насыщенных соединений (не содержащих кратных связей), одна s-орбиталь и три р-орбитали объединяются, образуя новые орбитали, представляющие собой гибриды исходных орбиталей (процесс называют гибридизацией). Количество гибридных орбиталей всегда равно количеству исходных, в данном случае, четыре. Получившиеся орбитали-гибриды одинаковы по форме и внешне напоминают асимметричные объемные восьмерки:
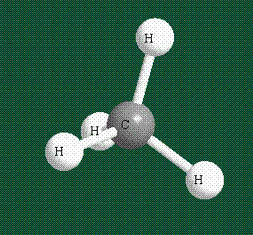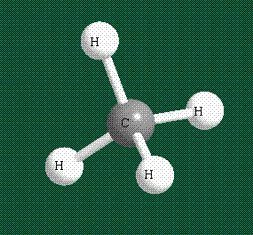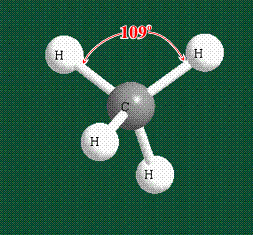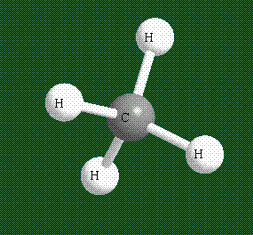
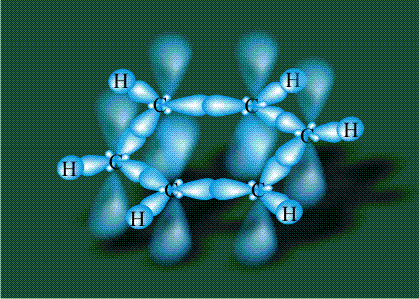
Вся конструкция оказывается как бы вписанной в правильный тетраэдр – призма, собранная из правильных треугольников. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109°. Четыре валентных электрона углерода располагаются на этих гибридных орбиталях:
Участие орбиталей в образовании простых химических связей.
Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа.
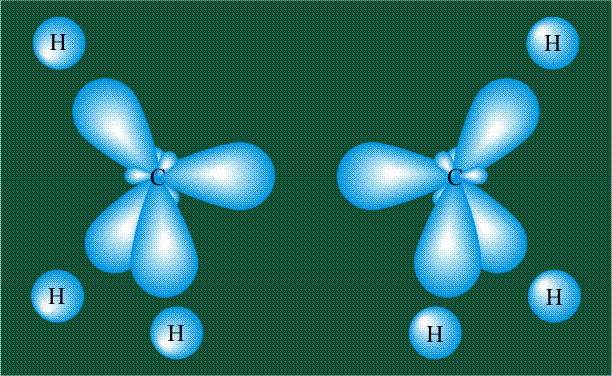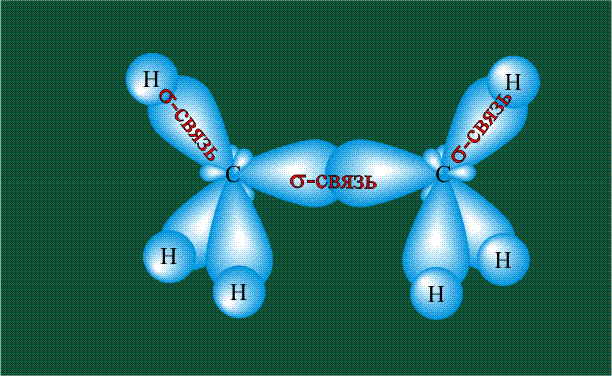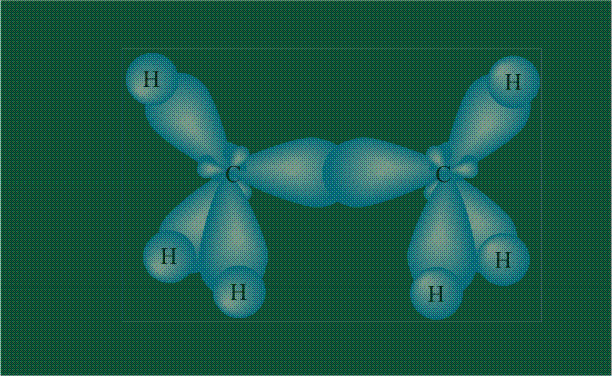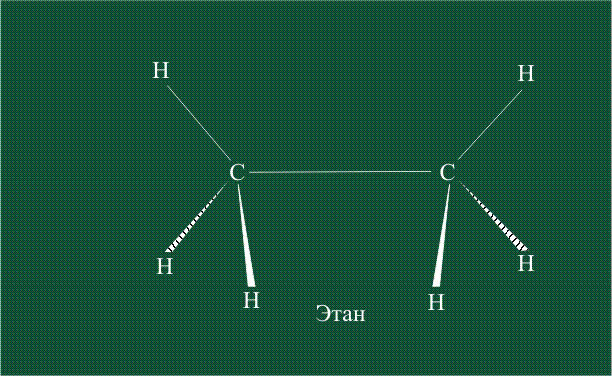
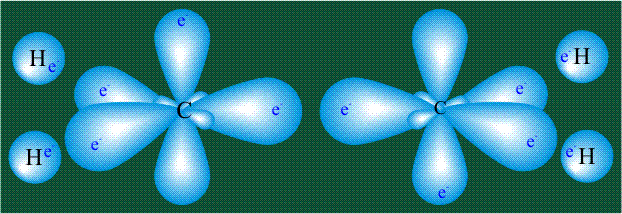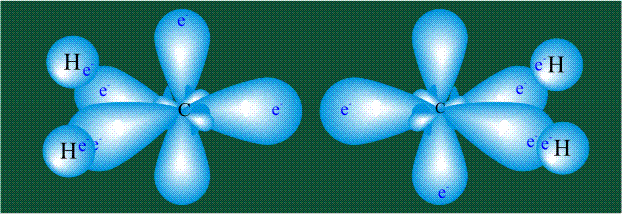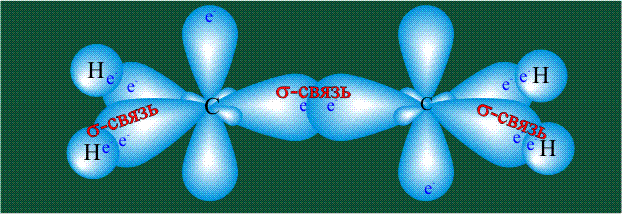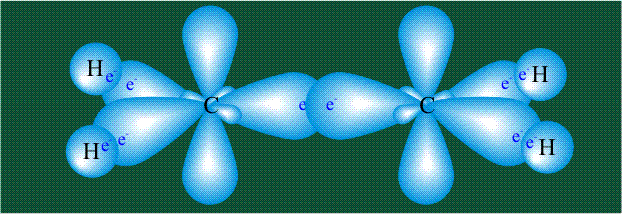
Взаимодействие атома углерода с четырьмя атомами водорода сопровождается взаимоперекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водородов. На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. Для объемного изображения структуры валентность, направленную от плоскости чертежа к зрителю показывают в виде сплошной клиновидной линии, а валентность, уходящую за плоскость рисунка – в виде штриховой клиновидной линии:
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода:
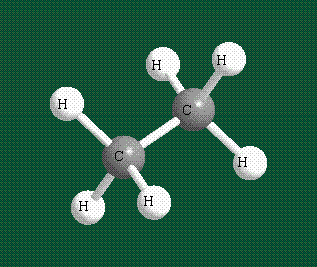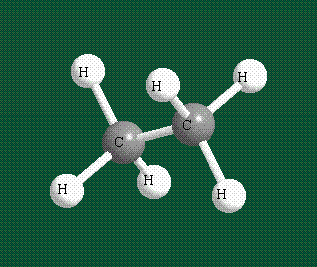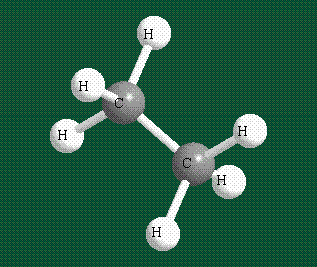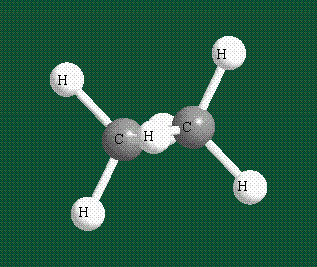
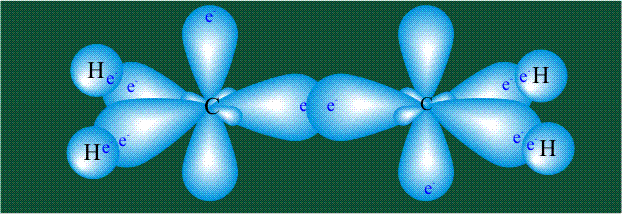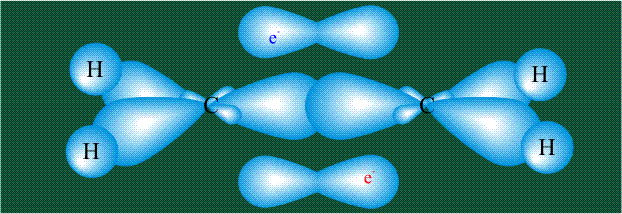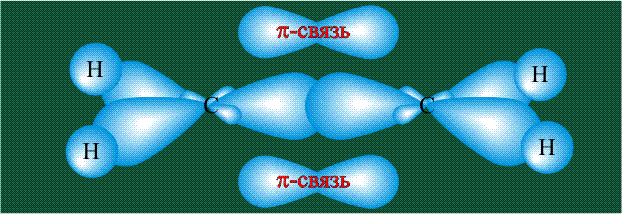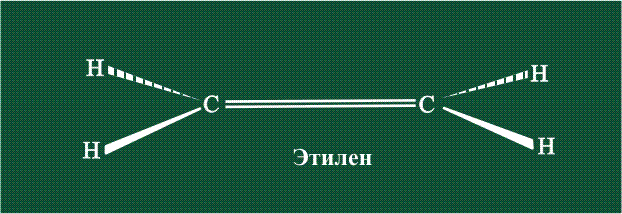
Образование молекулы этана аналогично показанному выше процессу, отличие состоит в том, что при взаимоперекрывании гибридных орбиталей двух атомов углерода происходит образование С-С – связи:
Участие орбиталей в образовании кратных химических связей.
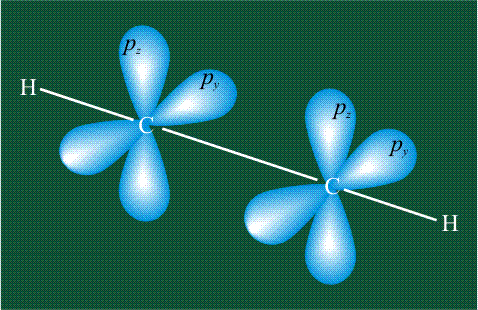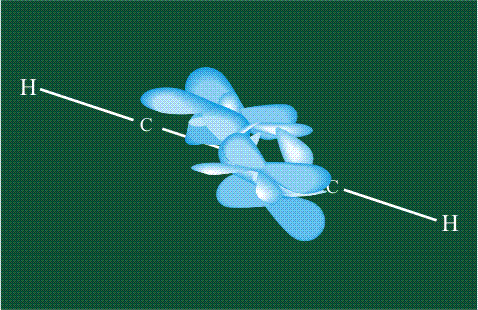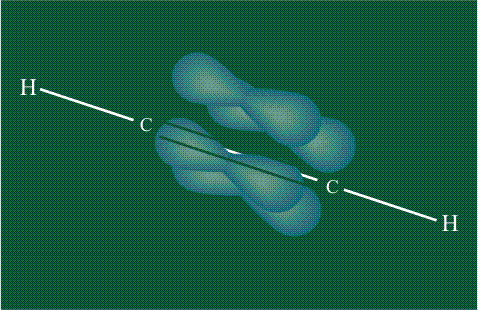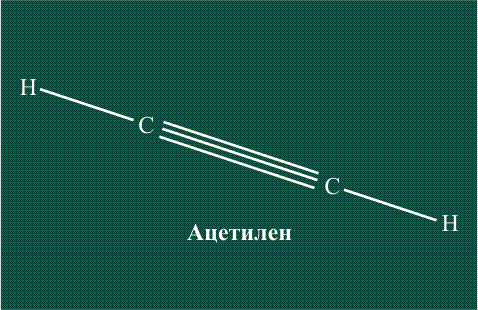
Молекула этилена образована также с участием орбиталей-гибридов, однако в гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120°:
Вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.
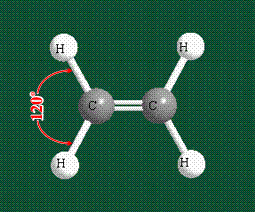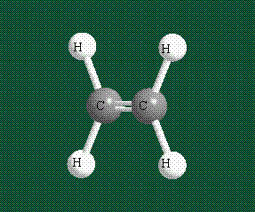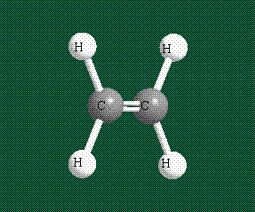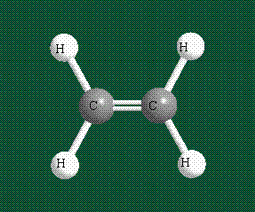
Структура молекулы этилена задана геометрией гибридных орбиталей, валентный угол Н-С-Н – 120°:
При образовании ацетилена в гибридизации участвует одна одна s-орбиталь и одна рx-орбиталь (орбитали pyи pz, в образовании гибридов не участвуют). Две образовавшиеся гибридные орбитали располагаются на одной линии, вдоль оси х:
В итоге молекула ацетилена имеет палочкообразную форму:
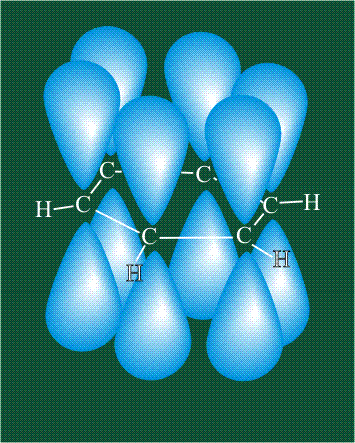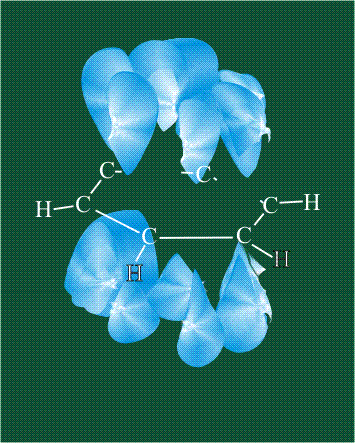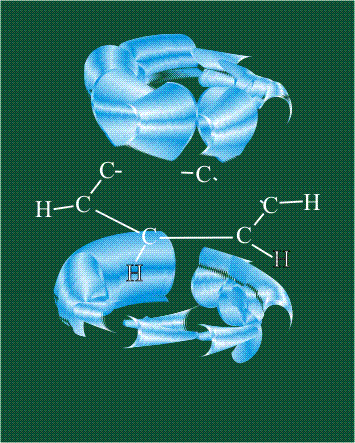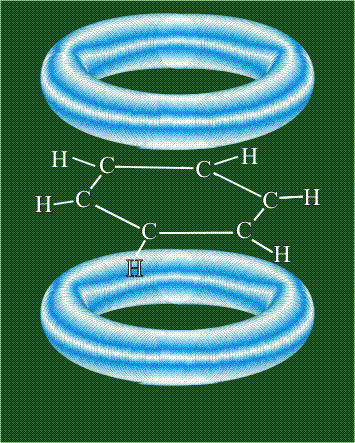
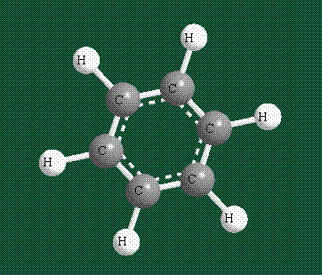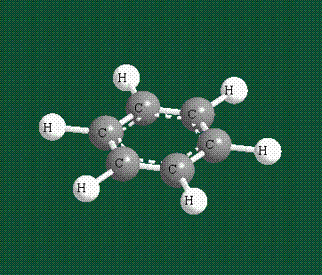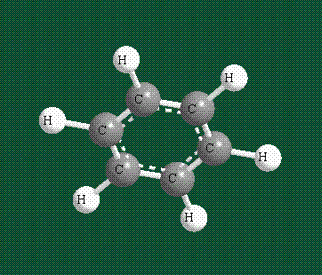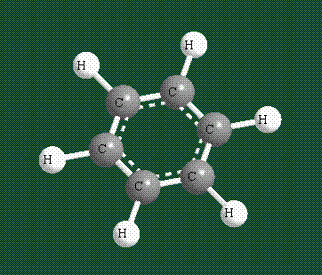
У бензола остов молекулы собран из атомов углерода, имеющих гибридные орбитали, составленные из одной s— и двух р-орбиталей, расположенные в форме трехлучевой звезды (как у этилена), р-орбитали, не участвующие в гибридизации, показаны полупрозрачными:
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла:
Возникает единая замкнутая электронная система (см. также АРОМАТИЧНОСТЬ).
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла:
В образовании химических связей могут также участвовать вакантные, то есть, не содержащие электронов орбитали (см. также ТРЕХЦЕНТРОВЫЕ СВЯЗИ).
Орбитали высоких уровней.
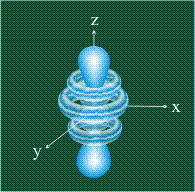
Начиная с четвертого электронного уровня, у атомов появляются пять d-орбиталей, их заполнение электронами происходит у переходных элементов, начиная со скандия. Четыре d-орбитали имеют форму объемных четырехлистников, называемых иногда «клеверным листом», они отличаются лишь ориентацией в пространстве, пятая d-орбиталь представляет собой объемную восьмерку, продетую в кольцо:
d-Орбитали могут образовывать гибриды с s- и p-орбиталями. Параметры d-орбиталей обычно используют при анализе строения и спектральных свойств в комплексах переходных металлов.
Начиная с шестого электронного уровня, у атомов появляются семь f-орбиталей, их заполнение электронами происходит в атомах лантаноидов и актиноидов. f-Орбитали имеют довольно сложную конфигурацию, ниже на рисунке показана форма трех из семи таких орбиталей, имеющих одинаковую форму и ориентированных в пространстве различным образом:
f-Орбитали весьма редко используют при обсуждении свойств различных соединений, поскольку расположенные на них электроны практически не принимают участия в химических превращениях..
Перспективы.
На восьмом электронном уровне находится девять g-орбиталей. Элементы, содержащие электроны на этих орбиталях, должны появится в восьмом периоде, пока они недоступны (в ближайшее время ожидается получение элемента № 118, последнего элемента седьмого периода Периодической системы, его синтез проводят в Объединенном институте ядерных исследований в Дубне).
Форма g-орбиталей, вычисленная методами квантовой химии, еще более сложная, чем у f-орбиталей, область наиболее вероятного местонахождения электрона в данном случае выглядит весьма причудливо. Ниже показан внешний вид одной из девяти таких орбиталей:
В современной химии представления об атомных и молекулярных орбиталях широко используют при описании строения и реакционных свойств соединений, также при анализе спектров различных молекул, в некоторых случаях – для прогнозирования возможности протекания реакций.
Основы строения атомов
Большинство из нас думает, что знает об атомах достаточно много. Мы знаем какие они маленькие и даже можем дать определение атому. Но как же человечество пришло к пониманию, что такое атом и каковы основы строения атомов?
Модель атома Томпсона (пудинг с изюмом)
В 1897 году Дж. Дж. Томпсон проводил опыт — в вакуумную трубку между двумя палочками (электродами) подавал напряжение и заметил, что в результате этого, проходит пучок сверкающих лучей от «-» к «+» электроду.
Эти лучи он назвал катодными лучами, позднее их стали называть электронными лучами. С помощью магнита, Томпсон определил, что эти лучи содержат частицы с отрицательным зарядом. После большой серии опытов ему удалось установить, что отрицательные частицы (электроны) очень малы, по сравнению с тем, что дает положительный заряд атому.
В итоге многочисленных опытов была разработана модель атома, получившая название «пудинг с изюмом». В этой модели атом – это большое облако, имеющее «+» заряд (пудинг), имеющее очень маленькие вкрапления «-» заряженных частиц (электроны — изюм).
Модель атома Резерфорда (ядерная модель)
В 1907 году Эрнест Резерфорд «дурачился» в своей лаборатории, запуская в тонкую золотую фольгу альфа-частицы, чтобы увидеть, как они отклоняются облаком положительного заряда.
Но вот произошло то, что он никак не ожидал увидеть: хотя большинство частиц летели прямо, некоторые отклонялись на большой угол, а некоторые летели назад в сторону источника. Этот эксперимент позволил предположить, что весь положительный заряд находится в ядре атома, а отрицательно заряженные электроны плавают вокруг него. Согласно ядерной модели строения атома по Резерфорду, большую часть атома занимает пустое пространство.
Модель атома Бора (планетарная модель)
Пока другие ученые ставили эксперименты с катодными лучами, Нильс Бор был озадачен теми линиями, которые давал водород при добавлении ему энергии. И вот возникла планетарная модель атома, в которой Бор предположил, что электроны движутся вокруг ядра по круговым орбитам, подобно планетам, вращающихся вокруг Солнца.
Также он полагал, что чем дальше электрон находится от ядра, тем большей энергией он обладает. При получении атомом дополнительной энергии, электроны с ближних орбит могут перескакивать на более отдаленные. Начальная орбиталь называется основной, а конечная – возбужденной. Энергия, полученная атомом должна куда-то уйти, и она высвобождается в виде квантов электромагнитного излучения. Т.к. существует несколько возбужденных состояний, то испускаются кванты различных энергий. Этим он объяснил полученный спектр водорода.
Современная модель атома (квантовая модель)
Во что мы верим сейчас? Из предыдущего раздела Основные понятия и законы химии, мы знаем, что Атом состоит из ядра и электронов. Атомное ядро имеет положительный заряд и состоит из протонов (Z) и нейтронов (N), а сумма масс протонов (Z) и нейтронов (N) атомного ядра называется массовым числом A = Z + N. Электроны атома расположены вокруг ядра на своих орбиталях.
В таблице приведены характеристики частиц, входящих в атом
Частица
Атомы электронейтральны и число протонов совпадает с числом электронов, а вот число нейтронов может отличаться, тогда и появляются изотопы. Поскольку все элементы имеют несколько изотопов, то у каждого из них мы будем иметь среднюю атомную массу от масс всех изотопов, отсюда и возникает дробное значение атомной массы элемента в Периодической таблице Менделеева.
Атомная орбиталь
А что же такое атомная орбиталь, какова ее природа и как она выглядит? В результате титанического труда многих ученых, родилась новая теория строения атома – квантовая.
Согласно этой теории электрон обладает корпускулярно-волновым дуализмом — является одновременно волной и частицей. Масса и заряд электрона – это свойства частицы, а способность к дифракции и интерференции — волновые.
Уравнение де Бройля связывает эти два свойства электрона.
Вскоре было выведено уравнение Шредингера, которое описывает электрон как волну:
где E— полная энергия электрона, V-потенциальная энергия электрона, Ψ-квадратный корень от вероятности нахождения электрона в пространстве с координатами x, y и z (при этом начало координат — ядро).
Уравнение предполагало, что точно предсказать местонахождение и траекторию движения электрона невозможно. Однако, можно найти вероятность нахождения электрона с помощью волновой функции. Теперь орбитали стали не двухмерными, как считалось ранее, а трехмерными телами.
Что такое орбиталь?
Орбиталь — это околоядерное пространство, в котором вероятность обнаружения электрона равна 95%.
Т.о. можно описать 4 разных видов орбиталей, имеющих разную энергию и различную форму:
Электроны в зависимости от занимаемой орбитали (подуровня), называют s-, p-, d- и f-электронами.
Элементы, внешние электроны которых занимают только s-подуровень, называются s-элементами. Таким же образом называют p-элементы, d-элементы и f-элементы.
Квантовые числа (n, l, ml, ms)
Чтобы описанные раннее уравнения работали, нужны 4 переменные (4 квантовых числа). Опишем их:
Принцип Паули гласит,
Никакие два электрона в атоме не могут иметь одинаковый набор всех 4х квантовых чисел.
Из принципа Паули вытекает, что на энергетическом уровне n может находиться не более чем 2n 2 электронов, на n 2 подуровнях.
Существует правило, которое гласит, что электроны размещаются на уровнях и орбиталях не беспорядочно, а по принципу наименьшей энергии, т.е. чтобы сумма главного и орбитального квантовых чисел n+l была наименьшей.
Это правило известно, как правило Клечковского. В случае, когда сумма равна, сначала идет заполнение энергетического уровня с наименьшим главным квантовым числом.
Правила заполнения орбиталей
Заполнение орбиталей происходит в следующем порядке:
1s В пределах одного периода, находясь в основном состоянии, атом стремится к максимально возможному числу неспаренных электронов
Зная, где находится электрон, мы можем написать его электронную конфигурацию (запись ряда орбиталей атома, на которых находятся электроны), которая составляется по образцу:
n(тип орбитали) число электронов на этой орбитали
Итак, заполнение орбиталей электронами происходит следующим образом:
Возбужденное состояние атома
При сообщении атому дополнительной энергии (действие температуры, рентгеновского или электромагнитного излучения), его электроны переходят в возбужденное состояние. При этом один или несколько электронов основного состояния переходят с занятых орбиталей на свободные. Предпочтительно возбуждаются электроны внешних оболочек, т.к. образующиеся состояния обладают наименьшей энергией.
Это состояние очень неустойчиво и длится всего миллионные доли секунды.
Валентные электроны (электроны, расположенные на внешнем уровне) способны выравнивать свою энергию и изменять форму орбиталей. Этот процесс называется гибридизацией атомных орбиталей и подробнее описан в разделе Метод валентных связей
Примеры с решениями на составление электронных формул, распределение электронов по орбиталям в различных атомах Вы можете посмотреть в разделе Задачи по теме Основы строения атомов
Атомные орбитали, из чего они состоят, как они символизируются и типы
Эта физическая концепция, применяемая химиками для понимания связи и периодической таблицы, рассматривает электрон как волну и частицу одновременно. Поэтому изображение солнечной системы отбрасывается, где электроны представляют собой планеты, вращающиеся на орбитах вокруг ядра или Солнца..
Эта устаревшая визуализация полезна при иллюстрации энергетических уровней атома. Например: круг, окруженный концентрическими кольцами, представляющими орбиты, и их статические электроны. На самом деле, это образ, с помощью которого атом вводится детям и молодежи..
Однако истинная атомная структура слишком сложна, чтобы даже приблизительное изображение.
Рассматривая тогда электрон как волну-частицу и решая дифференциальное уравнение Шредингера для атома водорода (простейшая из всех систем), были получены знаменитые квантовые числа.
Эти числа показывают, что электроны не могут занимать какое-либо место атома, а только те, которые подчиняются уровню дискретной и квантованной энергии. Математическое выражение вышесказанного известно как волновая функция.
Таким образом, из атома водорода была оценена серия энергетических состояний, управляемых квантовыми числами. Эти энергетические состояния были названы атомными орбиталями.
Но они только описали местонахождение электрона в атоме водорода. Для других атомов, полиэлектроники, начиная с гелия, делалось орбитальное приближение. Почему? Поскольку разрешение уравнения Шредингера для атомов с двумя или более электронами очень сложно (даже с современной технологией).
Каковы атомные орбитали?
Хотя на первый взгляд это может показаться сложным, обратите внимание, что квантовые числа N, L и мл Они обозначены маленькими буквами. Это означает, что эти три числа описывают орбиталь. Rп(г), более известный как радиальная функция, зависит от N и L; пока YLML(θφ), угловая функция, зависит от L и мл.
В математическом уравнении также есть переменные r, расстояние до ядра, а также θ и φ. Результатом всей этой системы уравнений является физическое представление орбиталей. Что? Тот, который показан на изображении выше. Есть ряд орбиталей, которые будут объяснены в следующих разделах.
Его формы и конструкции (а не цвета) происходят из-за построения в пространстве волновых функций и их радиальной и угловой составляющих..
Радиальная волновая функция
Как видно из уравнения, Rп(г) это так сильно зависит от N по состоянию на L. Затем радиальная волновая функция описывается основным энергетическим уровнем и его подуровнями..
Если бы можно было сфотографировать электрон без учета его направления, можно было бы наблюдать бесконечно малую точку. Затем, сделав миллионы фотографий, вы можете подробно описать, как меняется облако точек в зависимости от расстояния до ядра..
Таким образом, плотность облака можно сравнить по расстояниям и близости к ядру. Если бы та же самая операция была повторена, но с другим энергетическим уровнем или подуровнем, образовалось бы другое облако, которое окружит предыдущее. Между ними есть небольшое пространство, где электрон никогда не находится; это то, что известно как радиальный узел.
Также в облаках есть области с более высокой и низкой электронной плотностью. Поскольку они становятся больше и удаляются от ядра, у них появляется больше радиальных узлов; а также расстояние р где электрон вращается чаще и с большей вероятностью его найдет.
Угловая волновая функция
Опять же, из уравнения известно, что YLML(θφ) в основном описывается квантовыми числами L и мл. На этот раз он участвует в магнитном квантовом числе, поэтому направление электрона в пространстве определено; и этот адрес может быть построен из математических уравнений, которые включают переменные θ и φ.
Теперь мы не приступаем к съемке, а к записи видео пути электрона в атоме. В отличие от предыдущего эксперимента, неизвестно, где именно электрон, но куда он идет.
При движении электрон описывает более определенное облако; на самом деле, сферическая форма или форма с лепестками, подобная тем, которые видны на изображении. Тип фигур и их направление в пространстве описываются L и мл.
Есть области, близкие к ядру, где электрон не проходит и фигура исчезает. Такие регионы известны как угловые узлы.
Например, если наблюдается первая сферическая орбиталь, быстро делается вывод, что она симметрична во всех направлениях; Однако это не относится к другим орбиталям, формы которых показывают пустые пространства. Их можно наблюдать в начале декартовой плоскости и в мнимых плоскостях между долями.
Вероятность нахождения электронной и химической связи
Чтобы определить истинную вероятность нахождения электрона на орбите, необходимо рассмотреть две функции: радиальную и угловую. Поэтому недостаточно предположить угловую составляющую, то есть проиллюстрированную форму орбиталей, а также то, как изменяется ее электронная плотность по отношению к расстоянию до ядра..
Тем не менее, потому что адреса (мл) отличать одну орбиту от другой, целесообразно (хотя, возможно, и не совсем правильно) рассматривать только ее форму. Таким образом, описание химической связи объясняется перекрытием этих фигур.
Например, сравнительное изображение трех орбиталей показано выше: 1 с, 2 с и 3 с. Обратите внимание на его радиальные узлы внутри. У орбиты 1 с нет узла, а у двух других есть один и два узла.
При рассмотрении химической связи легче иметь в виду только сферическую форму этих орбиталей. Таким образом, орбита ns приближается к другому, и на расстоянии р, электрон сформирует связь с электроном соседнего атома. Отсюда возникает несколько теоретических (TEV и TOM), которые объясняют эту ссылку.
Как они символизируются?
Явные атомные орбитали явно обозначаются как: пмл.
Квантовые числа принимают целые значения 0, 1, 2 и т. Д., Но для символизации орбиталей оставляют только N числовое значение В то время как для L, целое число заменяется соответствующей буквой (s, p, d, f); и для мл, переменная или математическая формула (за исключением мл= 0).
Например, для орбиты 1 с: N= 1, с = 0 и мл= 0 То же самое относится ко всем ns-орбиталям (2s, 3s, 4s и т. Д.).
Чтобы символизировать остальные орбитали, необходимо обратиться к их типам, каждый из которых имеет уровни энергии и свои собственные характеристики..
тип
S орбитали
Квантовые числа L= 0 и мл= 0 (в дополнение к его радиальной и угловой составляющим) описывают орбиталь сферической формы. Это тот, который возглавляет пирамиду орбиталей исходного изображения. Кроме того, как видно на изображении радиальных узлов, можно ожидать, что орбитали 4, 5 и 6 имеют три, четыре и пять узлов..
Они характеризуются симметричностью, и их электроны испытывают больший эффективный заряд ядра. Это потому, что их электроны могут проникать во внутренние слои и зависать очень близко к ядру, что оказывает на них положительное притяжение.
Орбитали р
Обратите внимание, что каждая гантель расположена вдоль декартовой оси. х, и и Z. Следовательно, эта орбита p, расположенная на оси x, обозначается как pх; один на оси у, ри; и если он указывает перпендикулярно плоскости ху, то есть на оси z, то это рZ.
Все орбитали перпендикулярны друг другу, то есть они образуют угол 90º. Кроме того, угловая функция исчезает в ядре (начало декартовой оси), и существует только вероятность обнаружения электрона внутри лепестков (чья плотность электронов зависит от радиальной функции)..
Плохой экранирующий эффект
Электроны этих орбиталей не могут проникать во внутренние слои с той же легкостью, что и s-орбитали. Сравнивая их формы, p-орбитали кажутся ближе к ядру; однако ns электроны чаще всего встречаются вокруг ядра.
Каковы последствия вышесказанного? Что NP-электрон испытывает меньший эффективный заряд ядра. И, кроме того, последнее дополнительно уменьшается за счет эффекта экранирования орбиталей. Это объясняет, например, почему атом с гибридной орбитальной sp 3 она менее электроотрицательна, чем у sp-орбиталей 2 или зр.
Также важно отметить, что каждая гантель имеет угловую узловую плоскость, но не имеет радиального узла (2p орбитали больше ничего). То есть, если бы он был разрезан, внутри него не было бы слоев, подобных орбите 2s; но начиная с 3p орбиты, радиальные узлы начали бы наблюдаться.
Эти угловые узлы ответственны за то, что внешние электроны испытывают плохой экранирующий эффект. Например, электроны 2s экранируют электроны 2p-орбиталей в большей степени, чем электроны 2p по сравнению с электронами 3p.
Px, Py и Pz
г орбитали
Их формы делают их еще менее эффективными в защите эффективной ядерной нагрузки. Почему? Потому что у них больше узлов, с помощью которых ядро может притягивать внешние электроны.
Следовательно, все d-орбитали способствуют увеличению атомных радиусов, которые менее выражены от одного уровня энергии к другому..
F-орбиталей
Каждая из угловых функций представляет собой лепестки сложной формы и несколько узловых плоскостей. Поэтому они еще меньше экранируют внешние электроны, и это явление объясняет то, что известно как сокращение лантаноида.
По этой причине для тяжелых атомов нет выраженного изменения их атомных радиусов уровня N другому n + 1 (От 6n до 7n, например). На сегодняшний день 5f орбитали являются последними найденными в естественных или искусственных атомах.
Имея все это в виду, пропасть открывается между тем, что известно как орбита и орбитали. Хотя дословно они похожи, на самом деле они очень разные.
Концепция атомной орбитали и орбитальный подход позволили объяснить химическую связь и то, как это может, так или иначе, повлиять на молекулярную структуру.