Что такое ортопедический синдром
Что такое ортопедический синдром
Пермский государственный медицинский университет им. акад. Е.А. Вагнера
Пермская государственная медицинская академия им. акад. Е.А. Вагнера Минздравсоцразвития России; краевая больница системы исполнения наказаний России, Пермский край
Пермский государственный медицинский университет им. акад. Е.А. Вагнера
ООО ЛПП «Санаторий-профилакторий «Алмед», ул. Кировоградская, 112, Пермь, Российская Федерация, 614032
Диагностика и рациональное лечение легкой нейроортопедической патологии у детей и подростков
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015;92(2): 23-27
Щеколова Н. Б., Кравцова Е. Ю., Ненахова Я. В., Лихачева Л. В. Диагностика и рациональное лечение легкой нейроортопедической патологии у детей и подростков. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2015;92(2):23-27.
Shchekolova N B, Kravtsova E Iu, Nenakhova Ya V, Likhacheva L V. Diagnostics and the rational treatment of mild neuro-orthopedic pathology in children and adolescents. Voprosy kurortologii, fizioterapii, i lechebnoi fizicheskoi kultury. 2015;92(2):23-27.
https://doi.org/10.17116/kurort2015223-27
Пермский государственный медицинский университет им. акад. Е.А. Вагнера
Цель — изучить легкие нейроортопедические нарушения у детей и подростков с учетом этиологических, патофизиологических и клинических особенностей, разработать программу дифференцированного лечения. Материал и методы. Обследованы 100 детей в возрасте от 3 до 15 лет с асимметрией длины нижних конечностей малой величины с перекосом таза первичного (идиопатического) генеза и при патологии опорно-двигательной системы известной этиологии (вторичные). Проводили топографическое и электромиографическое обследование. Изучали вегетативную дисфункцию. Результаты. Легкая нейроортопедическая патология формируется в процессе роста и развития ребенка на фоне нейромышечных и вегетативных расстройств. Целенаправленное консервативное лечение, диспансерное наблюдение предотвращают прогрессирование патологии.
Пермский государственный медицинский университет им. акад. Е.А. Вагнера
Пермская государственная медицинская академия им. акад. Е.А. Вагнера Минздравсоцразвития России; краевая больница системы исполнения наказаний России, Пермский край
Пермский государственный медицинский университет им. акад. Е.А. Вагнера
ООО ЛПП «Санаторий-профилакторий «Алмед», ул. Кировоградская, 112, Пермь, Российская Федерация, 614032
В настоящее время к здоровью подрастающего поколения предъявляются все более жесткие требования. Одной из актуальных медицинских проблем является прогрессирующая нейроортопедическая патология. Наиболее частым ее проявлением является сочетание вегетативной дистонии с перекосом таза и асимметрией длины нижних конечностей малой величины. Ортопедический «дефект» часто не только является косметическим, но может привести к стойким патологическим нарушениям статики и биомеханики скелета, что особенно важно для растущего организма [1—5]. При этом легкие нейроортопедические нарушения являются адаптационными проявлениями опорно-двигательной системы к биомеханически аномальным условиям функционирования с вовлечением в патологический процесс сегментарного отдела аппарата вегетативной нервной системы [5—8].
Цель исследования — изучить легкие нейроортопедические нарушения у детей и подростков с учетом этиологических, патофизиологических и клинических особенностей, разработать программу дифференцированного лечения.
Материал и методы
Критерием включения в исследование было наличие у детей и подростков в возрасте от 3 до 15 лет асимметрии длины нижних конечностей малой величины с перекосом таза первичного (идиопатического) и вторичного (при патологии опорно-двигательной системы известной этиологии) генеза. Разница в длине конечностей составила от 0,5 до 3,0 см. Дети наблюдались ортопедом и неврологом детских поликлиник, дальнейшее реабилитационное лечение проводилось в санаториях Пермского края. Всего обследовано 100 детей. Девочки составили 55% (55 детей), мальчики — 45% (45 детей). Были сформированы 2 группы.
В 1-ю группу (основная) были включены 64 ребенка с первичным перекосом таза и асимметрией длины нижних конечностей малой величины. Во 2-ю группу (сравнения) — 36 детей с вторичным перекосом таза и асимметрией длины нижних конечностей малой величины. У этих больных диагностировали гемипаретический вариант детского церебрального паралича легкой степени.
В каждой группе дети были разделены на возрастные подгруппы. Младшую возрастную подгруппу составили 15 детей в возрасте от 3 до 7 лет (старший дошкольный возраст). Среднюю возрастную подгруппу — 50 детей в возрасте от 8 до 12 лет (младший школьный возраст). Старшая возрастная подгруппа — 35 детей от 13 лет до 15 лет (средний школьный возраст). У всех детей подробно изучали особенности наследственного и акушерского анамнеза, периода новорожденности, первого года жизни.
В основной группе большинство составили девочки среднего возраста — 32 (50%) ребенка. У 15 (23,4%) матерей указанной группы детей отмечали осложнения течения беременности и родов. У 43 (67,1%) детей была диагностирована разнообразная сопутствующая патология: 15,6% обследуемых (10 детей) наблюдались по поводу вегетативно-сосудистой дистонии, 12,5% (8 детей) страдали неврозом, патология пищеварительной системы выявлена у 14% обследуемых (9 детей), сердечно-сосудистой системы — у 12,5% (8 детей), дыхательной — у 9,3% (6 детей). Асимметрия длины нижних конечностей на 0,5 см диагностирована у 17 (26,6%) детей; на 1 см — у 40 (62,5%); на 2 см — у 4 (6,2%); на 2,50 см — у 3 (4,7%) детей.
В группе сравнения девочек было 19 (52,8%), мальчиков — 17 (47,2%). По данным акушерско-гинекологического анамнеза, у 33 (91,7%) матерей отмечалось осложненное течение беременности (угроза прерывания, токсикоз второй половины беременности, внутриутробное инфицирование и т. д.), у 24 (66,7%) женщин выявлена патология родовой деятельности. У 15 (41,7%) детей сопутствующая патология была представлена преимущественно заболеваниями пищеварительной системы. Укорочение нижней конечности на 0,5 см диагностировано у 5 (13,8%) детей; на 1 см — у 15 (41,7%); на 1,5 см — у 4 (11,1%); на 2 см — у 5 (13,9%); на 2,5 см — у 5 (13,9%); на 3 см — у 2 (5,6%) детей.
Всем детям для диагностики ортопедической патологии и оценки эффективности проводимого лечения использовали метод компьютерной оптической топографии (КОМОТ). Оценивали следующие основные топографические параметры: FP — угол перекоса таза относительно горизонтали; FT — угол наклона туловища во фронтальной плоскости относительно вертикали; PTI — общий интегральный индекс; PTI-F —интегральный индекс нарушения формы туловища во фронтальной плоскости; GT — угол скручивания туловища (поворота плечевого пояса относительно таза); LA — угол латеральной асимметрии, показатель латерального отклонения оси позвоночного столба (топографический аналог угла по Коббу); P — показатель величины патологической ротации на вершине сколиотической дуги; ST — угол наклона туловища в сагиттальной плоскости. Для оценки биоэлектрической активности мышц спины и нижних конечностей проводили электронейромиографическое исследование [7—12]. Изучали вегетативную дисфункцию по методике А.М. Вейна и соавт. (2003). Характеристика болевого синдрома проводилась в баллах по визуальной аналоговой шкале (ВАШ).
Результаты и обсуждение
Среди детей обследуемых групп доминировало укорочение левой нижней конечности. В 1-й группе укорочение бедра выявлено у 30 (46,9%) детей, укорочение голени — у 34 (53,1%). Во 2-й группе у 15 (41,7%) детей наблюдалось укорочение бедра, у 8 (22,2%) — голени и у 13 (36,1%) — обоих сегментов нижней конечности.
Особенности болевого синдрома и вегетативной дисфункции у детей с легкой нейроортопедической патологией
Болевой синдром регистрировался у каждого 3-го ребенка среднего и старшего возраста обеих групп преимущественно после физической нагрузки. Артралгический вариант болевого синдрома диагностировали в 58,7%, миофасциальный в 41,3% случаев. Боль была хроническая, рецидивирующая, умеренная, средней интенсивности. При анализе вегетативного тонуса и вегетативной реактивности в 1-й группе у детей младшего возраста доминировала выраженная фоновая симпатикотония, свидетельствующая о перенапряжении регуляторных систем. У детей старшего возраста 1-й и 2-й групп вегетативный баланс имел тенденцию смещения в вагальную сторону. У детей 1-й группы отметили снижение количества нормальных реакций и увеличение количества реакций повышенной, пониженной и извращенной реактивности по сравнению с больными 2-й группы (табл. 1).

Напряжение регуляции синусового сердечного ритма по данным индекса Кердо характеризовало дисфункцию интегративных систем мозга, ответственных за адаптационные реакции, преимущественно у детей основной группы [7, 11, 12].
Топографические и электромиографические изменения у детей с легкой нейроортопедической патологией
Во всех группах доминировало нарушение осанки во фронтальной плоскости (сколиотическая осанка). Более значимое нарушение осанки регистрировали у детей 2-й группы, у которых отмечался выраженный перекос таза и наклон туловища во фронтальной плоскости с поворотом плечевого пояса относительно таза в горизонтальной плоскости [7, 8, 12]. Анализ топографических показателей в возрастных подгруппах свидетельствовал о том, что в процессе роста ребенка нарушение осанки прогрессировало.
В основной группе у детей младшего возраста регистрировали выраженное нарушение осанки во фронтальной плоскости. Угол перекоса таза был выше нормы в 2 раза, угол латеральной асимметрии — в 7 раз (FP — 2,12±0,72°; LА — 6,35±1,71°; GT — 0,49±0,01°; p 
У всех пациентов в процессе диспансерного наблюдения отмечалась динамика роста. В 1-й группе рост детей в среднем увеличился на 0,89±0,01 см, преимущественно за счет длины нижних конечностей. Длина туловища увеличилась на 0,32±0,01 см, длина нижних конечностей — на 0,57±0,02 см. Во 2-й группе рост детей увеличился на 0,64±0,02 см, также в основном за счет длины нижних конечностей. Длина нижних конечностей увеличилась на 0,39±0,01 см, туловища — на 0,25±0,01 см. Среднее укорочение сократилось на 10% и составило 0,64±0,21 см (р
Что такое ортопедический синдром
Погорелова Любовь Николаевна
заведующая отделением общей неврологии,
врач-невролог высшей квалификационной категории
Остеохондроз и его профилактика
Остеохондроз и причины его возникновения
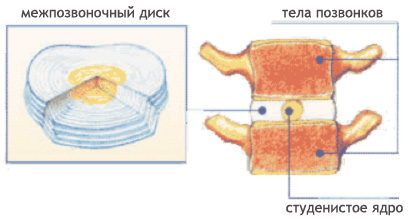
Тела позвонков на разрезе
Амортизирующая функция межпозвоночного диска
При остеохондрозе диски теряют упругость, расплющиваются, растрескиваются
По статистике чуть ли не каждый второй человек в возрасте от 25 до 55 лет страдает остеохондрозом. Но в основном люди начинают чувствовать проявления остеохондроза после 35 лет. Развитию и обострению остеохондроза позвоночника способствуют статические и динамические перегрузки, а также вибрация.
Это может быть вызвано:
Но нельзя сказать, что если вы будете в точности следовать всем указаниям, то остеохондроз вам не грозит. Ведь причиной возникновения этого заболевания могут быть травматические повреждения.
ВИДЫ ОСТЕОХОНДРОЗА
По локализации различают шейный, грудной, поясничный, крестцовый и распространенный остеохондроз. Чаще всего диагностируется поясничный остеохондроз (свыше 50% случаев), шейный (более 25%) и распространенный (около 12%).
Остеохондроз шейного отдела позвоночника
Шея предназначена природой не только для того, чтобы удерживать голову и поворачивать ее в разные стороны, что, кстати, с годами для людей нетренированных, не следящих за своим здоровьем, становится делом довольно сложным. Через область шеи проходят спинной мозг, артерии, питающие головной мозг, нервные корешки и стволы, осуществляющие нервную связь с руками, сердцем, легкими.
Жалобы при этом виде остеохондроза самые разнообразные: боли в сердце, головные боли, головокружение с кратковременной потерей сознания (из-за нарушений кровоснабжения головного мозга), боли в плечевом суставе или по всей руке.
Остеохондроз грудного отдела позвоночника
Боль, возникающая время от времени в грудном отделе позвоночника, знакома каждому, кто занимается тяжелым физическим трудом. Как правило, эти болезненные, неприятные ощущения служат первым признаком того, что в организме начинает развиваться достаточно неприятное заболевание – остеохондроз грудного отдела позвоночника. Часто этот недуг поражает лиц, так называемых сидячих профессий: конструкторов, операторов ЭВМ, водителей автомашин.
Но совсем необязательно, что у вас, даже если вы каждый день перетаскиваете тяжелые предметы или вынуждены долгие часы сидеть за письменным столом, будет остеохондроз.
Остеохондроз поясничного отдела позвоночника
Вначале возникают тупые боли в области поясницы и в ногах, затем обычно отмечаются онемение конечностей, значительное увеличение болей при резких движениях туловищем, при тряске.
ПРОФИЛАКТИКА
Профилактика остеохондроза шейного отдела позвоночника
Выполнение упражнений в течение длительного времени — надежная профилактика остеохондроза шейного отдела позвоночника. Вот ряд упражнений для профилактики этого вида остеохондроза:
Эти упражнения рекомендуется включать в утреннюю гигиеническую гимнастику, а также выполнять их в течение рабочего дня. Делать их можно и сидя и стоя. Однако совершать круговые вращательные движения головой нельзя ни в коем случае. Это может привести к травме.
Профилактика остеохондроза грудного отдела позвоночника
Если вы к тому же будете регулярно выполнять упражнения (указанные ниже) развивающие и поддерживающие тонус мышц спины и живота, обеспечивающие нормальную подвижность всех сегментов грудного отдела позвоночника, то остеохондрозу вас не одолеть.
ОРТОПЕДИЧЕСКИЙ РЕЖИМ
Как правильно сидеть
Как правильно стоять
Когда человек долго стоит, позвоночник испытывает значительные нагрузки, особенно поясничный его отдел.
Как правильно лежать
Спать лучше не на мягкой постели, но и не на досках. Постель должна быть полужесткой, чтобы тело, когда человек лежит на спине, сохраняло физиологические изгибы (шейный лордоз, грудной кифоз и поясничный лордоз). Для этого:
Встать с постели утром больным с острыми проявлениями остеохондроза бывает очень трудно. Поступайте так:
И еще один совет. Тем, кто любит баню, предпочтительнее сухой пар (сауна), а во время обострения и от сауны придется отказаться.
Как правильно поднимать и перемещать тяжести
Как правильно переносить тяжести
Как правильно поднимать тяжести
Хронические миогенные болевые синдромы в спине: механизмы развития и подходы к лечению
Боль в спине – наиболее распространенное состояние в структуре обращаемости за медицинской помощью. По данным эпидемиологического исследования, проведенного в городской поликлинике г. Москвы, из 1300 первичных пациентов, обратившихся за амбулаторной медицинской помощью, у 24,9% основной причиной обращения была боль в пояснично–крестцовой области [14]. По результатам изучения эпидемиологии болевых синдромов у взрослого населения России распространенность хронической боли в спине и шее составляет до 56,7% [7].
Результаты эпидемиологического исследования, включавшего опрос более 46 тысяч жителей разных стран Европы и Израиля, показали, что хронической болью в спине (без уточнения локализации) страдает 24%, болью в поясничной области – 18%, а болью в шее – 8% населения [20]. Традиционно считается, что большинство пациентов с острой болью в спине полностью выздоравливают [27]. Однако в противовес мнению о хорошем прогнозе боли в спине, М. Van Korff с соавт. (1993), основываясь на данных ранее проведенных исследований, указывают на менее благоприятный прогноз: до 40% пациентов после острого эпизода продолжают испытывать боль в поясничной области в течение 6 месяцев, а 62% пациентов отмечают повторные обострения в течение ближайшего года [51]. Психосоциальные факторы риска являются наиболее статистически значимыми и потенциально модифицируемыми факторами риска хронизации боли в спине. Психологический «портрет» пациента, склонного к хронизации боли в спине – человек, страдающий депрессией, страшащийся боли или повреждения позвоночника, сконцентрированный на собственном состоянии и неспособный найти оптимальную (активную) стратегию преодоления боли.
На основании различных патофизиологических механизмов выделяют ноцицептивную, невропатическую и психогенную боль.
Ноцицептивная боль связана с активацией болевых рецепторов – ноцицепторов. Она, как правило, острая, соответствует степени тканевого повреждения и длительности действия повреждающих факторов. Ноцицептивные болевые синдромы возникают в результате активации ноцицепторов при травме, воспалении, ишемии, чрезмерном растяжении тканей. Примерами являются боли при воспалении суставов позвоночника. В случае вовлечения в патологический процесс костной или мышечной ткани возникает ощущение тупой, ноющей боли. Эта боль усиливается при движении, ослабевает в покое и обычно хорошо локализована. Боль, являющаяся прямым следствием заболевания или повреждения соматосенсорной системы, называется невропатической. Невропатическая боль в шее и спине обычно связана с поражением корешков при формировании грыжи межпозвоночного диска. Она может возникать при стенозе позвоночного канала, спондилолистезе, компрессии корешков спинномозговых нервов остеофитами и гипертрофированными фасеточными суставами. Психогенная боль в спине «в чистом виде» встречается редко. Она крайне трудна для диагностики, поскольку при наличии у пациента психических нарушений возможно и существование скелетно–мышечных и других неврологических расстройств, которые могут вызывать имеющуюся у больного симптоматику. В том случае, когда наличие выраженной боли, вызывающей дистресс и отмечающейся почти постоянно на протяжение по меньшей мере 6 мес, не может быть адекватно объяснено физическими причинами или соматическим заболеванием, возможна постановка диагноза соматоформного болевого расстройства.
Хроническая боль в спине может формироваться с участием всех трех патофизиологических механизмов: ноцицептивного, невропатического и психогенного. Показано, что у пациентов с хронической болью в спине даже в отсутствие четких клинических признаков поражения корешков могут формироваться боли, формально соответствующие характеристикам невропатического болевого синдрома. Использование специального опросника для диагностики невропатической боли Paindetect и оценочной шкалы невропатических симптомов и признаков университета г. Лидс (LANSS) позволило выявить признаки невропатической боли у 37–54,7% пациентов с хронической болью в спине [31,40]. По данным Российского эпидемиологического исследования распространенности невропатической боли, в качестве основной причины развития невропатического болевого синдрома боли в поясничном отделе позвоночника выявлялись у 34,74% опрошенных, боли в шее – у 11,90%, боли в грудном отделе – в 3,94% случаев [15].
Высокая частота характеристик боли, типичных для невропатического болевого синдрома, у пациентов со скелетно–мышечными болями в спине может быть обусловлена наличием у них клинических признаков сенситизации, например, формирование гипералгезии (усиление ощущения боли при нанесении укола тупой иглой в зоне локализации боли и на участке кожи вне зоны боли), аллодинии – болевого ощущения, возникающего при нанесении стимула неболевой модальности и отраженной боли. Кроме этого, по данным R. Freynhagen с соавт. (2008), возможно, определенная часть пациентов с хронической болью в спине с иррадиацией в ногу даже в отсутствие клинических признаков поражения корешков может страдать невропатическим болевым синдромом на фоне субклинического их страдания [32]. Наконец, при оценке характеристик болевого синдрома необходимо учитывать и психологические особенности пациентов, когда выбор разных характеристик боли (в том числе формально соответствующих невропатическому болевому синдрому), а также наличие распространенной болезненности при пальпации паравертебральной области может являться проявлением болевого поведения и отражать психогенные механизмы формирования боли. В свою очередь, у пациентов с психогенными болевыми синдромами, как правило, выявляются негрубые скелетно–мышечные нарушения, которые не могут объяснить степень выраженности болевых ощущений и психологического дистресса. При этом они могут служить как «субстратом» формирования психогенной боли и болевого поведения, так и следствием детренированности мышц, нагрузка на которые приводит к усилению болевых ощущений.
Определение механизмов боли у конкретного больного позволяет выpабатывать патофизиологически обоснованную стpатегию лечения.
В случае хронической боли в спине нужно стремиться максимально точно локализовать источник болевой импульсации, даже с применением при необходимости инвазивных методов (например, диагностических блокад) и обязательно учитывать роль психосоциальных факторов, оказывающих большое влияние на хронизацию боли в спине. В данной статье будут обсуждаться только основные причины скелетно–мышечной боли в спине: миофасциальный и мышечно–тонический синдромы и фибромиалгия.
Очень часто невозможно отличить боль, источником которой является сустав, от боли, обусловленной повреждением мышц или их сухожилий, связанных с суставом. Например, воспалительные изменения, затрагивающие сустав часто распространяются и на прилежащие к нему мягкие ткани, включая мышцы. Рас-пространенные болевые синдромы выявляются у 20–25% пациентов, страдающих ревматоидным артритом или системной красной волчанкой. Альгогенные вещества, такие как брадикинин, серотонин, простагландины, выделяющиеся при воспалении суставов, играют важную роль в формировании мышечной боли. Патология сустава может вызывать перегрузку мышц, которая приводит к формированию локальной мышечной боли. Боль в мышцах может быть локальной и распространенной. Состоянием, для которого характерна локальная боль в мышце, сопровождающаяся формированием отраженной боли, является миофасциальный болевой синдром (МФБС). К формированию распространенной боли в мышцах приводят системные заболевания соединительной ткани, полимиозит, фибромиалгия.
Миофасциальный болевой синдром (МФБС)
Определенные трудности вызывает терминология, применяемая для описания состояния мышц, в случаях, когда они являются источниками боли. В руководстве для специалистов по боли, изданном Международной ассоциацией по изучению боли, отмечается, что термин «миофасциальная боль» может применяться как в широком значении, включающем все виды мышечной боли, так и в узком, когда облигатно выявление триггерных зон (ТЗ) в мышцах [23].
ТЗ – участок локального продольного уплотнения, расположенный по направлению мышечных волокон, при раздражении которого (пальпаторном, уколом, перкуссией) вызывается местная болезненность и иррадиации боли. Размер ТЗ составляет от 2 до 5 мм. Хотя при МФБС, как правило, неврологической симптоматики, свидетельствующей о поражении нервной системы, не выявляется, пациенты могут жаловаться на ощущение «онемения», «ползание мурашек», покалывание в зоне иррадиации боли. Для каждой ТЗ характерна своя строго определенная область отраженной боли и парестезий. При этом минимально необходимыми для диагностики ТЗ признаками является локальная болезненность в пределах пальпируемого тяжа в мышце и воспроизводимость спонтанной боли при его пальпации. Диагноз МФБС ставится на основе клинического обследования [43].
Критерии МФБС [по I. Russell, 2008, с изменениями]: Основные (необходимые) критерии
Паттерны боли, отраженной от мышц, детально описаны J.G. Travell и D.G. Simons и наиболее стабильно воспроизводятся при исследовании мышц плечевого пояса (1989) [10]. Проблема диагностики МФБС состоит в том, что относительно большое количество мышц потенциально может принимать участие в развитие МФБС, и, соответственно, врач должен владеть методикой мануального исследования различных мышц.
Затруднения связаны с различной конституцией пациентов, толщиной подкожной жировой клетчатки, глубиной залегания мышц. Особенно трудно доступны пальпации мышцы ног и ягодичной области (например, глубоко залегающая грушевидная мышца). Воспроизводимость диагноза МФБС при сравнении результатов обследования пациентов двумя независимыми обученными для диагностики МФБС специалистами остается низкой. Это отчасти объясняется тем, что области мышечного уплотнения с участками локальной болезненности и даже типичными паттернами отраженной боли и локальным сокращением мышцы нередко выявляются и в здоровой популяции. Показано, что в наибольшей степени пациентов с МФБС от здоровых отличают ограничение движений в пораженной мышце, уменьшение в ней силы (при активном сопротивлении, из–за возникающей при движении боли) и снижение болевого порога, выявляемого при альгометрии [49].
Кроме скелетно–мышечных нарушений, у пациентов с МФБС нередко отмечаются расстройства сна и сопутствующие эмоциональные нарушения (тревожность и депрессия). Несмотря на продолжающуюся дискуссию о МФБС, как самостоятельной нозологической единице, с прямо противоположными точками зрения [25,50], большинство (88%) исследователей и специалистов в области болевых синдромов диагноз МФБС считают правомочным [49]. Задачей врача является диагностика МФБС в качестве причины боли в спине и конечностях для последующего ее устранения.
Показано, что при МФБС бО льшая болезненность отмечается в так называемых «статических» (тонических) мышцах, находящихся в состоянии длительного напряжения для поддержания определенного положения тела, т.е. несущих позную нагрузку. Примером такой «статической» мышцы является надостная мышца. В отличие от «статических» мышц, «фазические» мышцы «включаются» только при необходимости выполнения движения. Примером «фазической» мышцы является четырехглавая мышца бедра, которая задействуется только при динамической нагрузке. Даже у здорового человека с высокой частотой выявляется болезненность и уплотнения при пальпации «статических» мышц [28], что следует учитывать при обследовании больных.
Для лечения МФБС применяют комплексный подход. Для купирования болевого синдрома показана эффективность нестероидных противовоспалительных препаратов (НПВП). При лечении острой и хронической скелетно–мышечной боли в спине доказательность применения этой группы лекарственных средств относится к уровню А [13,48].
Диклофенак натрия (Вольтарен) остается «золотым стандартом» эффективности НПВП. При этом ни один из существующих НПВП не показал доказанно большей эффективности при лечении острой и хронической боли в спине, чем диклофенак натрия (Вольтарен). В отношении риска серьезных поражений желудочно–кишечного тракта, несмотря на неселективность в отношении ингибирования циклооксигеназы, диклофенак принадлежит к одним из наиболее безопасных неселективных НПВП (сравним с ибупрофеном и ацеклофенаком) [43,47]. В исследовании эффективности НПВП при хронической боли в спине показано, что частота развития нежелательных явлений со стороны желудочно–кишечного тракта при применении диклофенака натрия в дозе 150 мг/сут в течение 1 месяца была сопоставима с таковой для специфического ингибитора ЦОГ–2 эторикоксиба в дозе 60 мг/сут. [56].
Для уменьшения частоты побочных явлений Вольтарен при хронической боли в спине не рекомендуется применять длительно (более 14 дней). Суточная доза препарата в зависимости от выраженности болевого синдрома может варьировать от 75 до 150 мг/сут. По соотношению эффективности и переносимости Вольтарен является препаратом выбора для лечения скелетно–мышечных болевых синдромов у пациентов без серьезных факторов риска развития НПВП–гастропатии и заболеваний сердечно–сосудистой системы.
Необходимо помнить, что редко Вольтарен вызывает гепатотоксические осложнения. Востребованность Вольтарена подтверждается еще и количеством генериков диклофенака, которых на сегодняшний день в России более 100. Ведущие эксперты высказывают сомнение в возможности переносить данные по эффективности и безопасности оригинального препарата Вольтарен на его генерики, многие из которых не проходили серьезной клинической оценки [5,12,38,54]. Вольтарен может применяться для лечения боли в спине у лиц пожилого возраста без серьезной сопутствующей соматической патологии и у пациентов с поражением желудочно–кишечного тракта в анамнезе (без тяжелых осложнений) в сочетании с ингибиторами протонной помпы.
Большая роль при лечении МФБС принадлежит местному лечению – растяжению, массажу заинтересованной мышцы и ТЗ, воздействию теплом или холодом, ультразвуком, чрескожной нейростимуляцией, инъекциям местных анестетиков в ТЗ. Считается, что при МФБС наиболее эффективны инъекции местных анестетиков в ТЗ. Обычно вводят 0,5–1 мл 0,5% pаствоpа новокаина. Новокаин считается наименее миотоксичным местным анестетиком. Для усиления эффекта блокад дополнительно применяют пассивное растяжение мышцы или использование релаксирующих приемов мануальной терапии [4,41].
Для уточнения эффективности введения ботулотоксина в ТЗ проведено несколько рандомизированных контролируемых исследованиях, систематизированных в обзоре K. Ho и К. Tan [36]. Четыре из пяти проанализированных рандомизированных контролируемых исследований не подтвердили эффективность инъекций ботулотоксина при МФБС.
К другим местным методам лечения относятся массаж, применение ультразвука (в непpеpывном или импульсном pежиме интенсивностью 0,2–0,5 Вт/см2 вокpуг ТЗ). При МФБС возможно применение чрескожной электронейростимуляции, однако ее эффективность, как и большинства методов физиотерапии, при МФБС четко не доказана. По данным нескольких рандомизированных контролируемых исследований, при МФБС потенциальной эффективностью обладает акупунктура. Курс лечения составляет от 10 до 15 сеансов.
Важное место занимают аппликации на болевые участки кожи гелей, мазей, как противовоспалительных, так и раздражающих. Расслабление спазмированной мускулатуры, кроме того, достигается при помощи постизометрической релаксации [4].
Иногда для устранения ТЗ применяется методика прессуры или ишемической компрессии ТЗ. При этом производится энергичное пальцевое давление на ТЗ в течение 1–2 минут. Считается, что это воздействие вызывает фазные изменения кровотока (ишемия и реактивное полнокровие), которые, возможно, лежат в основе лечебного эффекта. Различные методы релаксации мышц подробно описали Г.А. Иваничев (2005), Р.Г. Есин с соавт. (2003), Д.Г. Тревел и Д.Г. Симонс (1989), Л. Фергюсон и Р. Гервин (2008) и др.
Целесообразно применение миорелаксантов: тизанидина (Сирдалуда) (2 мг 3 раза в сутки, при необходимости, дозу постепенно повышают до 8–12 мг/сут. в 3 приема), толперизона (300–450 мг/сут. в 3 приема), баклофена (5 мг 2 раза в сутки с постепенным повышением дозы каждые 5 дней до 30 мг/сут.). Применение миорелаксантов способствует регрессу не только активных, но и латентных ТЗ, то есть улучшает отдаленный прогноз, снижая возможность рецидивирования МФБС [53]. При хроническом течении МФБС целесообразно добавление к терапии антидепрессантов, обладающих собственной анальгетической активностью: амитриптилина (50–75 мг/сут), венлафаксина (75–150 мг/сут.), дулоксетина (60–120 мг/сут.), милнаципрама (50–100 мг/сут.).
Мышечно–тонические синдромы
Больные с мышечно–тоническими синдромами жалуются на боли в позвоночнике или в мышцах плечевого и тазового пояса, которые уменьшаются после отдыха, растирания, разминания и растяжения мышцы. Боль нередко носит «стягивающий» характер. Визуально можно определить изменение контура, «выбухание» мышцы, которая при пальпации может иметь повышенную плотность. Произвольные движения с вовлечением спазмированной мышцы совершаются в неполном объеме. Компрессия сосудисто–нервных структур при мышечно–тонических синдромах может вызывать иррадиацию боли в конечность, двигательные, чувствительные и вегетативные нарушения, локализующиеся в соответствующих зонах иннервации и васкуляризации.
Хроническое течение мышечно–тонических синдромов чаще всего отмечается в тех мышцах, которые испытывают позные перегрузки, например, при асимметрии конечностей, таза, выраженном сколиозе, патологии внутренних органов. Боль в этих случаях, как правило, имеет слабую или умеренную интенсивность. Пациенты предъявляют жалобы на ощущение дискомфорта, тяжести после физической нагрузки, которые уменьшаются после разминания мышцы, ее согревания. Болезненность в спазмированной мышце возникает при ее активном сокращении и обычно отсутствует при растяжении. При перерастяжении и микротравматизации мышцы на фоне ее перегрузки или при длительном вынужденном положении может возникать локальная боль. При этом в ответ на травму происходит сокращение как пораженной мышцы, так и тех мышц, которые ее окружают. Это защитное напряжение мышц обозначается, как рефлекторный мышечный спазм [1].
Таким образом, важной клинической задачей является выяснение механизма развития локального длительного мышечного напряжения – патологии внутренних органов, позвоночного двигательного сегмента, спровоцировавших спазм движения или длительной неудобной позы. Воздействие на основной пато-логический процесс в этом случае приведет к регрессу и мышечно–тонического синдрома.
Мышечно–тонические синдромы в мышце, выпрямляющей позвоночник, развиваются при дегенеративном спондилолистезе, когда соединительнотканные структуры позвоночника (волокна фиброзного кольца, фронтальная поверхность дугоотростчатых суставов и подвздошно–поясничная связка) утрачивают способность противодействовать силе гравитации. В этом случае мышце, выпрямляющей позвоночник, противодействует большая поясничная мышца, при сокращении которой к позвоночнику прикладывается сила, направленная на смещение позвонка кпереди. Вместе эти мышцы стабилизируют поясничный отдел позвоночника в сагиттальной плоскости.
Точные механизмы формирования мышечно–тонических синдромов неизвестны. Мышечно–тонической синдром может выполнять саногенетическую функцию, ограничивая пораженную область от дальнейшего повреждения. Считается, что повышение активности паравертебральных мышц в ответ на боль направлено на повышение стабильности позвоночника и таза. При нормальной работе мышц сокращение чередуется с их расслаблением. При этом на восстановление мышцы после сокращения тратится энергия основного обмена [8]. В спазмированной мышце выявлено нарушение микроциркуляции и окислительного метаболизма [6,29]. К сожалению, общепринятое упрощенное представление об изменении состояния мышечной системы в ответ на болевую стимуляцию (так называемый «порочный круг» «боль – мышечный спазм – боль») не получило достаточного подтверждения ни в экспериментальных работах, ни при клинических наблюдениях. Хорошо известно, что изменение активации мышц является неоднонаправленным. Если при острой боли в спине имеется тенденция к повышению активации паравертебральных мышц [37], то при хронической боли четких паттернов изменения ЭМГ–активации мышц не найдено [17,26]. При остром повреждении ткани и связанной с ним боли, как правило, отмечается снижение активации глубоких и повышении активации поверхностных мышц спины [37]. Длительно сохраняющиеся изменения состояния паравертебральных мышц приводят к негативным последствиям в виде повышения нагрузки на костные и связочные структуры позвоночника и таза, нарушению выполнения сложных движений в пораженном сегменте. Интересно, что изменение состояния мышц часто сохраняется, даже если боль полностью регрессирует, и может способствовать ускорению дегенеративных изменений в структурах позвоночного столба и развитию повторных эпизодов боли в спине [33]. Хорошо известно, что наличие эпизода боли в поясничной области в анамнезе является фактором риска повторного возникновения боли в спине. Показана связь изменения активации мышц брюшной стенки и снижения площади поперечного сечения многораздельных мышц с развитием повторного эпизода боли в спине [24,35].
Предположено, что изменения мышечного тонуса при хронической боли в спине очень индивидуальны и зависят от различных, часто не связанных собственно с состоянием позвоночного столба, факторов. В активации паравертебральных мышц обсуждается роль изменения возбудимости моторной и премоторной коры [21,52], мотонейронов спинного мозга [30,42] и изменение чувствительности мышечных веретен [46]. Также предположено, что нарушение двигательной адаптации после эпизода острой боли в спине может быть связано с психологическими особенностями пациентов, в частности, с их представлениями о боли в спине и формирующимся на их основе болевым поведением. Этот факт может объяснить тесную связь таких факторов риска хронической боли в спине, как наличие эпизодов боли в спине в анамнезе, и таких психологических особенностей, как выраженность соматизации и использование неадаптивных стратегий преодоления боли [37]. Считается, что определенную роль в изменении активности паравертебральных мышц при хронической боли в спине могут играть и нарушения сенсорного контроля. Пациенты с болью в спине по сравнению со здоровыми испытуемыми чаще ошибаются при выполнении движений в позвоночнике на заданный угол. Также у них отмечается уменьшение постуральных корректирующих реакций при воздействии вибрации на паравертебральные мышцы. Предполагается, что наибольший вклад в состояние паравертебральных мышц при боли в спине вносят не спинальные и стволовые механизмы, а «высшие» центры, осуществляющие интеграцию сенсомоторной информации и организацию движений [4,37].
Лечение мышечно–тонических синдромов. В большинстве случаев коррекции требует первичное состояние, вызвавшее формирование мышечно–тонического синдрома. При устранении первичного источника болевой импульсации рефлекторный мышечно–тонический синдром может регрессировать. В тех случаях, когда мышечно–тонические нарушения становятся основным или самостоятельным источником боли, применяют как местные, так и общие воздействия. Проводятся растяжение, массаж заинтересованной мышцы, воздействие согревающими физиопроцедурами, приемы мануальной терапии, направленные на мобилизация пораженного позвоночного двигательного сегмента. Целесообразна коррекция двигательного стереотипа, избегание провоцирующих нагрузок и поз. При отсутствии саногенетической роли мышечно–тонического синдрома возможно назначение НПВП (Вольтарен (75–150 мг/сут.) и др.) и миорелаксантов, обладающих анальгетическими свойствами, например Сирдалуд (6–12 мг/сут.). Согласно клиническим исследованиям был доказан обезболивающий и миорелаксирующий эффект тизанидина (Сирдалуда) в отношении острого болезненного мышечного спазма уже в течение первых 3 суток от начала лечения [39,44].
Фибромиалгия
Фибромиалгия – хронический генерализованный болевой синдром, нередко сопровождающийся постоянным чувством усталости, депрессией, нарушениями сна, ощущением скованности в мышцах и суставах.
Общепринятые критерии диагностики фибромиалгии, предложенные Американским колледжем ревматологов:
Фибромиалгия обычно развивается постепенно, чаще начинаясь с одной области тела. Определенной причины больные, как правило, назвать не могут, реже указывают на травму, эмоциональный стресс, инфекцию. Для заболевания характерны обострения и ремиссии, как правило, без влияния внешних факторов. Многие пациенты отмечают ощущение пpипухлости и скованности суставов (объективно отечности суставов может не выявляться), метеочувствительность (усиление болей в холодное вpемя года).
Уже на ранних этапах изучения проблемы фибромиалгии отмечалась роль психических нарушений. У 71% пациентов с фибромиалгией в анамнезе были указания на имевшиеся ранее депрессивные нарушения. При обследовании примерно у половины больных фибромиалгией присутствуют характерные жалобы на подавленное настроение, утрату интересов и чувства удовольствия; часты и дополнительные жалобы на снижение аппетита, нарушения сна и др. [9].
Также нередко при фибромиалгии отмечается нарушение когнитивных функций. Пациенты испытывают трудности концентрации внимания, нарушения кратковременной памяти. Они хуже выполняют нейропсихологические тесты, связанные с переключением внимания [49].
У пациентов с фибромиалгией часто (90% случаев) отмечаются нарушения сна. Они проявляются жалобами на прерывистый, поверхностный сон, трудности засыпания, повышенную двигательную активность во сне и частые пробуждения. Типичной является жалоба на отсутствие ощущения отдыха («восстановления») после ночного сна [9,49].
Обращается внимание на значение психических травм в детстве и генетических факторов. Считается, что генетические факторы и факторы окружающей среды в одинаковой степени повышают риск развития фибромиалгии.
При однофотонной эмиссионной компьютерной томографии при фибромиалгии выявляется снижение мозгового кровотока в ядрах таламуса и некоторых других структурах мозга, принимающих участие в обработке сенсорной информации, которое коррелирует с содержанием субстанции Р в цереброспинальной жидкости [45]. Возможно, значимую роль играют изменения серотонинергической и норадренергической систем мозга, приводящие к недостаточности антиноцицептивных влияний. Количество «чувствительных» зон при фибромиалгии коррелирует со снижением уровня серотонина в сыворотке крови. Подтверждением этому служит высокая терапевтическая эффективность антидепрессантов. При фибромиалгии отмечается усиление феномена «взвинчивания» нейронов задних рогов спинного мозга. Несколько нейрохимических медиаторов, возможно, играют роль в патогенезе фибромиалгии (субстанция Р, фактор роста нервов, динорфин А, глютамат, оксид азота, серотонин, норадреналин). Первые пять из перечисленных веществ принимают участие в передаче афферентных ноцицептивных сигналов. Их уровень повышен в биологических жидкостях пациентов с фибромиалгией. При первичной фибромиалгии фактор роста нервов, по–видимому, опосредует повышение концентрации субстанции Р в цереброспинальной жидкости [49]. В патогенезе фибромиалгии обсуждается роль цитокинов [34]. Генетические факторы, роль которых показана при фибромиалгии, в основном включают антигены системы гистосовместимости и локусы, кодирующие синтез серотониновых рецепторов 2А типа [49]. Причина формирования «чувствительных» зон остается неизвестной. «Чувствительные» зоны при фибромиалгии, в отличие от ТЗ при МФБС, считаются проявлениями центральной сенситизации и сами по себе не являются источниками ноцицептивной боли. В области ТЗ при МФБС выявляются биохимические изменения, которые не обнаруживаются в «чувствительных» зонах при фибромиалгии [19].
При фибромиалгии определяется избыточная альфа–активность на ЭЭГ во время 4 фазы медленноволнового сна (так называемый «альфа–дельта сон»), что отражает недостаточность торможения активности нейрофизиологических систем бодрствования во время сна. Можно отметить, что у здоровых испытуемых, подвергшихся депривации сна, отмечались симптомы (ноющие боли в мышцах, чувство недостаточного отдыха после сна), аналогичные таковым у больных фибромиалгией, причем эти симптомы наблюдались лишь у тех, в повседневной жизни которых отсутствовали регулярные физические нагрузки.
Вероятно, фибромиалгия представляет собой состояние, при котором нарушается взаимодействие ноцицептивной и антиноцицептивной систем. При этом ключевая роль принадлежит дефициту нисходящих ингибирующих влияний, который опосредуется генетическими, эндокринными и средовыми факторами, что способствует формированию центральной сенситизации, усилению и амплификации ноцицептивной импульсации на различных уровнях ЦНС.
Лечение фибромиалгии
Специфического лечения фибромиалгии нет. В лечении фибромиалгии рекомендуется использование как немедикаментозных, так и медикаментозных методов [22]. Пациенту до назначения препаратов необходимо разъяснить суть заболевания. Необходимо добиваться понимания пациентом взаимоотношений между болью, настроением, стрессом и факторами, касающимися семейных отношений. Следует настоятельно рекомендовать как взрослым пациентам, так и детям сохранять оптимальную профессиональную и учебную активность. Полезны регулярные занятия ЛФК (не реже 2 раз в неделю) с использованием аэробных упражнений, однако необходимо предупреждать пациентов о необходимости выполнять упражнения до появления легкого «ощущения сопротивления», а не «до боли». Для немедикаментозного лечения фибромиалгии также рекомендованы следующие методики: бальнеотерапия, массаж, методика обратной биологической связи (по поверхностной ЭМГ). Особое внимание рекомендуется уделять гигиене сна, как важной составляющей части терапевтического плана, психотерапевтической и лекарственной коррекции тревожных и депрессивных расстройств.
Медикаментозная терапия (с позиций доказательной медицины приведенные ниже данные относятся к рекомендациям уровня A) включает коррекцию нарушений сна, лечение депрессии и усталости. Препараты из группы трициклических антидепрессантов (ТЦА), помимо антидепрессивного эффекта, помогают улучшить сон. Низкие уровни серотонина и норадреналина коррелируют с возникновением депрессии, мышечной боли и усталостью. Применение ТЦА, таких как амитриптилин, помогает уменьшить эти симптомы. Рекомендовано применение амитриптилина в дозе 25–50 мг/сут. за 2–3 часа до сна, что дает возможность получить максимальный седативный эффект с минимальным эффектом последействия. При необходимости можно увеличивать дозу до 50–75 мг/сут. в течение следующих недель. Для лечения фибромиалгии показана эффективность прегабалина в дозе 600 мг/сут. и длительное применение (12 мес.) милнаципрама в дозе 100–200 мг/сут. [9,18].
Препаратом выбора у детей и подростков является флуоксетин (перед началом лечения рекомендуется консультация психиатра). Для дополнительного устранения боли на короткое время может назначаться трамадол (50–100 мг каждые 4–6 часов). Использование других опиоидных анальгетиков не рекомендуется. Не рекомендуется использовать кортикостероиды для лечения фибромиалгии, если при обследовании не выявлено сопутствующих заболеваний суставов и сухожилий воспалительного характера.
При отсутствии достаточного эффекта от лечения адекватными дозами амитриптилина рекомендуется добавить к лечению препарат из группы селективных ингибиторов обратного захвата серотонина (флуоксетин) в дозе 20 мг утром. Для пациента, у которого наиболее выраженными проявлениями являются боль и депрессия, применение дулоксетина может быть лечением первого выбора. В случаях, когда основными расстройствами являются боль и нарушения сна, оправдано применение прегабалина в виде монотерапии или в сочетании с дулоксетином или милнаципрамом. В ситуации сочетания умеренной выраженности боли и депрессии оптимальной является монотерапия дулоксетином или милнаципрамом [49]. Следует избегать комбинации селективных ингибиторов обратного захвата серотонина и трамадола из–за повышения риска серотонинового синдрома.
Другие подходы к лечению фибромиалгии включают коррекцию коморбидных расстройств. При неэффективности приведенных выше комбинаций препаратов для коррекции нарушений сна, а также для уменьшения выраженности тревожных расстройств возможно добавление к лечению бензодиазепинов (альпразолама в начальной дозе 0,125 мг 3 раза в сутки с ее повышением до 1–1,5 мг/сут. в течение 5–7 дней или достижения эффекта на меньшей дозе, клоназепама в начальной дозе 0,5 мг на ночь и ее повышении до 1–2 мг). Показана эффективность зопиклона и золпидема для коррекции инсомнии, при этом последний целесообразно применять через день для уменьшения вероятности развития инсомнии на его отмену. Учитывая, что снотворные средства не влияют на другие проявления фибромиалгии, нарушения сна следует начинать лечить с применения прегабалина, который доказанно уменьшает и интенсивность боли.
Пациентам, ощущающим себя «изношенными» к концу дня, рекомендуется сочетать дневную активность с короткими периодами отдыха. Если ощущение «утраты сил» или дневной сонливости отчасти связано с принимаемыми пациентом снотворными средствами или амитриптилином, добавление флуоксетина в утреннее время может уменьшить эти проявления. Прием кофеина для уменьшения выраженности и усталости, по–видимому, не оправдан, так как его стимулирующее действие обычно сменяется необходимостью отдохнуть в течение дня.
В целом, если в лечении острых скелетно–мышечных болевых синдромов основная задача лечения – купирование болевого синдрома и улучшение функциональных возможностей пациента в большинстве случаев достигается назначением НПВП в сочетании с миорелаксантами и советом поддерживать повседневную активность, при лечении хронической боли в спине важно устранение не только периферических источников болевой импульсации (сочетанием медикаментозных и немедикаментозных методов лечения), но и коррекция психологических факторов, принимающих участие в хронизации и поддержании болевого синдрома.
Литература
Ключевые слова статьи: спине, развития, лечению, синдромы, болевые