Что такое осадка в химии
Портал аналитической химии
Методики, рекомендации, справочники
Прежде всего рассмотрим процесс образования осадков. Этот процесс, несомненно, сложнее, чем можно ожидать на основании уравнения реакции. Так, судя по уравнению
Ba 2+ + SO4 2- —► BaSO4
Образовавшиеся первичные кристаллы еще не создают поверхности раздела, т. е. образование этих первых частиц твердой фазы и соединение их (агрегация) в более крупные, состоящие из десятков, сотен молекул, еще не вызывает выделения вещества в осадок. Эта стадия формирования осадка соответствует существованию коллоидных систем. Затем первичные кристаллы или их агрегаты образуют более крупные частицы и выпадают в осадок. Этот процесс может идти двумя путями, которые определяют форму осадка, т. е. образование кристаллического или аморфного осадка. В первом случае при прибавлении в раствор порций осаждающего реагента не появляются новые центры кристаллизации, новые агрегаты. Раствор некоторое время остается в пересыщенном состоянии.
При постепенном введений осадителя выделение вещества из пересыщенного раствора происходит преимущественно на поверхности ранее образовавшихся зародышевых кристаллов, которые постепенно растут, так что в конце концов получается кристаллический осадок, состоящий из сравнительно небольшого числа относительно крупных кристаллов.
Так идет осаждение обычно тогда, когда растворимость осадка не слишком мала, особенно если приняты меры к повышению ее путем нагревания или прибавления тех или иных реактивов, например кислот.
Иначе происходит процесс образования аморфных осадков. В этом случае прибавление каждой порции осадителя вызывает быстрое возникновение в жидкости огромного количества мельчайших зародышевых кристаллов, которые растут уже не вследствие отложения на их поверхности соответствующего вещества, а в результате их соединения в более крупные, агрегаты, оседающие под влиянием силы тяжести на дно сосуда. Другими словами, происходит коагуляция первоначально образующегося коллоидного раствора.
Поскольку связь между отдельными зародышевыми кристаллами в получающихся агрегатах сравнительно непрочная, эти агрегаты могут снова распадаться с образованием коллоидного раствора.
Как видно из сказанного, называть эти осадки аморфными не совсем правильно. Правильнее было бы называть их «скрытокри-сталлическими», поскольку они образуются из кристаллов, хотя и мельчайших. Действительно, наличие кристаллической решетки у аморфных осадков может быть в большинстве случаев доказано на опыте путем исследования их с помощью рентгеновских лучей, а иногда и под микроскопом.
Форма выделяющегося осадка зависит от индивидуальных свойств веществ. Например, полярные, сравнительно хорошо рас-, творимые вещества (BaSO4, AgCl, PbSO4 и т. п.) выпадают в кристаллическом состоянии.
Но та или иная форма осадка не только связана с индивидуальными свойствами вещества, но и зависит от условий осаждения. Например, при осаждении из разбавленных водных растворов BaSO4 выпадает в виде кристаллического осадка. Если, однако, осаждать его из смеси воды с 30—60% спирта, сильно понижающего растворимость сульфата бария, то образуется коллоидный раствор или аморфный осадок. С другой стороны, осаждая сульфиды в присутствии пиридина C5H5N, получают’ некоторые из них в виде кристаллов. Можно считать экспериментально
доказанным, что любое вещество может быть получено как в виде кристаллического, так и в виде аморфного осадка. Однако образование одной из этих форм обычно связано с созданием таких условий, которые неприемлемы при количественных определениях. Поэтому, в зависимости от индивидуальных свойств образующихся соединений, одни из них получаются при анализе в виде кристаллических, другие — в виде аморфных осадков. Задача аналитика состоит в том, чтобы создать условия, при которых выпадающий осадок был бы возможно более чистым и удобным для дальнейшей обработки, т. е. для отделения фильтрованием и промывания.
В заключение следует сказать, что если свежеосажденный осадок оставить на некоторое время под маточным раствором, то осадок претерпевает ряд изменений, которые называются «старением» осадка.
Оптимальные условия осаждения и старения оказываются весьма различными в случае образования аморфных и кристаллических осадков.
Выпадение осадка в химии почему происходит. Определение возможности выпадения осадка малорастворимого электролита в обменной реакции. Использование гидролиза в аналитической химии
Прежде всего рассмотрим процесс образования осадков. Этот процесс, несомненно, сложнее, чем можно ожидать на основании уравнения реакции. Так, судя по уравнению
можно думать, что для образования сульфата бария нужно только, чтобы встретились в растворе два иона: Ba2+ и SO2T. Но это, конечно, не так.
Осадок BaSO4 выпадает в виде кристаллов, а из двух ионов кристаллическая решетка построена быть не может. Процесс образования твердой фазы в растворе очень сложен.
Наличие индукционного периода объясняется тем, что образование осадка проходит через ряд стадий. В начале образуются зародышевые, или первичные кристаллы. Для их образования в пространстве должно встретиться в определенном соотношении и при определенном расположении довольно большое число реагирующих ионов. В растворе ионы окружены гидратной оболочкой, при формировании осадка она должна быть разрушена.
Образовавшиеся первичные кристаллы еще не создают поверхности раздела, т. е. образование этих первых частиц твердой фазы и соединение их (агрегация) в более крупные, состоящие из десятков, сотен молекул, еще не вызывает выделения вещества в осадок. Эта стадия формирования осадка соответствует существованию коллоидных систем. Затем первичные кристаллы или их агрегаты образуют более крупные частицы и выпадают в осадок. Этот процесс может идти двумя путями, которые определяют форму осадка, т. е. образование кристаллического или аморфного осадка. В первом случае при прибавлении в раствор порций осаждающего реагента не появляются новые центры кристаллизации, новые агрегаты. Раствор некоторое время остается в пересыщенном состоянии.
При постепенном введений осадителя выделение вещества из пересыщенного раствора происходит преимущественно на поверхности ранее образовавшихся зародышевых кристаллов, которые постепенно растут, так что в конце концов получается кристаллический осадок, состоящий из сравнительно небольшого числа относительно крупных кристаллов.
Так идет осаждение обычно тогда, когда растворимость осадка не слишком мала, особенно если приняты меры к повышению ее путем нагревания или прибавления тех или иных реактивов, например кислот.
Иначе происходит процесс образования аморфных осадков. В этом случае прибавление каждой порции осадителя вызывает быстрое возникновение в жидкости огромного количества мельчайших зародышевых кристаллов, которые растут уже не вследствие отложения на их поверхности соответствующего вещества, а в результате их соединения в более крупные, агрегаты, оседающие под влиянием силы тяжести на дно сосуда. Другими словами, происходит коагуляция первоначально образующегося коллоидного раствора.
Поскольку связь между отдельными зародышевыми кристаллами в получающихся агрегатах сравнительно непрочная, эти агрегаты могут снова распадаться с образованием коллоидного раствора.
Как видно из сказанного, называть эти осадки аморфными не совсем правильно. Правильнее было бы называть их «скрытокри-сталлическими», поскольку они образуются из кристаллов, хотя и мельчайших. Действительно, наличие кристаллической решетки у аморфных осадков может быть в большинстве случаев доказано на опыте путем исследования их с помощью рентгеновских лучей, а иногда и под микроскопом.
Форма выделяющегося осадка зависит от индивидуальных свойств веществ. Например, полярные, сравнительно хорошо рас-, творимые вещества (BaSO4, AgCl, PbSO4 и т. п.) выпадают в кристаллическом состоянии.
Но та или иная форма осадка не только связана с индивидуальными свойствами вещества, но и зависит от условий осаждения. Например, при осаждении из разбавленных водных растворов BaSO4 выпадает в виде кристаллического осадка. Если, однако, осаждать его из смеси воды с 30-60% спирта, сильно понижающего растворимость сульфата бария, то образуется коллоидный раствор или аморфный осадок. С другой стороны, осаждая сульфиды в присутствии пиридина C5H5N, получают» некоторые из них в виде кристаллов. Можно считать экспериментально
В заключение следует сказать, что если свежеосажденный осадок оставить на некоторое время под маточным раствором, то осадок претерпевает ряд изменений, которые называются «старением» осадка.
Оптимальные условия осаждения и старения оказываются весьма различными в случае образования аморфных и кристаллических осадков.
Произведение растворимости является одной из основных характеристик осадка. Пользуясь этой характеристикой, можно изменять растворимость осадка, рассчитывать оптимальные условия осаждения, предвидеть, какими реакциями осаждения лучше пользоваться для определения тех или иных ионов.
Из уравнения (3.1.) вытекают условия образования в растворе осадка:
Осадок малорастворимого электролита образуется только в том случае, когда произведение концентраций его ионов (П) в растворе превышает величину произведения растворимости этого соединения, т.е. когда раствор становится пересыщенным относительно данного малорастворимого соединения. Из ненасыщенного раствора осадок не выделяется, происходит растворение твёрдой фазы.
Решение: Найдём молярные концентрации веществ в момент смешения по формуле:
Концентрации ионов, образующих осадок, равны:
См 2 (Pb(NO) 2), т.к. при диссоциации из 1 моль соли образуется 1 моль ионов свинца.
Итак, карбонаты бария и свинца будут выпадать одновременно из раствора, если СВа 2+ >СРb 2+ в 46700 раз. Если отношение СВа 2+ / СPb 2+ >46700, то первым из раствора будет выпадать ВаСО 3 до тех пор, пока отношение СВа 2+ / СPb 2+ не будет равным 46700. И только после этого начнется одновременное выпадение осадков. Если же отношение концентрации ионов бария и свинца меньше 46700, то первым начнет осаждаться карбонат свинца. Осаждение карбоната свинца будет протекать до тех пор, пока отношение СВа 2+ / СPb 2+ не достигнет значения, при котором ВаСО 3 и РbСО 3 будут осаждаться одновременно.
ОБРАЗОВАНИЕ И РАСТВОРЕНИЕ ОСАДКОВ
1. Произведение растворимости и растворимость. Условие выпадения осадка
2. Произведение растворимости при неполной диссоциации малорастворимого соединения
3. Факторы, влияющие на полноту осаждения
4. Растворение осадков
Произведение растворимости и растворимость.
Условие выпадения осадка
Гетерогенными называются химические и физико-химические процессы, которые происходят в системах, состоящих из нескольких фаз. Фазы могут быть жидкими, твердыми и газообразными.
Фаза – это отдельные части гетерогенной системы, разграниченные поверхностями раздела.
Мы будем рассмотривать фазовое равновесие жидкость – твердое вещество, как имеющее наибольшее значение для разделения элементов, качественного и количественного определения.
Рассмотрим равновесие в системе малорастворимого сильного электролита А а В в, опустив для простоты заряды ионов:
А а В втв ó aA + bВ
Это равновесие описывается термодинамической константой равновесия:
Активность твердой фазы есть величина практически постоянная, произведение двух констант даст новую константу, которую называют термодинамическим произведением растворимости (ПР) :
В растворе над осадком малорастворимого сильного электролита произведение активностей ионов в степенях соответствующих стехиометрических коэффициентов есть величина постоянная при данных условиях (температура, давление, растворитель).
ПР Т = f (T, р, природы растворителя)
В немецкой литературе ПР обозначается Lp (löslichkeitsprodukt), в английской – Sp (solubility product).
Растворимость S – это способность веществ образовывать гомогенную систему с растворителем.
Растворимость измеряют в моль/л, г/100мл, г/мл и т.д.
Чем меньше растворимость, тем труднее растворяется электролит
Для малорастворимого сильного электролита АВ, который состоит из ионов одинаковой зарядности, растворимость S – это равновесная концентрация иона А или иона В.
Если обозначить эту концентрацию через x, то
А а В b тв ó aA + bВ
Если произведение концентраций ионов (ионное произведение) труднорастворимого электролита меньше его произведения растворимости, раствор является ненасыщенным. В тот момент, когда ионное произведение достигнет величины ПР данного электролита, раствор станет.насыщенным относительно этого электролита. Если ионное произведение превысит величину ПР, начинается выпадение осадка:
Осадок образуется в том случае, когда произведение концентраций. ионов малорастворимого электролита превысит величину произведения растворимости электролита при данной температуре.
Когда ионное произведение станет равным величине ПР, выпадение осадка прекращается. Зная объем и концентрацию смешиваемых растворов, можно рассчитать, будет ли выпадать осадок образующейся соли.
Пример. Выпадает ли осадок при смешении равных объемов 0,2 М растворов РЬ(.ЫОз) 2 и NaCl? ПРрьс1 2 =2,4-10
Из всего сказанного выше мы можем сделать вывод о влиянии различных факторов на образование осадков.
1. Влияние концентрации растворов. Трудиораство-римый электролит с достаточно большой величиной ‘ПР нельзя осадить из разбавленных растворов. Например, осадок РЬСЬ не будет выпадать при смешении равных объемов 0,1 М растворов Pb(N0 3)2 и NaCl.
При смешении равных объемов концентрации каждого из веществ станут 0,1: 2 = 0,05 М или 5-10
2 моль/л. Ионное произведение
[РЬ 2 +] [СГ] 2 = 5- Ю- 2 (5- Ю- 2) 2 = 12,5-10-».
2. Влияние количества осадителя. Для возможно более полного осаждения употребляют избыток осадителя.
Например, осаждаем соль ВаС0 3:
ВаС1 2 + Na 2 C0 3 = BaC0 3 J + 2NaCl
Большое значение имеет степень диссоциации осадителя. Концентрация ионов, вступающих в реакцию, у слабого электролита во ‘много раз меньше концентрации самого электролита, а следовательно, осаждение мало-диссоциированным реактивом будет гораздо менее полным.
3. Влияние одноименного иона. Растворимость труднорастворимых электролитов понижается в присутствии
других сильных электролитов, имеющих одноименные ионы.
Соли с одноименным ионом понижают растворимость солей с довольно большой растворимостью.
4. Солевой эффект. Соли, не имеющие одноименного иона, тоже влияют на растворимость электролитов, но влияни в данном случае противоположное: растворимость электролита повышается. Так, например, раство римость PbS0 4 повышается в присутствии нитратов калия или натрия, а растворимость AgCl повышается в присутствии сульфатов «атрия или калия. Описанное явление называется солевым эффектом.
5. Влияние температуры. Произведение растворимости является постоянной величиной при постоянной температуре. С увеличением температуры величина произведения растворимости возрастает, поэтому осаждение, как правило, проводят из холодных растворов. Осаждение из горячих растворов проводят лишь тогда, когда температура благоприятно влияет на характер осадка (переход из аморфного состояния в кристаллическое, предотвращение образования коллоидных растворов и т. д.).
Знание численной величины произведения растворимости позволяет сделать прогноз, будет ли выпадать осадок малорастворимого соединения в результате обменной реакции. Например, для того чтобы при сливании растворов AgNO 3 и K 3 PO 4 выпал осадок Ag 3 PO 4 в результате обменной реакции
3 Ag + + PO 4 3– ® Ag 3 PO 4 ¯
При решении подобных задач необходимо в первую очередь найти в исходных растворах число моль тех ионов, которые могут образовать осадок (в данном случае – это ионы Ag + и PO 4 3–).
В растворе Na 3 PO 4: n(Na 3 PO 4) = C(Na 3 PO 4)·V раствора (Na 3 PO 4);
n(Na 3 PO 4) = 5·10 –5 моль/л · 1 л = 5·10 –5 моль = n(PO 4 3–).
В растворе AgNO 3: n(AgNO 3) = C(AgNO 3)·V раствора AgNO 3 ;
n(AgNO 3) = 2·10 –3 моль/л · 1 л = 2·10 –3 моль = n(Ag +).
В растворе, образующемся после смешивания, число моль ионов Ag + и PO 4 3– до образования осадка будет таким же, как и в исходных растворах, а объём раствора станет равен 2 литрам:
V общий ≈ V раствора Na 3 PO 4 + V раствора AgNO 3 = 1 л + 1 л = 2 л.
C(Ag +) = n(Ag +) / V общий = 2·10 –3 моль / 2 л = 1·10 –3 моль/л;
C(PO 4 3–) = n(PO 4 3–) / V общий = 5·10 –5 моль / 2 л = 2,5·10 –5 моль/л.
Образование осадка происходит в результате реакции, протекающей по уравнению 3 Ag + + PO 4 3– ® Ag 3 PO 4 ¯, поэтому произведение концентраций (ПК) ионов Ag + и PO 4 3– в полученном растворе следует рассчитывать по уравнению:
Расчёт количеств ионов Pb 2+ и Cl – в исходных растворах:
В растворе Pb(NO 3) 2: n(Pb(NO 3) 2) = C(Pb(NO 3) 2)·V раствора (Pb(NO 3) 2);
n(Pb(NO 3) 2) = 0,005 моль/л · 0,2 л = 0,001 моль = n(Pb 2+).
В растворе NaCl: n(NaCl) = C(NaCl)·V раствора NaCl;
n(NaCl) = 0,01 моль/л · 0,3 л = 0,003 моль = n(Cl –).
В растворе, образующемся после смешивания, число моль ионов Pb 2+ и Cl – до образования осадка будет таким же, как и в исходных растворах, а объём раствора станет равен 0,5 литра:
V общий ≈ V раствора Pb(NO 3) 2 + V раствора NaCl = 0,2 л + 0,3 л = 0,5 л.
Концентрации ионов Ag + и PO 4 3– в полученном растворе будут следующими:
C(Pb 2+) = n(Pb 2+) / V общий = 0,001 моль / 0,5 л = 0,002 моль/л = 2·10 –3 моль/л;
C(Cl –) = n(Cl –) / V общий = 0,003 моль / 0,5 л = 0,006 моль/л = 6·10 –3 моль/л.
Образование осадка происходит в результате реакции, протекающей по уравнению Pb 2+ + 2 Cl – ® PbCl 2 ¯, поэтому произведение концентраций (ПК) ионов Pb 2+ и Cl – в полученном растворе следует рассчитывать по уравнению:
Значение слова «осадок»
1. Мельчайшие частицы какого-л. вещества, выделившиеся из раствора, жидкости и осевшие на дно. Осадок в растительном масле. Дать осадок. □ Вода [в ведре] была мутная, с желтым осадком — в нее нападала глина с потолка. Симонов, Живые и мертвые.
2. перен. Тяжелое, неприятное чувство, остающееся после какого-л. разговора, события и т. п. Я и сам не знаю, откуда взялся в моей душе этот едва заметный, но горький осадок разочарования? Куприн, Прапорщик армейский. Разговор этот [с Евдокией] оставил в душе Быланина неприятный осадок. Наседкин, Большая семья.
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
ОСА’ДОК, дка, м. 1. Посторонняя примесь к жидкости в виде мельчайших твердых частиц, опускающаяся на дно или на стенки сосуда. Вода дала о. || Нерастворимое вещество, выделившееся из раствора в результате химической реакции. Белый о. 2. перен. Тяжелое чувство, остающееся в памяти после каких-н. событий. В душе был страшный осадок. Л. Тлстй. 3. только мн. Атмосферная влага, падающая на землю в виде дождя, снега. Обильные осадки. 4. чаще мн. Отложения на дне ранее существовавших водоемов, образовавшие горные, т. наз. осадочные, породы (геол.).
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
оса́док I
1. хим. твёрдое вещество, выделяющееся в виде частиц из раствора в результате химической реакции, упаривания, отстаивания ◆ Он вбрызнул в колбу ацетон, быстро профильтровал получившийся чёрный раствор, отделив весь выпавший осадок, потом подошёл к шкафу, выдвинул ящичек и достал одну красную таблетку. Егор Радов, «Змеесос», 2003 г. (цитата из НКРЯ) ◆ По окончании реакции полученный раствор выливали в воду, выпавший осадок перекристаллизовывали из этилового спирта и анализировали. Наталья Лозинская, «Синтетический дизайн в реакции ароматических альдегидов с аммиаком», 2003 г. (цитата из НКРЯ)
2. неприятное переживание после какого-либо события ◆ Разумеется, от прошедшего остался осадок, до которого нельзя было касаться безнаказанно, ― что-то сломленное внутри, какой-то чутко дремлющий испуг и боль. А. И. Герцен, «Былое и думы», 1862—1866 г.
Фразеологизмы и устойчивые сочетания
Делаем Карту слов лучше вместе

Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова треножник (существительное):
Содержание:
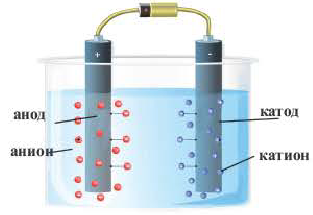
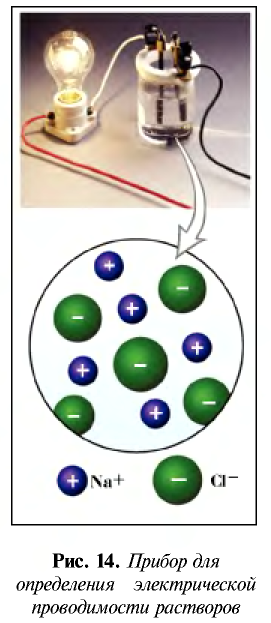
Электролитическая диссоциация:
По электрической проводимости вещества делятся на две группы.
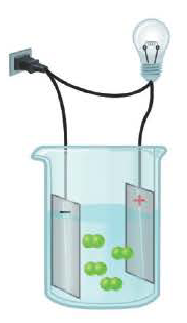
Вещества, водные растворы и расплавы которых проводят электрический ток, называются электролитами.
Вещества, водные растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. Нерастворимые в воде неорганические вещества (H2SiO3, SiO2, AgCl, CaSO4 и др.), чистая вода, большинство органических веществ неэлектролиты.
Процесс распада электролитов на ионы при растворении их в воде или расплавлении называется электролитической диссоциацией.
Основные теоретические положения электролитической диссоциации дал в 1887 году шведский ученый Сванте Аррениус. Современная теория электролитической диссоциации состоит из трех основных положений:
1) Электролиты в растворе и в расплаве распадаются (диссоциируют) на ионы, обладающие положительным или отрицательным зарядом
HNO3 

Ионы в растворе находятся в беспорядочном движении в разных направлениях.
Ионы и нейтральные атомы отличаются друг от друга как по строению, так и по свойствам. Например:
| 11Na 0 l s 2 ∕2s 2 2p 6 ∕3s 1 Электронная формула атома натрия | 11Na + ls 2 ∕2s 2 2p 6 / Электронная формула иона натрия |
| 11Na 0 l)2e 2)8e 3)1е Схема строения атома натрия | 11Na + l)2e 2)8е Схема строения иона натрия |
| Восстановитель | Окислитель |
Несмотря на все это, С.Аррениус не смог полностью раскрыть сущность процесса электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. При диссоциации электролитов в растворе образуются положительно и отрицательно заряженные частицы, состоящие из одного или нескольких атомов.
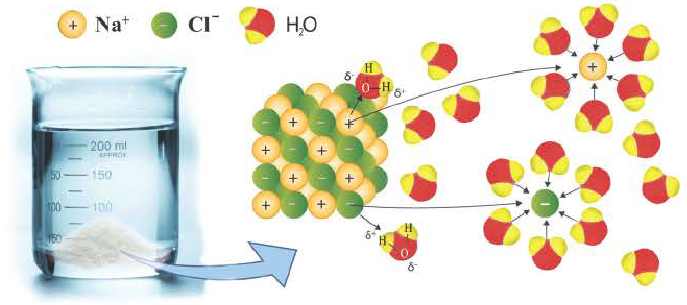
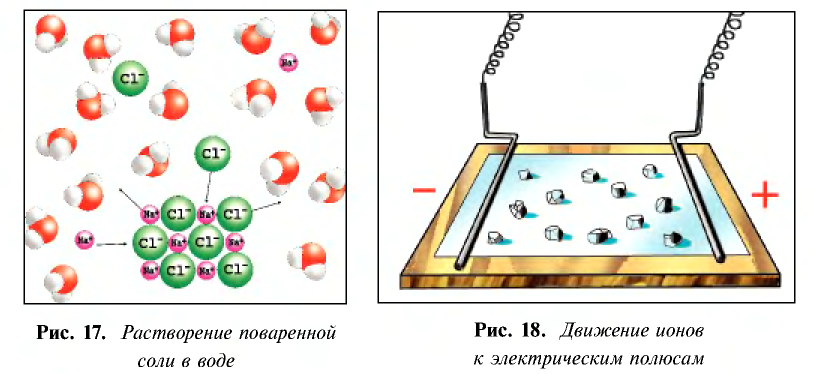
Диссоциация водного раствора хлорида натрия
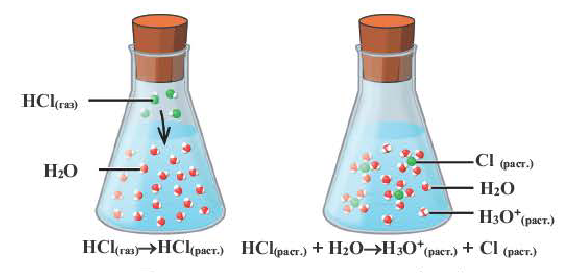
Наряду с веществами, кристаллическая решетка которых имеет ионное строение, молекулы с полярной ковалентной связью также в воде распадаются на ионы. При растворении в воде хлорида водорода (хлороводорода) с полярно-ковалентной связью под действием полярных молекул воды связь между атомами разрывается. Молекула хлорида водорода распадается на два гидратированных иона. Электронная пара переходит к атому хлора, в результате полярная ковалентная связь превращается в ионную связь.
Диссоциация молекулы хлороводорода
Процесс диссоциации характеризуется степенью диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называется степенью диссоциации и обозначается знаком а (альфа).
Здесь а показывает степень диссоциации,n число диссоциированных молекул, N— общее число растворенных молекул.
Величина а принимает значения между 0÷1, при выражении в процентах между 0÷100%.
Если α=0, значит, диссоциация не произошла.
Если α=1 или а= 100%, значит, электролит полностью диссоциировал на ионы.
Величина n может принимать разные значения от 0 до N.
По значению степени диссоциации электролиты делят на три группы.
| Сильные Электролиты | Электролиты средней силы | Слабые электролиты |
| a ≥ 30% | a=3 ÷ 30% (или 0,03 ÷ 0,3) | a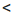 3% 3% (или a 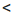 0,03) 0,03) |
| Щелочи: LiOH, NaOH, КОН, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) | NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплавлении частично диссоциируются на ионы, называются слабыми электролитами.
Факторы, влияющие на степень диссоциации
Значение степени диссоциации зависит от ряда факторов.
Природа электролита (характер связи в молекуле электролита). Слабые и средней силы электролиты диссоциируют в растворе частично, а сильные электролиты полностью.
Природа растворителя
Диэлектрическая постоянная показывает, во сколько раз сила взаимодействия между двумя электрическими зарядами, находящимися в определенной среде, меньше по отношению к вакууму. Поскольку диэлектрическая постоянная воды (проникающая способность) при 20 o C высокая, способность ионизации также сравнительно высокая. Численное значение ее диэлектрической постоянной (81) показывает, что сила взаимодействия между ионами в растворе с водной средой в 81 раз слабее по сравнению с их силой взаимодействия в кристалле. Если в растворе, приготовленном с одинаковой концентрацией, в качестве среды берется вода, то степень диссоциации бывает сравнительно больше по отношению к растворителям.
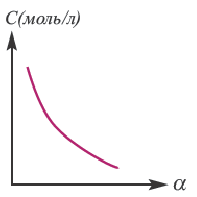
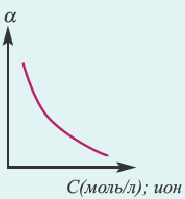
Концентрация раствора электролита. При уменьшении концентрации раствора (т.е. разбавлении раствора), вероятность встречи ионов уменьшается и равновесие смещается в сторону ионизации (степень диссоциации повышается). При уменьшении числа столкновений между ионами в разбавленных растворах в заметной степени снижается и скорость образования молекул. Это, в свою очередь, способствует смещению равновесия в сторону диссоциации и повышению степени диссоциации. Значит, степень диссоциации находится в обратной зависимости от концентрации электролита.
Влияние температуры
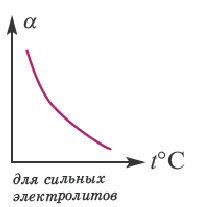
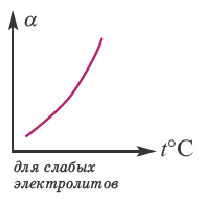
В процессе диссоциации электролитов в небольшом количестве поглощается или выделяется тепло. Обычно нагревание раствора на IoC усиливает процесс диссоциации большинства электролитов на 0,05%. При повышении температуры усиливается и электрическая проводимость электролита. Однако это связано как с понижением степени гидратации ионов и вязкости среды, так и с повышением скорости движения ионов. В этом отношении вода занимает особое место. Диссоциация воды эндотермический процесс, который протекает с затратой 57,3 кДж теплоты. Вот почему с повышением температуры повышается и степень диссоциации воды. При нагревании раствора сильных электролитов степень диссоциации понижается, а при нагревании слабых электролитов степень диссоциации повышается.
Влияние концентрации ионов. Повышением или понижением концентрации ионов, образованных в результате диссоциации, можно сместить равновесие. Например, NH4OH диссоциирует на ионы в воде по следующему
уравнению:
NH4OH
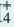
При добавлении в раствор немного NH4CI концентрация иона NH 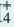
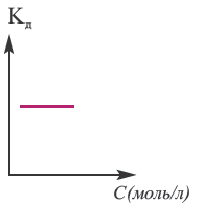
Постоянная диссоциации (Кд). Поскольку значение степени диссоциации зависит от концентрации электролита использование 
Постоянная диссоциации равна отношению произведения концентраций ионов на концентрацию молекул, не разложившихся на ионы.
Например, формула вычисления постоянной диссоциации для уксусной кислоты следующая:
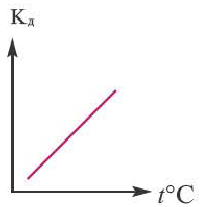
Поскольку Кд не зависит от концентрации, это постоянная величина. Значение Кд зависит от природы /электролита и растворителя и температуры. Чем больше значение Ka, тем больше диссоциирует электролит.
Электрическая проводимость бывает более высокой в том из растворов с одинаковым мольным количеством растворенных в них различных электролитов, в котором образуется наибольшее количество ионов. В ряду NaCl, FeCl2, AlCl3 в
водном растворе каждого из них электрическая проводимость повышается.
Диссоциация кислот, оснований и солей
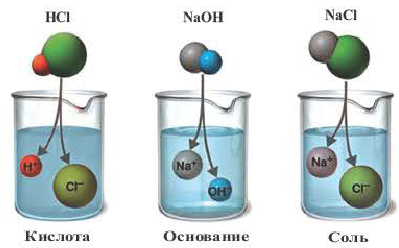
Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков. C точки зрения теории электролитической диссоциации кислотам можно дать такое определение:
Кислоты это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Диссоциация кислот
Свойства кислот (кислый вкус, воздействие на индикаторы и т.д.) связаны с наличием в растворе гидратированных ионов водорода (Н3О + ). Следовательно, общим для кислот является ион водорода H+ (или Н3О + ). Отсюда становится ясно, что цвет индикатора меняет ион H+ (или Н3О + ).
Одноосновные кислоты диссоциируют одноступенчато, двухосновные кислоты двуступенчато, а трехосновные кислоты (Н3РО4) грехступенчаго. Диссоциация двух- и трехосновных кислот в основном происходит в первой стадии (ступени). При ступенчатой диссоциации каждая последующая ступень протекает более слабо (т.е. при ступенчатой диссоциации процесс диссоциации протекает все медленнее). Основность кислот определяется количеством катионов водорода, образованных в процессе полной диссоциации.
| Диссоциация одноосновных кислот | Диссоциация двухосновных кислот | Диссоциация трехосновных кислот |
I. H2SO4  H + + H HSO H + + H HSO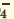 II. HSO4  H + + SO H + + SO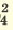 | I. H3PO4 H + +H2PO H + +H2PO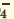 II. H2PO4  H + +HPO H + +HPO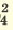 III.HPO 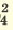  H+HPO H+HPO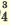 | |
I. H3PO3  H + + H2PO H + + H2PO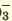 II. H2PO 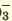  H + + HPО H + + HPО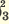 |
Знак обратимости  в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. Если скорость распада на ионы больше, чем скорость образования исходных ионов, процесс диссоциации смещается вправо, если меньше то влево. |
Диссоциация оснований
Электролиты, при диссоциации которых в качестве анионов образуются только гидроксоионы, называются основаниями.
Растворимые в воде основания называют щелочами. Как известно, кислотность оснований определяется количеством гидроксильных ионов (ОН ) в их молекуле. Количество гидроксильных групп показывает кислотность основания. Однокислотные щелочи диссоциируют одноступенчато, двукислотные щелочи двуступенчаго. Цвет индикагора также меняется под действием гидроксильного иона (ОН ).
| Диссоциация однокислотных щелочей | Диссоциация двукислотных щелочей |
NaOH  Na + + ОН Na + + ОН KOH  K + + ОН K + + ОН NH4OH  NH NH 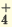 + ОН + ОН | I. Ca(OH)2 CaOH + + ОН CaOH + + ОН II. CaOH +  Ca 2+ + ОН Ca 2+ + ОН |
2OH + Zn 2+ 
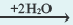
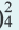
Диссоциация солей
Вещества, образующие в процессе диссоциации катион металла (или аммония) и анион кислотного остатка, называются солями.
В зависимости от вида, соли диссоциируют по-разному. Нормальные, двойные и смешанные соли диссоциируют одноступенчато.
Кислые соли диссоциируют ступенчато. Гидросоли диссоциируют двуступенчато, а дигидросоли трехступенчаго. Процесс диссоциации постепенно, поступенчато, слабеет.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. NaHSO4  Na + + HSO Na + + HSO II. HSO   H + + SO H + + SO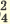 | I. KH2PO4  K + + H2PO K + + H2PO II. H2PO   H + + PO H + + PO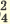 III. HPO 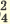  H + + PO H + + PO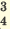 |
Основные соли также диссоциируют ступенчато: гидроксосоли диссоциируют двуступенчато, дигидроксосоли трехступенчато.
Реакции ионного обмена
Реакции обмена, протекающие между водными растворами электролитов, в прошлых разделах мы показывали молекулярными уравнениями. В действительности же, в этих реакциях участвуют не молекулы электролитов, а их диссоциированные ионы.
Взаимодействие водных растворов электролитов называют ионными реакциями, а уравнения таких реакций ионными уравнениями. Уравнение, полученное при сокращении ионов, не участвующих в реакции, называется сокращенным ионным уравнением.
Чтобы понять условия протекания реакций ионного обмена, нужно знать их важнейшие свойства.
Свойства ионов
Вам уже известно, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из них характерны специфические химические свойства.
При составлении ионных уравнений соблюдаются следующие правила:
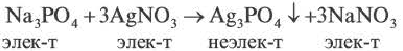
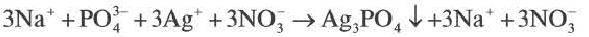
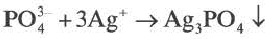
Если при реакциях заряды ионов не меняются, такие реакции называются реакциями ионного обмена.
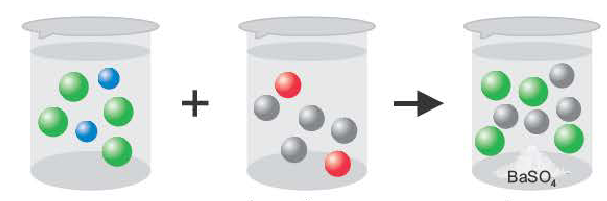
Реакции ионного обмена протекают до конца в трех случаях:
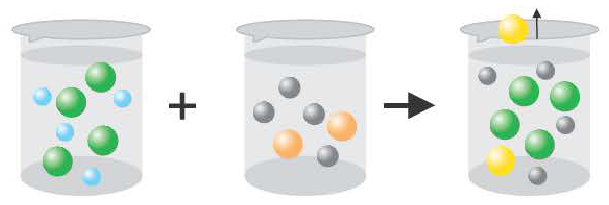
Если образуется осадок.
BaCI2 + Na2SO4 = BaSO4↓ + 2NaCI
Ba 2+ +2CI + 2Na + +SO 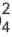
Ba 2+ +SO 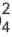
Если получается слабодиссоциирующее вещество (например: вода)
H + +CI +Na + +OH = Na + + Cl + H2O
H + +ОН =H2O
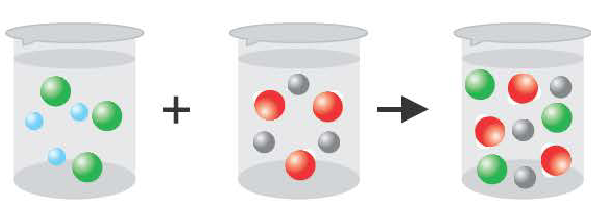
Если получается газообразное вещество.

2H + +2CI + 2Na + +S 2 = H2S↑ + 2Na + + 2CI
2H + +S 2 =H2S↑
Полное ионное уравнение и сокращенное ионное уравнение реакций, протекающих с участием или с образованием двух и более неэлектролитов, бывают одинаковыми.
Реакции ионного обмена используются для определения того или иного вещества или иона.
Обменные реакции в растворах электролитов протекают только тогда, когда хотя бы одно из образованных в результате этих реакций веществ является малодиссоциирующим, или нерастворимым (осадком), или же находится в газообразном состоянии.
Сумма коэффициентов сокращенного ионного уравнения реакций, протекающих с образованием лишь одного неэлектролита (осадка или мало диссоциирующего вещества) всегда на 1 единицу бывает больше суммы ионов, образующих этот неэлектролит.
| Слабые электролиты и неэлектролиты | Сумма коэффиниентов сокращенного ионного уравнения его образования |
| СаСО3, MgCO3, ВаСО3, CaSO4, BaSO4, PbSO4, SrSO4, ZnCO3, CuS, PbS, ZnS, CdS, AgCl, Н2О, HCOOH, CH3COOH и др. | 3 |
| Be(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2, Cr(OH)2, Cu(OH)2, PbCl2, Mn(OH)2, MgF2 и др. | 4 |
| Al(OH)3, Fe(OH)3, Cr(OH)3, Ag3PO4 и др. | 5 |
| Ca3(PO4)2, Ba3(PO4)2 и др. | 6 |



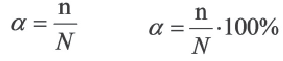
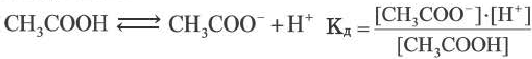
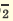

 2Na+Cl2
2Na+Cl2  2Na + Cl2
2Na + Cl2

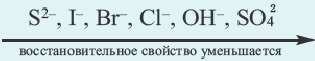
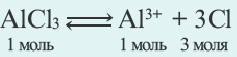
 N(OH ) среда кислая; при N (H + )
N(OH ) среда кислая; при N (H + )  Cl, Br, I, Me
Cl, Br, I, Me  + H2O
+ H2O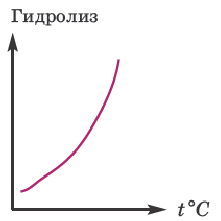
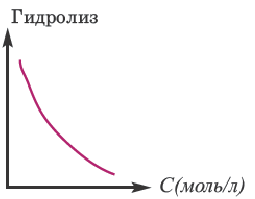
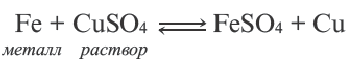
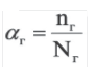 или
или 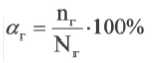
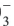 ∙(n-1)H2O
∙(n-1)H2O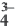
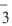

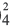

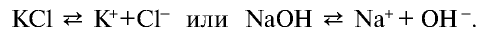
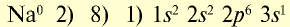
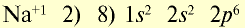
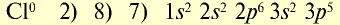
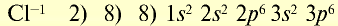
 ).
).
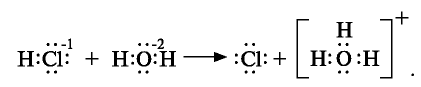
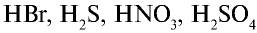 и других кислот образуется ион
и других кислот образуется ион 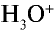 (гидроксоний). Ион гидроксония образует ионы воды и водорода:
(гидроксоний). Ион гидроксония образует ионы воды и водорода: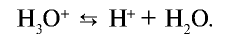
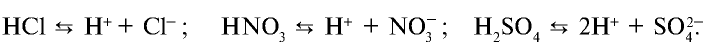


 ) и анионы гидроксида (
) и анионы гидроксида (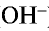 ):
):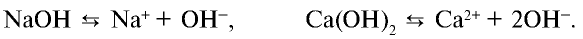
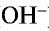 , образующихся при их диссоциации.
, образующихся при их диссоциации.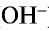 ).
).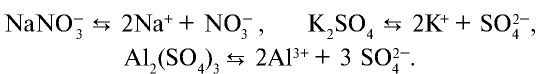
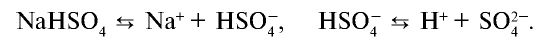
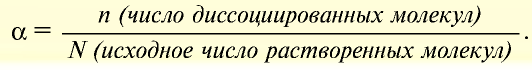
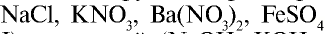 ), кислот (
), кислот (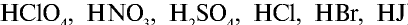 ) и щелочей (
) и щелочей (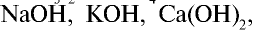
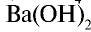 ) считаются сильными электролитами.
) считаются сильными электролитами.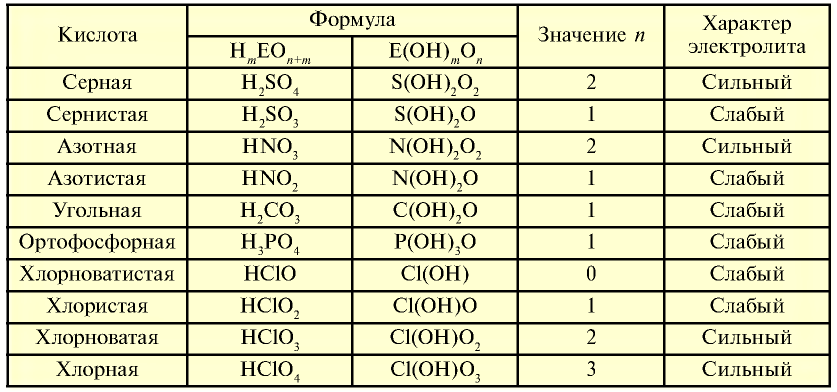
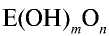 можно определить их характер. При n
можно определить их характер. При n