Что такое осмотическое давление в химии
Осмотическое давление
Из Википедии — свободной энциклопедии
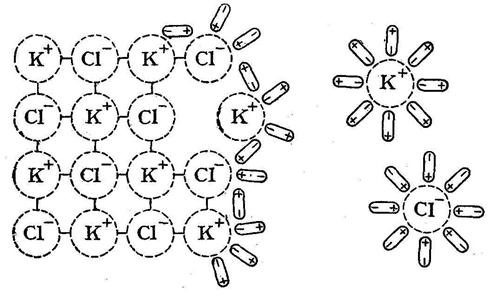
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для внутривенного введения, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3—10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом.
Осмотическое давление
Полезное
Смотреть что такое «Осмотическое давление» в других словарях:
Осмотическое давление — (обозначается π) избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации… … Википедия
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ — ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ, давление, производимое молекулами растворенного вещества на полупроницаемые стенки сосуда^ Теория О. д. Если чистая вода и какой либо раствор разделены перегородкой, задерживающей растворённые молекулы, ю> пропускающей… … Большая медицинская энциклопедия
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ — (обозначение П), давление, оказываемое растворенным веществом посредством движения его молекул. В разбавленном растворе давление изменяется в зависимости от концентрации и температуры, как если бы раствор был газом, занимающим тот же объем. Оно… … Научно-технический энциклопедический словарь
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ — (диффузное давление), термодинамич. параметр, характеризующий стремление р ра к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворителя и растворённого в ва. Если р р отделён от… … Физическая энциклопедия
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ — избыточное внеш. давление, крое необходимо приложить к раствору, чтобы противодействовать поступлению в него растворителя через разделяющую их полупроницаемую мембрану. По величине О. д. различают: изотонические, или изоосмотические, растворы,… … Биологический энциклопедический словарь
осмотическое давление — избыточное давление, которое надо приложить к концентрированному раствору, чтобы в него не поступал растворитель из менее концентрированного раствора. Растворы должны быть разделены мембраной, непроницаемой для растворенного вещества. (Источник:… … Словарь микробиологии
осмотическое давление — Давление, оказываемое раствором на полупроницаемую мембрану [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN osmotic pressure … Справочник технического переводчика
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ — избыточное гидростатическое давление со стороны раствора, препятствующее проникновению растворителя из менее концентрированного в более концентрированный раствор через разделяющую эти два раствора тонкую пористую перегородку (мембрану), не… … Большая политехническая энциклопедия
осмотическое давление — – параметр системы, численно равный силе, приходящейся на единицу поверхности полупроницаемой мембраны, которую нужно приложить, чтобы предотвратить проникновение молекул растворителя в раствор. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Осмотическое давление



Если раствор и растворитель разделены полупроницаемой (т.е. проницаемой только для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения равновесного его значения – осмотического давления.
Осмотическое давление не зависит от природы растворителя и растворенного вещества, оно пропорционально молярной концентрации раствора СМ и абсолютной температуре Т:
Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем равный объему расвтора.
При определении молярной массы растворенного вещества по величине осмотического давления используют соотношение:
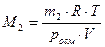
где m2 масса растворенного вещества, г; V – объем раствора, л.
1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 202-227.
2. Шиманович И.Е., Павлович М.Л., Тикавый В.Ф., Малашко П.М. Общая химия в формулах определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 115-121.
3. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 46-52.
Тема 7. Водные растворы электролитов
1. Электролитическая диссоциация и причины ее возникновения.
2. Сильные и слабые электролиты.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью*, распадаются на ионы – положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим примерным уравнением
К электролитам относятся вещества, в молекулах которых атомы связаны сильно полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
твердое жидкий раствор
Электролитическая диссоциация полярных молекул (КА) в растворе происходит вследствие ослабления связи, вызванного действием полярных молекул растворителя:
Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона 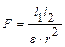
Если в растворе дополнительно могут возникнуть еще и водородные связи между молекулами растворителя и атомом водорода растворенного вещества, то процесс диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется соединение, диссоциирующее в водном растворе с образованием гидратированных водородных ионов (гидроксоний-ионов) и кислотного остатка:
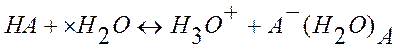
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов и т.д.) принадлежат иону гидроксония.
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
при х = у – средние (нормальные) соли
при х 2MgOH + + SO4 2-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
1. диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
2. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
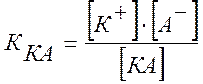
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
где С – исходная молярная концентрация; a – степень электролитической диссоциации электролита. Концентрация недиссоциировавших молекул КА в растворе равна
Откуда 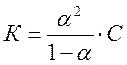
Данное уравнение выражает закон разбавления Оствальда.
Если a мала, то 1- a ≈ 1 и тогда
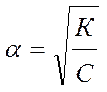
Видно, что с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты Н2СО3 в водном растворе имеют место следующие равновесия:
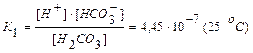
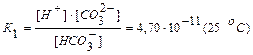
Как видно из этих данных, процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых кислот и оснований (25 °С):
Осмотическое давление – определение, уравнение и примеры
Определение осмотического давления
Осмотическое давление можно рассматривать как давление, необходимое для предотвращения распространения воды через барьер осмос, Другими словами, это относится к тому, как сильно вода «проталкивается», чтобы пройти через барьер, чтобы распространиться на другую сторону.
Осмотическое давление определяется растворенное вещество концентрация – вода будет «стараться» диффундировать в область с высокой концентрацией растворенного вещества, такого как соль, чем в область с низкой концентрацией.
В действительности, конечно, осмотическое давление – это не «желание» воды двигаться, а скорее продолжение естественного закона, согласно которому вся материя со временем будет случайным образом распределяться. Когда концентрации веществ различны в двух областях, и области имеют контакт друг с другом, случайное движение частиц заставит вещества диффундировать до решение равномерно по всей области.
Осмос является особенным диффузия воды через полупроницаемую мембрану. Таким образом, в случае осмоса растворенные вещества не могут двигаться, потому что они не могут проходить через мембрану. Однако вода может двигаться, и это происходит – проходя через мембрану в область с более высокой концентрацией растворенного вещества.
Это очень важный фактор в биологии, потому что внутриклеточная среда отличается от внеклеточной среды. Если изменяется внеклеточная среда, это может привести к попаданию воды в наши клетки.
Некоторые организмы, такие как растения, которые используют осмотическое давление для перемещения воды, воспользовались этим принципом. Но это также может угрожать здоровью клеток и организмов, когда во внеклеточной среде слишком много или слишком мало воды по сравнению с внутренней частью клетки.
Уравнение осмотического давления
Осмотическое давление может быть рассчитано с использованием следующего уравнения:
Важно отметить, что π не равно 3.14… в этом уравнении!
Вместо этого здесь «π» – символ, используемый для обозначения осмотического давления. Вы можете думать об этом уравнении как о решении для «π» так же, как о решении для X.
В символе «π» нет ничего особенного, кроме того, что на международном уровне химики согласились обозначать осмотическое давление.
М – молярная концентрация растворенного вещества. Молярная концентрация относится к фактическому количеству атомов, ионов или молекул растворенного вещества.
Это важно, потому что именно количество частиц определяет, как частицы взаимодействуют при осмосе, а не объем или вес.
Сколько моль – единица измерения частиц – весит, или сколько он занимает, будет варьироваться в зависимости от молекулярного веса и плотности растворенного вещества.
R – идеальная газовая постоянная.
Хотя постоянная идеального газа была создана для обозначения газов и их диффузии и поведения, она также применима к жидкостям.
В химии и жидкости, и газы считаются «жидкостями» – частицами, которые могут свободно диффундировать, в отличие от твердых тел, частицы которых удерживаются на месте прочными связями.
Т – температура в градусах Кельвина.
Один градус Кельвина равен одному градусу Цельсия, но между двумя измерительными системами есть важное различие.
Температура является мерой энергии в молекулах. При более высоких температурах молекулы движутся быстрее; при более низких температурах они движутся медленнее. Вот почему температура так важна для этого уравнения: чем быстрее частицы подвергаются случайному молекулярному движению, тем быстрее они будут диффундировать.
В градусах Цельсия «ноль градусов» считается точкой замерзания воды. Это произвольное число, выбранное учеными, потому что замерзание воды является обычным явлением. Температура по Цельсию может быть положительной (выше нуля) или отрицательной (ниже нуля).
Но в Кельвине «ноль градусов» – это температура, при которой не происходит молекулярного движения. На самом деле это абсолютный ноль – невозможно стать холоднее, чем «отсутствие молекулярного движения».
В результате Кельвин используется во многих химических уравнениях, потому что это абсолютная мера тепла. Если вещество находится при 300 градусах Кельвина, вы точно знаете, сколько тепла находится в веществе: всего 300 Кельвинов.
Примеры осмотического давления
Увядшие растения
Многие растения фактически используют осмотическое давление для поддержания формы своих стеблей и листьев.
Если вы сохранили растения в горшках, вы, вероятно, знаете, что ваши растения могут очень быстро увядать, если их не поливать. Но в течение нескольких минут после полива они могут взбодриться!
Это происходит потому, что стебли и листья многих растений по существу «надуваются» осмотическим давлением – соли в клетках заставляют воду всасываться через осмос, делая клетку упругой и упругой.
Если воды недостаточно, растение будет увядать, потому что его клетки становятся «спущенными». В научном плане они «гипертонический »- что означает« концентрация растворенного вещества слишком высока ».
Растения также могут демонстрировать силу осмотического давления по мере роста.
Возможно, вы видели растения, растущие сквозь асфальт, или корни деревьев, растущие сквозь кирпичи или бетон.
Это также стало возможным благодаря осмотическому давлению: по мере роста растений их клетки поглощают больше воды. Медленное, но неумолимое давление воды, движущейся через растительная клетка Мембраны действительно могут протолкнуть асфальт!
Эффекты обезвоживания – и чрезмерного увлажнения
Мы все знаем об опасности обезвоживания, когда недостаток воды может вызвать опасные последствия для нашего организма. Чего мы не могли бы понять, так это того, что эти эффекты напрямую связаны с осмотическим давлением.
Когда наши тела не имеют достаточного количества воды, вода может фактически выйти из наших клеток в наши кровь, Это может привести к тому, что концентрации солей и других растворенных веществ в наших клетках станут слишком высокими, что повлияет на клеточную функцию.
Когда мы пьем воду, вода попадает в организм через наши кровяные потоки и способна диффундировать обратно в наши клетки через осмос, восстанавливая их правильную функцию.
Возможно и обратное: на самом деле можно умереть, выпив слишком много воды.
Трудно случайно «передозировать» воду, но в экстремальных случаях, таких как соревнования по питью воды, можно выпить столько воды, что слишком много ее диффундирует в ваши клетки. В крайних случаях это может вызвать отек головной мозг.
Быстрая регидратация после тяжелой дегидратации может быть опасной по той же причине. Рекомендуется проводить регидратацию медленно, потому что внезапное заполнение обезвоженных клеток большим количеством воды может привести к их взрыву!
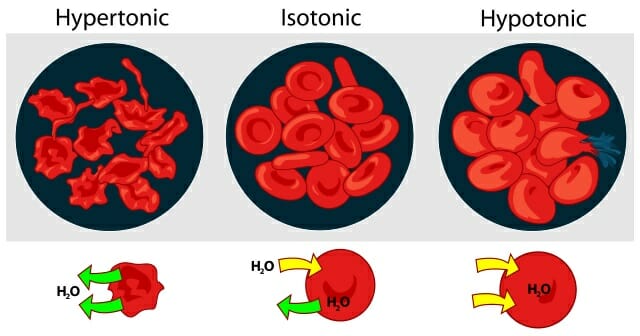
На рисунке ниже показано, как обезвоживание – или чрезмерное увлажнение – может влиять на наши клетки крови, вызывая их усыхание или взрыв:
викторина
1. Что из следующего НЕ верно для осмоса?A. Это относится конкретно к движению воды через полупроницаемую мембрану.B. Это может произойти только там, где есть мембрана, которая проницаема для воды.C. Это может относиться к любому диффузионному процессу с участием воды.D. Ни один из вышеперечисленных.
Ответ на вопрос № 1
С верно. Осмос относится только к диффузии воды через полупроницаемую мембрану. Другие типы диффузии, такие как диффузия без мембраны, не являются осмосом.
2. Что из следующего НЕ является переменной в уравнении для осмотического давления?A. π – значение 3.14…B. М – молярная концентрация растворенного вещества.C. Р – Закон идеального газа.D. Т – температура раствора в градусах Кельвина.
Ответ на вопрос № 2
верно. Это хитрый! Хотя символ «π» появляется в уравнении для осмотического давления, здесь он НЕ означает значение «3.14…», используемое в геометрии.
Вместо этого он просто используется как символ, представляющий решение вашего уравнения – осмотическое давление вашего решения. Здесь значение «π» является тем, каким оказывается осмотическое давление.
13 лучших примеров осмоса в повседневной жизни
Что такое осмос?
Но что такое полупроницаемая мембрана? Что ж, это своего рода барьер, через который проходят одни молекулы или вещества, но не другие. Например, пластиковая пленка позволяет водяному пару и воздуху проходить через нее, но не пище или воде. Точно так же мембраны клеток пропускают воду и определенные растворенные вещества (крошечные молекулы, растворенные в растворителе), блокируя при этом другие растворенные вещества.
Этот процесс был впервые задокументирован французским физиком Жаном-Антуаном Нолле в 1748 году. Более века спустя немецкий химик изобрел высокоселективные осаждающие мембраны, продвигая искусство и технику измерения осмотического потока.
Как это работает?
Осмос всегда пытается уравнять концентрацию по обе стороны мембраны. Поскольку растворенное вещество не может проходить через мембрану, перемещаться должен только растворитель (вода). По мере приближения к равновесию раствор становится более стабильным. Таким образом, осмос поддерживает законы термодинамики.
Виды осмоса
Обычно бывает два типа осмоса:
Чтобы лучше объяснить это явление, мы перечислили несколько очень хороших примеров осмоса, с которыми мы сталкиваемся в повседневной жизни.
13. Изюм в воде
Тип: Эндосмос
Поскольку растворитель (чистая вода) входит в клетку изюма, это является примером эндосмоса.
12. Картофель в сахарном растворе
Тип: Экзосмос
Если положить картофель в сахарный раствор, он со временем сожмется. Это связано с тем, что в клетках картофеля концентрация воды намного выше, чем в растворе сахара, поэтому вода выходит из картофеля через его мембрану в раствор сахара.
Поскольку растворитель выходит из клеток картофеля и попадает в раствор сахара, пытаясь достичь равновесия, это пример экзосмоса.
11. Растения поглощают воду из почвы
Тип: Эндосмос
В то время как растения поглощают воду по всей своей поверхности (листья, стебли и корни), большая часть воды поглощается корневыми волосками. Эти корневые волоски действуют как полупроницаемый барьер, позволяя молекулам воды (растворителю) перемещаться от высокой концентрации (почва) к низкой концентрации (корни).
В результате корневые волосковые клетки становятся более набухшими, а их осмотическое давление (способность впитывать растворители) падает.
Затем молекулы воды перемещаются в трубки, называемые сосудами ксилемы, и транспортируются к листьям. Внутри клеток ксилемы молекулы воды оказывают сильное влияние друг на друга за счет водородных связей. Когда вода испаряется через устьица (крошечные поры на листьях), через клетки ксилемы корня выводится больше воды, чтобы заменить то, что было потеряно.
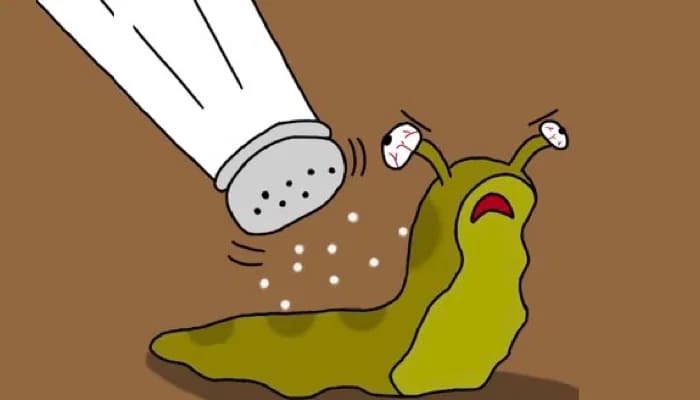
10. Соль на слизнях
Тип: Экзосмос
Соль и слизни плохо сочетаются. Вы когда-нибудь задумывались, почему соль убивает слизней и улиток? Влажная кожа слизняка действует как полупроницаемая мембрана. Высокая концентрация соли на коже слизняка вытягивает воду из его клеток посредством осмоса.
Вода выходит наружу, потому что это уравновешивает концентрацию соли между внешней и внутренней стороной кожи слизняка. Как и большинству других живых организмов, слизням для обслуживания нужна вода. А когда они теряют слишком много воды, они сморщиваются и умирают.
9. Красные кровяные тельца, помещенные в пресную воду
Тип: Эндосмос
При помещении в пресную воду вода попадает в клетки посредством осмоса, вызывая набухание клеток. Это происходит потому, что концентрация ионов и других растворенных частиц внутри эритроцита выше, чем вне его.
Количество воды, которая может попасть в клетки, контролируется давлением клеточной мембраны, действующим на содержимое клетки. В большинстве случаев клетка потребляет больше воды, чем может выдержать ее мембрана, что приводит к взрыву клетки. Это явление называется гемолизом.
Однако, когда красные кровяные тельца помещаются в раствор с более высокой концентрацией растворенного вещества, вода выходит из клетки. В результате клетки становятся меньше и имеют зубчатую форму.
8. Рыбы впитывают воду через кожу и жабры
Тип: эндосмос или экзосмос в зависимости от вида рыб.
Если поместить морскую или пресноводную рыбу в воду с разной концентрацией соли, она погибнет из-за попадания или выхода воды в ее клетки.
Кровь и физиологические жидкости пресноводных рыб намного соленее, чем вода, в которой они плавают. Таким образом, вода проходит через их жабры. Точно так же рыба, обитающая в океане, имеет тенденцию терять воду через жабры.
Как и человеческое тело, рыбьему телу для наилучшего функционирования необходима определенная концентрация соли. Они не могут противостоять слишком большому количеству воды, втекающей или вытекающей через жабры. Пресноводная рыба лопнет, а морская засохнет.
Однако этого не происходит, потому что их жабры содержат специализированные клетки, которые выборочно перекачивают соль в кровь или из нее. Клетки пресноводных рыб регулярно переносят соль, а клетки морских рыб регулярно ее выкачивают. А поскольку океанская вода очень соленая, рыба откачивает излишки соли через жабры и почки.
7. Полоскание горла с соленой водой избавляет от боли в горле
Тип: экзосмос (избыток жидкости выбрасывается из тканей горла).
Соленая вода на самом деле не лечит боль в горле, но помогает уменьшить боль и дискомфорт. Это потому, что соленая вода содержит более высокую концентрацию растворенного вещества (соли), чем то, что присутствует в тканях нашего горла.
Более конкретно, осмотическое давление соленой воды больше, чем давление в жидкости окружающих клеток. Поэтому, когда мы полощем горло, избыток жидкости выходит из тканей горла, уменьшая отек и облегчая боль.
6. Сахар на клубнике
Тип: Экзосмос
Наружная мембрана клубники действует как полупроницаемый слой между ее внутренней и внешней частью. Внутренняя часть уже содержит воду и натуральный сахар. При посыпании сахара на срезанную клубнику, большее количество сахара за пределами клеток плода (в сочетании со способностью сахара притягивать воду) вызывает движение воды наружу к поверхности клубники.
Этот процесс можно использовать для приготовления вкусных продуктов, таких как мацерированная клубника, желе и джемы. Его также можно использовать для продления срока хранения фруктов.
5. Консервирование продуктов питания
Тип: Экзосмос (клетки бактерий теряют воду)
Они действуют не только как усилители вкуса, но и как отличные консерванты, убивая бактерии и предотвращая рост других вредных микроорганизмов.
Высокая концентрация сахара и соли гипертонически воздействует на клетки бактерий. Клетки бактерий теряют воду из-за более высоких концентраций снаружи и становятся менее проводящими для поддержания роста микроорганизмов.
4. Переваренная пища всасывается в тонком и толстом кишечнике
Тип: Эндосмос
Когда вы пьете воду или едите пищу, она движется изо рта по пищеводу в желудок. Внутри желудка пища распадается на множество мелких частей, которые смешиваются с желудочными жидкостями. Смесь образует густую полужидкую массу, называемую химусом. Когда химус попадает в тонкий кишечник, происходит осмос.
Клетки кишечного эпителия (которые образуют слизистую оболочку кишечника) имеют более низкую концентрацию, чем химус. Таким образом, чтобы достичь равновесия, растворитель (вода) проникает в эти клетки через полупроницаемые мембраны, забирая с собой некоторые питательные вещества.
Рядом с эпителиальными клетками находятся капилляры. И питательные вещества, и вода проходят через клетки капилляров в кровоток.
3. Патогенные бактерии мешают кишечным клеткам
Бактерии холеры, полученные с помощью сканирующего электронного микроскопа
Тип: Экзосмос
Некоторые патогенные бактерии, такие как Vibrio cholerae, способны вмешиваться в каналы транспорта ионов кишечных клеток человека. Они производят энтеротоксины, которые изменяют проницаемость эпителиальных клеток кишечной стенки за счет образования пор.
В результате осмоса вода и другие жидкие соединения выводятся из организма, что приводит к сильному обезвоживанию и диарее. Эти бактерии могут крепко держаться за клетки кишечника, в то время как обычные бактерии, живущие в нашем желудке, вымываются. Таким образом, бактерии холеры получают достаточно области для роста и размножения. Умный крошечный микроб, не так ли?
2. Вызванная контактными линзами сухость глаз
Тип: Экзосмос
Знаете ли вы, почему мы помещаем контактные линзы в физиологический раствор? Почему не чистая вода? Это связано с тем, что физиологический раствор для контактных линз содержит такую же концентрацию соленой воды, как и ваш глаз.
Когда вы держите линзы внутри раствора, они остаются влажными, мягкими и удобными. В противном случае они имеют тенденцию впитывать влагу из глаз посредством осмоса, поскольку теряют воду во время носки.
1. Очистка воды
Этот процесс широко используется для удаления из воды распространенных загрязняющих веществ, в том числе пестицидов свинца, нитратов, фтора, сульфатов, мышьяка, бактерий и многого другого.