Что такое основание с точки зрения тэд
Свойства оснований в свете ТЭД
Урок 40. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Свойства оснований в свете ТЭД»
Прежде, чем изучать свойства оснований, давайте с вами вспомним классификацию оснований по нескольким признакам.
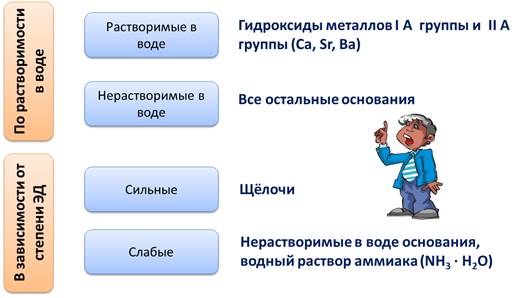
По растворимости в воде основания делятся на растворимые в воде, или щёлочи, к ним относятся гидроксиды металлов I A группы главной подгруппы и гидроксиды металлов II A группы главной подгруппы, таких как Ca, Sr, Ba. Все остальные основания являются нерастворимыми в воде.
В зависимости от степени электролитической диссоциации различают сильные основания, к ним относятся щёлочи, степень диссоциации этих оснований стремиться к единице. К слабым основаниям относятся основания, степень диссоциации которых стремиться к нулю, к таким основаниям относятся нерастворимые в воде основания, водный раствор аммиака (NH3 · H2O).
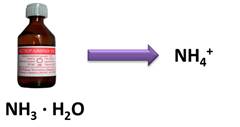
Все основания по агрегатному состоянию являются твёрдыми веществами, имеющими различную окраску. Исключение составляет только раствор аммиака в воде, представляющий собой всем известный нашатырный спирт. Это основание, в отличие от других, содержит не катион металла, а катион аммония (NH4 + ) и существует только в растворе. Он легко разлагается на аммиак и воду.
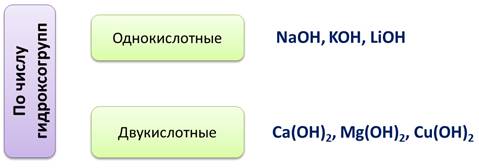
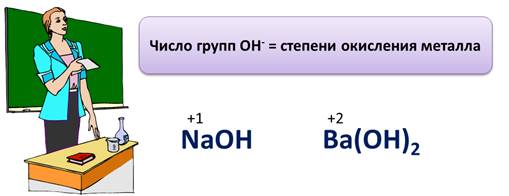
Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число групп ОН равно степени окисления металла. Если степень окисления металла +1, значит, в составе основания будет 1 группа ОН, например NaOH, 1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH)2, в составе данного основания 2 группы ОН, т.к. у металла бария степень окисления +2.
Наличие группы ОН обуславливает ряд общих свойств оснований: мыльность на ощупь, изменение окраски индикаторов и др.
Основания, в частности щёлочи, изменяют окраску индикаторов, т.к. при диссоциации образуют гидроксид-ионы. В присутствии щелочей лакмус изменяет свою окраску на синюю, метиловый оранжевый – на желтую, фенолфталеин – на малиновую.
Основания вступают в реакцию с кислотами. Эти реакции относятся к реакциям обмена. В результате чего образуется соль и вода. Вспомните, если мы в стакан с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
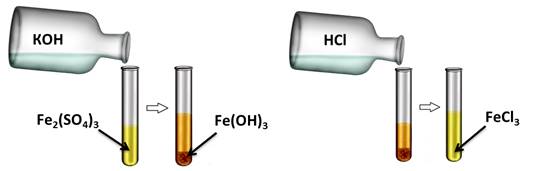
Аналогично, и нерастворимые основания реагируют с кислотами. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
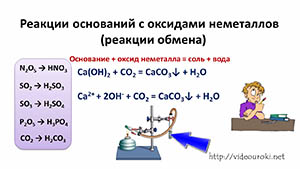
Поэтому в реакциях щелочей с оксидами неметаллов образуются соли соответствующих кислот и вода. Вспомните качественную реакцию на углекислый газ: известковая вода реагирует с углекислым газом, в результате чего происходит помутнение известковой воды, вследствие образования карбоната кальция.
Эта реакция относится к реакциям обмена.
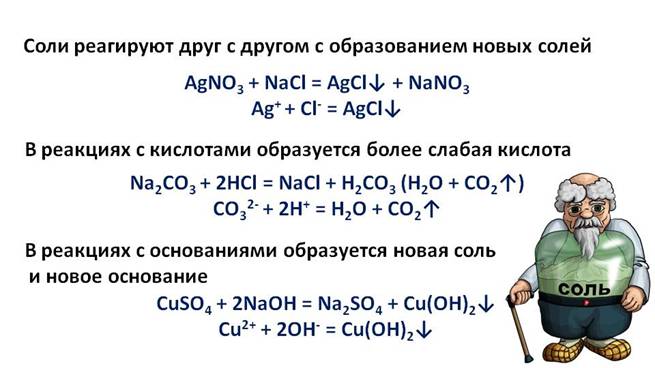
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
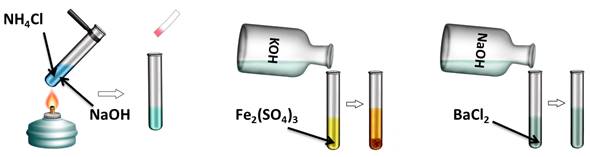
Проведём эксперимент, для этого нальём в первую пробирку гидроксида натрия и хлорида аммония, во вторую – гидроксида калия и сульфата железа (III), а в третью – гидроксида натрия и хлорида бария. Содержимое первой пробирки нагреем. В результате появляется резкий запах аммиака. Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло. Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия: образуется осадок или слабый электролит.
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Например, гидроксид железа (II) разлагается на оксид железа (II) и воду.
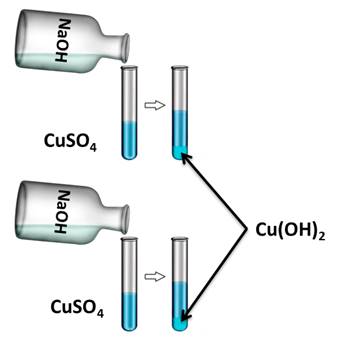
Для подтверждения этого свойства получим нерастворимое основание гидроксида меди (II), а затем нагреем его. Для этого, в две пробирки нальём раствора сульфата меди (II), затем сюда же добавим несколько капель гидроксида натрия. У нас образуется осадок голубого цвета. Это гидроксид меди (II).
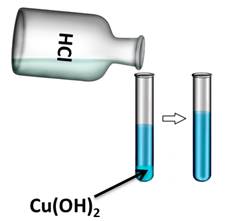
Если в одну из пробирок с осадком гидроксида меди (II) добавить раствора соляной кислоты, то осадок растворяется. В результате образуется соль и вода. В этом можно убедиться, если несколько капель раствора капнуть на предметное стекло и выпарить, то на стекле появляются кристаллы соли.
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II). Образуется оксид меди (II), т.к. нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Techemy
ЗНАНИЯ КОТОРЫЕ ПРИНЕСУТ ДЕНЬГИ
Bitcoin кошелек за 5 минут
Переходи по ссылке!
Спрашивай, узнавай, общайся.
Кобальтовое стекло
Топливный элемент
Радиус протона меньше чем считали ранее
Твердотельные и электрохимические солнечные батареи
Коды биологической регуляции
Твердое, жидкое, газообразное
Тайны химических превращений
Необыкновенное поведение обыкновенного железа
Новый вид ракетного топлива — алюминий водное ракетное топливо позволит путешествовать в космосе.
На пути к высокотемпературной сверхпроводимости.
Основания, кислоты, соли с точки зрения ТЭД
Основания с точки зрения теории электролитической диссоциации
Название “ основания ” первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
NaOH — гидроксид натрия
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
С точки зрения теории электролитической диссоциации (есть и другие точки зрения на то, что такое основания, кислоты, соли)
Основания — это вещества, диссоциирующие в водном растворе с образованием анионов одного вида — гидроксид-ионов OH —
Основание ⇄ катион основания + OH —
Гидроксиды металлов типа NaOH и Ba(OH)2, представляющие собой ионные кристаллы, являются сильными электролитами, а гидрат аммиака (ковалентное соединение) — это слабое основание.
Некоторые из щелочей при плавлении распадаются на ионы подобно диссоциации в водном растворе:
Большинство же основных гидроксидов разлагаются при нагревании на оксиды и воду еще до плавления:
Основания — гидроксиды металлов — могут быть получены при взаимодействии неблагородных металлов с водой или основных оксидов с водой.
Оксиды металлов, которые подобным путем образуют основания, раньше называли основные ангидриды.
Кислоты с точки зрения теории электролитической диссоциации
Кислоты исторически получили такое название из-за кислого вкуса водных растворов таких веществ, как уксусная кислота, муравьиная кислота, щавелевая кислота.
С точки зрения теории электролитической диссоциации
Кислоты — это вещества, диссоциирующие в водном растворе с образованием катионов одного вида — катионов водорода H +
Кислота ⇄ Катион водорода + Анион кислотного остатка
Таким образом, характеристической составной частью всех кислот является водород, способный диссоциировать в водном растворе.
Первое определение кислот как класса неорганических соединений было дано немецким химиком Либихом в 1839 г.; это определение справедливо и сегодня:
Кислота — это водородсодержащее соединение, водород которого может быть замещен на металл с образованием соли
Кислоты делят на кислородсодержащие кислоты (H2SO4, HNO3) и беcкислородные кислоты (HCl, H2S).
Примеры потенциальных электролитов — кислот.
Хлороводород HCl — газ при комнатной температуре. При растворении в воде и электролитической диссоциации образует кислый раствор, называемый хлороводородной кислотой (при массовой доле 36% эту кислоту называют соляная кислота).
Серная кислота H2SO4 в безводном (100%) состоянии при комнатной температуре — вязкая жидкость, которая практически не содержит ионов и поэтому не проводит электрический ток. При растворении кислоты в большом количестве воды протекает полная электролитическая диссоциация.
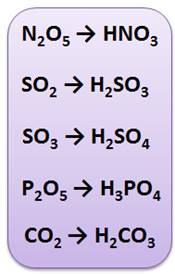
Кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов с водой.
Ранее такие оксиды неметаллов называли кислотными ангидридами. Многим неметаллам, ввиду многообразия их степеней окисления, отвечает несколько кислородсодержащих кислот.
Например для хлора известны:
HClO4 — хлорная кислота
HClO3 — хлорноватая кислота
HClO2 — хлористая кислота
HClO — хлорноватистая кислота
Металлы, которые проявляют несколько степеней окисления, также могут образовывать кислотные оксиды и кислоты.
Марганец в степени окисления (+II) образует основной оксид MnO и основание Mn(OH)2, а в степени окисления (+VII) — кислотный оксид Mn2O7, который при взаимодействии с водой дает марганцевую кислоту:
Как правило, всем металлам атомы которых находятся в степени окисления от (+V) до (+VII) отвечают кислотные оксиды и кислоты.
Типичные свойства кислот по Аррениусу связаны с тем, что они поставляют в водный раствор катионы водорода H + (H3O + ). На этом основано обнаружение кислот с помощью индикаторов. Так, самый распространенный в лаборатории индикатор — лакмус окрашивается растворами кислот в красный цвет.
Соли с точки зрения теории электролитической диссоциации
Соли — это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка
Соль ⇄ Катион основания + Анион кислотного остатка
Все соли — истинные электролиты; реакции их диссоциации проходят полностью и не являются ступенчатыми, в отличие от оснований и кислот.
Важнейший способ получения солей — взаимодействие оснований с кислотами ( реакция нейтрализации ).
Основание + Кислота = Соль + Вода
Типичные способы получения солей
Свойства кислот оснований и солей с точки зрения ТЭД (теории электролитической диссоциации). Амфотерность.
Основания. Название «основание» первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
В общем виде уравнение электролитической диссоциации основания имеет вид:
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
H2SO4 
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
K2CO3 
Амфотерность — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Амфотерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H + ), так и по механизму оснований (отщепление гидроксид-ионов, OH – ). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Если обозначить амфотерный электролит формулой XOH, то его диссоциацию можно описать схемой:
H + + XO − ⇄ XOH ⇄ X + + OH −
Например, кислотно-основные свойства азотистой кислоты определяются равновесными процессами диссоциации с образованием нитрит-аниона и нитрозильного катиона:
HNO2 ⇄ NO + + OH − Kb ≈ 10 − 7
Идеальным амфолитом будет вода:
Также к числу идеальных амфолитов относят гидроксид галлия Ga(OH)3, вторые и третьи константы диссоциации которого по кислотному и основному типам практически одинаковы.
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донором и акцептором протона. Например, для воды амфотерность проявляется как автопротоли:
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3 + являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).
3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома (III) известны реакции:
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионные).
Окислительно-восстановительные реакции. Понятие «степень окисления». Типы окислительно-восстановительных реакций (привести примеры).
Окислительно-восстановительные реакции, также редокс— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления и не более 2-х атомов, входящих в состав реагирующих веществ (или ионов веществ), реализующимся путём перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором).
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.[2]
Окисление — процесс отдачи электронов с увеличением степени окисления.
При окислении вещества в результате отдачи электронов увеличивается его степени окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель +e− ↔ сопряжённый восстановитель.
Восстановление — процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
Несвязанный, свободный электрон является сильнейшим восстановителем.
Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями.
В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, то есть восстановлением, другая — с отдачей электронов, то есть окислением.
Степень окисления (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле.
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Что такое основание с точки зрения тэд
Как объяснить тот факт, что кислоты, соли и основания вступают в реакции не со всеми веществами, а со строго определенными? Чем определяются свойства кислот, оснований и солей?
На эти вопросы вы найдете ответы на данном уроке.
I. Химические свойства щелочей
1. Взаимодействие щелочей с кислотами: Me(OH)x + HxR
2. Взаимодействие щелочей с кислотными оксидами: Me(OH)x + неMexOy
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но для этого нужно, чтобы образовался осадок или слабый электролит. Если в одну пробирку с гидроксида натрия добавить хлорида аммония (NH4Cl), во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III) (Fe2(SO4)3), а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2) и содержимое первой пробирки нагреем, то в результате появляется резкий запах аммиака (NH3). Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло.
II. Химические свойства солей
1. Взаимодействие солей с металлами: MexOy + Me*
Но нужно быть внимательным и обязательно пользоваться рядом активности металлов. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду.
При этом должны соблюдаться условия:
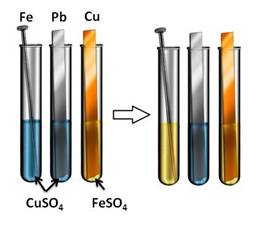
Посмотрим, как это происходит: в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II) (CuSO4), а в третью – раствор сульфата железа (II) (FeSO4). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe0 + Cu 2+ = Fe 2+ + Cu0↓
2. Взаимодействие солей с щелочами:
3. Взаимодействие солей с кислотами:
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.
III. Химические свойства кислот
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H+), который всегда образуется при диссоциации.
Именно поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный цвет.
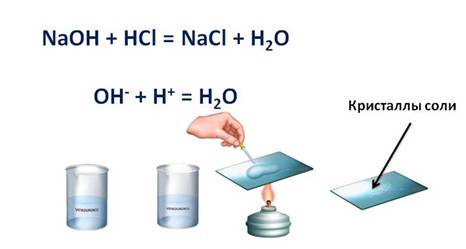
1. Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
2. Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
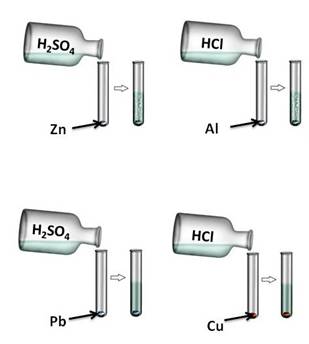
3. Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
Давайте, попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую –алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты (H2SO4), во вторую и четвёртую – раствора соляной кислоты (HCl). Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn 0 + 2H + = Zn 2+ + H2 0 ↑
2Al 0 + 6H + = 2Al 3+ + 3H2 0 ↑
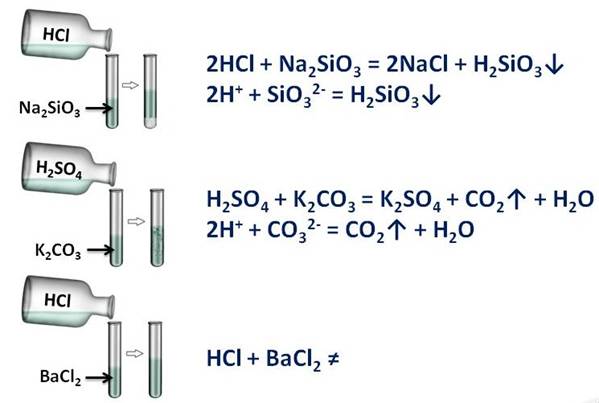
Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Соляна (HCl) и серная кислоты (H2SO4), вам покажут это: в первой пробирке будет соляная кислота и силикат натрия (Na2SiO3), во второй – серная кислота и карбоната калия (K2CO3), в третьей – опять соляной кислоты и хлорида бария (BaCl2). Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого осадка (H2SiO3), во второй – выделение газа (CO2), а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
IV. Выполнение упражнений
Задание: составьте уравнения цепочки реакций (на “4”)
Еесли реакция является обменом, разберите ее как РИО, если реакция является ОВР, разберите ее с помощью электронного баланса (на “5”)