Что такое основания бренстеда
Органическая химия
Информативные ответы на все вопросы курса «Органическая химия» в соответствии с Государственным образовательным стандартом.
Оглавление
Приведённый ознакомительный фрагмент книги Органическая химия предоставлен нашим книжным партнёром — компанией ЛитРес.
5. Кислоты Бренстеда
Для характеристики кислотности и основности органических соединений применяют теорию Бренстеда.
Основные положения этой теории.
Кислота — это частица, отдающая протон (донор Н+); основание — это частица, принимающая протон (акцептор Н-).
Кислотность всегда характеризуется в присутствии оснований и наоборот.
А-Н(кислота) +В(основание) — А (сопряженное основание) + В-Н+ (сопряженная кислота).
Кислоты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
2) ОН-кислоты (спирты, фенолы, карболовые кислоты);
3) НЗ-кислоты (амины, амиды);
В этом ряду сверху вниз кислотность уменьшается. Сила кислоты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее кислота. Стабильность аниона зависит от делока-лизации (распределения) «отрицательного» заряда по всей частице (аниону). Чем больше делокализован «отрицптельный» заряд, тем стабильнее анион и сильнее кислота.
Делокализация заряда зависит:
1) от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая кислота. Например: R-OH и R-NH2.
Спирты более сильные кислоты, чем амины, т. к. ЭО (0) → 30(N);
2) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая кислота. Например: R-SH и R-ОН.
Тиолы более сильные кислоты, чем спирты, т. к. атом S более поляризован, чем атом О;
3) от характера заместителя R (его длины, наличия сопряженной системы, делокализации электронной плотности).
Например: СН3-ОН, СН3-СН2-ОН, СН3-СН2-СН2-ОН. Кислотность меньше, так как увеличивается длина радикала.
При одинаковом кислотном центре сила спиртов, фенолов и карбоновых кислот не одинакова. Фенолы являются более сильными кислотами, чем спирты за счет р, s-сопряжения (+М) группы (-ОН). Связь О—Н более поляризуется в фенолах. Фенолы могут взаимодействовать даже с солями (FeC13) — качественная реакция на фенолы. Карбоновые кислоты по сравнению со спиртами, содержащими одинаковый R, являются более сильными кислотами, так как связь О—Н значительно поляризована за счет — М-эффекта группы > С = О. Кроме того, карбоксилат-анион более стабилен, чем анион спирта за счет р, s-сопряжения в карбоксильной группе;
4) от введения заместителей в радикал. ЭА-замести-тели увеличивают кислотность, ЭД-заместители уменьшают кислотность;
Кислоты и основания Бренстеда
Вы будете перенаправлены на Автор24
Определение кислот и оснований по Бренстеду и Лаури
И основание, и кислота во время реакции могут переносить протон, поэтому их называют протолитами. Реакции между протолитами называются протолитическими.
В общем виде реакцию между кислотой и основанием можно записать следующим образом:
Реакции между кислотами и основаниями Бренстеда
Готовые работы на аналогичную тему
Вода является амфотерным растворителем и может выступать как в роли кислоты, так и в роли основания.
Вода в роли кислоты, является донором протона:
Вода в роли основания, действует как акцептор протонов:
Ионы могут обнаруживать двойные функции: выступать и как основание и как кислота. Свойства конкретного соединения зависят от свойств, проявляемых конкурирующей сопряженной пары.
ведет себя как донор (кислота):
ведет себя как акцептор (основание):
Свойства кислот и оснований противоположны и при взаимодействии они нейтрализуют друг друга, то есть протекает реакция нейтрализации. В результате данной реакции образуется соль (ионное соединение) и вода.
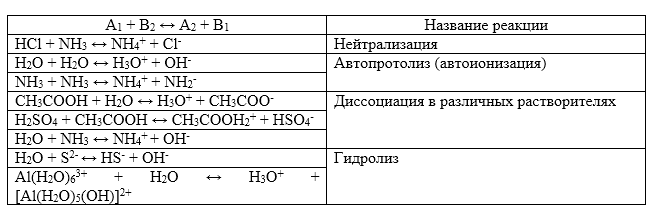
Протолитическая теория описывает многие равновесия. Примеры таких процессов изображены в таблице:
При определении концентрации кислоты, пользуются стандартным раствором основания (т.е. с известной концентрацией). И наоборот, при определении концентрации основания пользуются стандартным раствором кислоты.
Количественная характеристика силы кислоты
Измерить абсолютное значение Кa невозможно, так как данное равновесие возможно при наличии сопряженной пары. Значение константы кислотности можно предопределить относительно выбранного стандарта.
Стандартное равновесие имеет вид:
$A_1 + B_2 ↔ A_2 + B_1$
Константы кислотности кислоты при взаимодействии с водой будут теми же, что и в теории Аррениуса. Для многоосновных кислот первая константа равновесия всегда больше последующих.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 06 05 2021
Кислотность и основность по Бренстеду



Органических соединений
КИСЛОТНОСТЬ И ОСНОВНОСТЬ
Кислотность и основность – важнейшие понятия, определяющие многие физико-химические свойства и реакционную способность органических соединений. Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда и теория Льюиса.
По теории Бренстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н + :
 |
Кислота Н + + Основание
Кислоты – вещества, способные отдавать протон (доноры протонов).
Основания – вещества, способные присоединять протон (акцепторы протона).
Кислота и основание образуют сопряженную кислотно-основную пару. Кислотные свойства проявляются в присутствии основания, основные – в присутствии кислоты. Между кислотой и основанием сопряженной пары существует взаимосвязь: чем сильнее кислота, тем слабее сопряженное основание, и наоборот. Например, уксусная кислота слабее, чем соляная, и, соответственно, ацетат-анион – более сильное основание, чем анион хлора.
Кислоты Бренстеда. Сила кислот Бренстеда зависит от растворителя. Это связано с тем, что молекулы растворителя сами являются кислотами или основаниями Бренстеда. Например, при растворении кислоты Н-А в воде происходит ионизация этих веществ:
 |
Константа равновесия этой реакции выражается уравнением:
В зависимости от природы элемента, с которым связан отщепляемый протон, бренстедовские кислоты делятся на ОН-кислоты (карбоновые кислоты, спирты, фенолы), SH-кислоты (тиолы), NH-кислоты (аммиак, амины, амиды), СН-кислоты (углеводороды и их производные).
По возрастанию кислотности кислоты Бренстеда располагаются в ряд:
СН-кислоты n-основания (содержат свободную электроную пару) и p-основания.
К p-основаниям относят алкены, алкадиены, арены, т.е. соединения, содержащие p-связи. p-Основания за счет электронной пары p-связи могут присоединять протон (s-орбиталь протона перекрывается с p-орбиталью). Эта неустойчивая частица носит название p-комплекса. Протон при этом не присоединяется ни к одному из атомов:
В дальнейшем p-комплекс преобразуется в s-комплекс.
n-Основания связь с протоном образуют за счет свободной электронной пары атома азота (в аминах, гетероциклических соединениях), атома кислорода (в спиртах, простых эфирах, карбоновых кислотах, альдегидах, кетонах), атома серы (в тиоспиртах, тиоэфирах).
Сила n-оснований уменьшается в ряду: R-NH2 > R-OH > R-SH.
На силу кислот и оснований влияют строение вещества и природа растворителя. Кислотность органических соединений зависит:
· От электроотрицательности атомов, ответственных за проявление кислотных свойств,
· От поляризуемости связей в кислотном центре;
· От факторов, которые определяют высокую стабильность образующихся при диссоциации.
Лекция №4 Органические кислоты и основания
ОРГАНИЧЕСКИЕ КИСЛОТЫ И ОСНОВАНИЯ
ОРГАНИЧЕСКИЕ КИСЛОТЫ И ОСНОВАНИЯ
В настоящее время существуют две основных
теории кислот и оснований: теория Бренстеда и теория Льюиса.
Протонная теория кислот и
оснований Бренстеда
Кислоты Бренстеда – э то соединения,
способные отдавать протон (доноры протона).
Кислоты и основания образуют сопряженные
кислотнотно-основные пары, например:
| CH3COOH | + | H2O |  | CH3COO — | + | H3O + |
| кислота1 | основание 2 | основание1 | кислота2 |
| CH3NH2 | + | H2O |  | CH3NH3 + | + | OH — |
| основание1 | кислота2 | кислота1 | основание2 |
| Н-А | + | :В |  | :А | + | Н-В |
| кислота1 | основание2 | основание1 | кислота2 |
Сила кислоты НА будет зависеть от силы основания
:В. Поэтому для создания единой шкалы силу кислот и оснований Бренстеда
определяют относительно воды, которая является амфотерным соединением и может
проявлять и кислотные, и основные свойства.
Сила кислот определяется константой равновесия
их взаимодействия с водой как основанием, например:
Так как в разбавленных растворах
[H 2 O]=const, то ее можно внести в
константу равновесия, которую называют константой кислотности:
Сила оснований определяется константой
равновесия взаимодействия их с водой как кислотой:
.gif)
константа основности.
На практике чаще пользуются величиной .gif)
.gif)
сильнее основание.
Классификация органических
кислот и оснований
Кислоты и основания Бренстеда классифицируют по
природе атома при кислотном или основном центре.
В зависимости от природы элемента, с которым
связан протон, различают четыре основных типа органических кислот
Бренстеда:
В зависимости от
природы атома, к неподеленной паре электронов которого присоединяется протон,
основания Бренстеда делят на три основных типа:
Влияние структурных факторов на
относительную силу кислот и оснований
Сила кислоты или основания определяется
положением равновесия кислотно-основного взаимодействия и зависит от разности
свободных энергий исходных и конечных соединений. Поэтому факторы, которые
стабилизируют сопряженное основание в большей степени, чем кислоту, увеличивают
кислотность и уменьшают основность. Факторы, стабилизирующие преимущественно
кислоту по сравнению с основанием, действуют в противоположном направлении.
Поскольку сопряженные основания, как правило, несут отрицательный заряд, то
увеличению кислотности способствуют факторы, стабилизирующие анион.
Влияние строения на силу кислот и
оснований.
Сила кислоты зависит от природы атома при
кислотном центре и от его структурного окружения.
Для оценки относительной силы кислот важны такие
характеристики атома при кислотном центре как его электроотрицательность и
поляризуемость.
При прочих равных условиях для элементов одного
периода с ростом электроотрицательности атома кислотность соединений
увеличивается, так как высокая электроотрицательность атома при кислотном центре
стабилизирует образующийся при отщеплении протона анион. Так, кислотность
уменьшается в ряду:
OH-кислоты> NH-кислоты>
CH-кислоты
| CH3O-H | CH3NH-H | CH3CH2-H | |
| pKa | 16 | 30 | 40 |
Электроотрицательность атома зависит не только
от его природы, но и от типа гибридизации и возрастает по мере увеличения
s-характера гибридных орбиталей. Параллельно возрастает кислотность
соединений:
.gif)
Для элементов одной подгруппы с возрастанием
заряда ядра кислотность соединений увеличивается:
Увеличение кислотности соединений, несмотря на
снижение электроотрицательности атомов в подгруппе, связано с увеличением их
поляризуемости по мере возрастания радиуса атома. Большая поляризуемость атома
способствует лучшей делокализации отрицательного заряда и повышению стабильности
сопряженного основания.
При одинаковой природе атома при кислотном
центре сила кислоты определяется его структурным окружением. Увеличению силы
кислоты способствует делокализация отрицательного заряда в сопряженном основании
(анионе) и его рассредоточение на большем количестве атомов.
Так, карбоновые кислоты – одни из самых сильных
органических кислот. Их сила обусловлена стабилизацией карбоксилат-аниона за
счет делокализации отрицательного заряда в сопряженной системе. В результате
отрицательный заряд в карбоксилат-анионе рассредоточен между двумя атомами
кислорода, а обе связи С-O абсолютно равноценны:
Фенолы являются более сильными кислотами, чем
спирты, за счет резонансной стабилизации фенолят-аниона, отрицательный заряд
которого делокализован по ароматическому кольцу:
В результате по силе органические OH-кислоты
могут быть расположены в следующий ряд:
Введение заместителя в связанный с кислотным
центром углеводородный радикал влияет на силу кислоты. Электроноакцепторные
заместители увеличивают, а электронодонорные — уменьшают кислотность. Влияние
электроноакцепторных заместителей связано с их способностью делокализовать
отрицательный заряд и, тем самым
стабилизировать сопряженное основание (анион). Влияние электронодонорных
заместителей напротив приводит к дестабилизации аниона.
Электроноакцепторные заместители увеличивают
силу алифатических и ароматических карбоновых кислот, электронодонорные
заместители действуют в противоположном направлении:
Аналогичное влияние оказывают заместители на
кислотность спиртов и фенолов.
П ри одинаковом структурном окружении для
элементов одного периода с ростом электроотрицательности атома при основном
центре основность соединений уменьшается:
аммониевые основания > оксониевые основани я
| ROH | RNH2 | ||||||||||||||||||
.gif) | Снижение основности связано с тем, что более Увеличения s-характера гибридных орбиталей Для элементов одной подгруппы с возрастанием оксониевые основания > сульфониевые Введение электронодонорных заместителей
Если свободная пара электронов азота находится в Протонирование анилина приводит к нарушению
Амиды карбоновых кислот являются очень слабыми | .gif) | .gif) | .gif) | |||||||||||||||
| pKa | 11,27 | 5,2 | — 0.3 |
Кислоты и основания
Льюиса
Дж. Льюисом была предложена более общая теория
кислот и оснований.
Основания Льюиса – это доноры пары
электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.)
Таким образом, основания Бренстеда и Льюиса –
это одни и те же частицы. Однако основность по Бренстеду есть способность
присоединять только протон, в то время как основность по Льюису – понятие более
широкое и означает способность к взаимодействию с любой частицей, имеющей
низколежащую свободную орбиталь.
Кислотно-основное взаимодействие по Льюису есть
доноро-акцепторное взаимодействие и любую гетеролитическую реакцию можно
представить как взаимодействие кислоты и основания Льюиса:
Единой шкалы для сравнения силы кислот и
оснований Льюиса не существует, так как их относительная сила будет зависеть от
того, какое вещество взято за стандарт (для кислот и оснований Бренстеда таким
стандартом является вода). Для оценки легкости протекания кислотно-основного
взаимодействия по Льюису Р. Пирсоном была предложена качественная теория
“жестких” и “мягких” кислот и оснований.
Жесткие основания обладают высокой
электроотрицательностью и низкой поляризуемостью. Они трудно окисляются. Их
высшие занятые молекулярные орбитали (ВЗМО) имеют низкую энергию.
Мягкие основания имеют низкую
электроотрицательность и высокую поляризуемость. Они легко окисляются. Их высшие
занятые молекулярные орбитали (ВЗМО) имеют высокую энергию.
Жесткие кислоты имеют высокую
электроотрицательность и низкую поляризуемость. Они трудно восстанавливаются. Их
низшие свободные молекулярные орбитали (НСМО) имеют низкую энергию.
Мягкие кислоты обладают низкой
электроотрицательностью и высокой поляризуемостью. Они легко восстанавливаются.
Их низшие свободные молекулярные орбитали (НСМО) имеют высокую энергию.
Таблица 5. Жесткие и мягкие кислоты
и основания.
Принцип жестких и мягких кислот и оснований
Пирсона (принцип ЖМКО):
Жесткие кислоты преимущественно
взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими
основаниями.
Это выражается в больших скоростях реакций и в
образовании более устойчивых соединений, так как взаимодействие между близкими
по энергии орбиталями эффективнее, чем взаимодействие между орбиталями,
значительно различающимися по энергии.
Принцип ЖМКО используют для определения
преимущественного направления конкурирующих процессов (реакции элиминирования и
нуклеофильного замещения, реакции с участием амбидентных нуклеофилов); для
направленного создания детоксикантов и лекарственных препаратов.
Лекция №4 Органические кислоты и основания : 1 комментарий
Нельзя ли узнать, из какого учебника взят материал для лекции № 4 \»Органические кислоты и основания\»? Помогите, пожалуйста, очень нужна ссылка! Заранее спасибо! ЕИ




.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)