Что такое основания химия 8 класс определение
Что такое основания химия 8 класс определение
Основаниями или гидроксидами называют соединения металлов с гидроксогруппами ОН (одна или несколько групп ОН на каждый атом металла М, т.е. МОН или М(ОН)n). Гидроксогруппа ОН – это ион, ее заряд равен 1–, валентность I.
Названия оснований
В названии основания два слова: КОН – гидроксид калия. Если металл имеет переменную валентность, то ее указывают римской цифрой в скобках: Сг(ОН)3 – гидроксид хрома(III).
Щелочи – это растворимые в воде основания (LiOH, NaOH, КОН, Ва(ОН)2, Са(ОН)2 ). Щелочи – очень едкие вещества, вызывают ожоги. При работе с ними надо особенно тщательно соблюдать правила техники безопасности, надевать очки и перчатки.
Для распознавания растворов щелочей используют индикаторы.
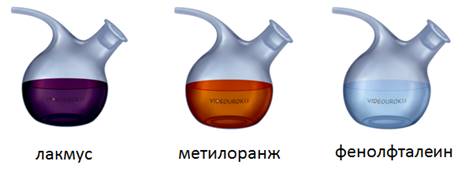
Индикаторы – это органические красители, изменяющие окраску в зависимости от состава раствора. Так, бесцветный раствор фенолфталеина в растворе щелочи становится малиновым. Фиолетовый раствор лакмуса в растворах щелочей становится синим, а оранжевый раствор метилоранжа приобретает интенсивно желтый цвет.
Нерастворимые основания – это практически нерастворимые в воде вещества, например гидроксид железа(III), гидроксид меди(II), гидроксид магния.
Основные оксиды – это оксиды, которым соответствуют основания. Если элемент образует несколько оксидов, то оксид, соответствующий низшей степени окисления, является основным оксидом. Например, СrО и МnО – основные оксиды.
Формулы основных оксидов можно вывести, вычитая необходимое число молекул воды из формулы основания. Например, для формул основных оксидов Na2O, СаО, Fe2O3:
а) 2NaOH – Н2O = Na2O;
б) Са(ОН)2 – Н2O = СаО;
в) 2Fe(OH)3 – 3Н2O = Fe2O3.
Получение оснований
Растворимые основания получают:
а) реакцией оксидов щелочных и щелочноземельных металлов с водой: ВаО + Н2O = Ва(ОН)2;
б) взаимодействием активных металлов (электроотрицательность которых 1,2 и меньше) с водой: 2 Li + 2Н2O = 2LiOH + Н2 ↑;
в) электролизом водного раствора соли, например хлорида натрия; при пропускании постоянного электрического тока через раствор на катоде выделяется водород, на аноде – хлор, а в растворе остается гидроксид натрия:
2NaCl + 2Н2O →электролиз→ Н2 ↑ + 2NaOH + Cl2 ↑.
Нерастворимые основания получают по реакции обмена растворимых солей со щелочами:
CuCl2 + 2NaOH = Cu(OH)2 ↓ + 2NaCl.
Химические свойства оснований
Нерастворимые основания – довольно неустойчивые соединения. Нагревание (300–400 °С) приводит к потере ими воды. Например, голубой гидроксид меди(II) при нагревании отщепляет воду и превращается в черный оксид меди(II):
Сu(ОН)2 → t → СuО + Н2O.
Основания (химия, 8 класс) – формулы и свойства реакций
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Рис. 1. Щёлочи в твёрдом состоянии.
Основания классифицируются по двум признакам:
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
Реакции
Что образуется
Примеры
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O
Разложение при высокой температуре
Оксид металла и вода
2Fe(OH)3 → Fe2O3 + 3H2O
С кислотными оксидами (реагируют щёлочи)
С неметаллами (вступают щёлочи)
2NaOH + Si + H2O → Na2SiO3 +H2↑
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓
Щелочей с некоторыми металлами
Сложная соль и водород
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Рис. 3. Реакция индикаторов на основания.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Физические и химические свойства оснований
Основания в химии — что это такое
В строительном деле в качестве скрепляющего компонента используется гашеная известь Ca(OH)2. Для ликвидации засоров в канализационной системе применяется едкий натр NaOH. В качестве электролита в гальванических элементах используется едкое кали KOH. Перечисленные вещества, как и многие другие, в химии относятся к основаниям, в формуле которых содержится металл и гидроксильная группа ОН.
В мире неорганической химии особое место занимают основания — вещества, содержащие в своем составе гидроксогруппы OH, благодаря которым у них появляются определенные характеристики, позволяющие широко применять эти соединения в быту и во многих отраслях промышленности. Растворимые основания называют щелочами. В растворенном виде это едкие мыльные на ощупь вещества.
Чтобы правильно построить название оснований, на первое место нужно поставить слово «гидроксид», затем назвать металл, атом которого присутствует в формуле. Кроме этого, обязательно в скобках указывают валентность этого металла (если он может проявлять различные валентности):
Характерным свойством гидроксидов является способность вступать в реакцию с кислотой, в результате чего образуется соль.
В химии основным оксидам соответствуют основания, подобно тому, как кислотным оксидам соответствуют кислоты.
Основание — вещество сложного строения, которое состоит из атома металла и гидроксогрупп ОН (их может быть несколько).
Схематически формулу основания можно выразить так:
где Me — условное обозначение металла;
(OH) — гидроксильные группы, число которых в формуле отражает валентность металла, точнее, — степень его окисления.
Поскольку в воде растворимые гидроксиды практически полностью распадаются на катионы металлов и анионы ОН-, с позиции электролитической диссоциации они являются электролитами.
Термин «основание» пришел в наши дни из XVII века, когда его употребил французский химик Гийом Франсуа Руэль (1754 год). По его утверждению превращение летучих жидкостей (например, уксусной кислоты) в кристаллическую соль происходит при участии конкретных веществ. В данном контексте эти вещества являются основанием для образования солей в твердой фазе.
Шведский физик и химик С. Аррениус в 1887 году представил научному миру единую теорию кислот и оснований, в которой изложил мысли, что при диссоциации кислот образуются положительно заряженные ионы H+, а при диссоциации оснований — отрицательно заряженные гидроскид-ионы OH-.
Классификация
В основе классификации оснований лежит ряд принципов:
Химические и физические свойства оснований
Описание химических свойств оснований всегда начинают со способности окрашивать в определенный цвет растворы индикаторов. Происходит это из-за наличия гидроксид-ионов в растворах оснований. Так, в присутствии раствора щелочей фенолфталеин приобретает малиновую окраску.
При добавлении в раствор щелочи нескольких капель лакмуса либо опускании в него лакмусовой бумажки появляется синяя окраска, в случае индикатора метилового оранжевого — желтая.
Одним из основных химических свойств является взаимодействие с кислотами. Такие реакции называются реакциями нейтрализации. В результате получается соль и вода. К примеру:
2KOH + H2SO4 → K2SO4 + 2H2O
С кислотами взаимодействуют как растворимые основания (как в примере с гидроксидом калия), так и нерастворимые:
Образованием солей заканчиваются не только реакции с кислотами, но и с кислотными оксидами:
Аналогичным образом происходит реакция с амфотерными оксидами (теми, которые при определенных условиях могут проявлять и кислотные, и основные свойства):
NaOH(твердый)+Al(OH)3→NaAlO2+H2O
Так протекает реакция при сплавлении амфотерных оксидов и гидроксидов с твердыми щелочами.
С другой стороны, реакция амфотерных оксидов и гидроксидов со щелочами возможна и в растворе. Тогда уравнение реакции имеет следующий вид:
Гидроксиды могут вступать в химическую реакцию с отдельными металлами, образующими амфотерные соединения, например, с цинком. В уравнении в качестве реагента реакции присутствует вода:
Как видно, реакция заканчивается образованием комплексной соли и выделением газообразного водорода.
Взаимодействие с растворимыми солями протекает только тогда, когда образуются нерастворимые вещества:
К химическим свойствам оснований относится разложение на оксиды и воду, причем независимо от того, растворимое оно или нет. Для этого нужно нагревание:
В данную реакцию не вступают только гидроксиды натрия NaOH и калия KOH, которые плавятся без разложения.
Характеристика физических свойств оснований заключается в том, что это твердые вещества, некоторые (щелочи) растворимы в воде. Основания могут иметь различную окраску (гидроксид натрия NaOH — белый, гидроксид меди (II) Cu(OH)2 — синий, гидроксид железа (III) Fe(OH)3 — бурый). К слабым основаниям относят также раствор аммиака в воде.
Щелочи имеют свойство разъедать ткани и кожу человека (при длительном воздействии). По этой причине работы со щелочами нужно проводить со строгим соблюдением правил химической безопасности, пользоваться средствами индивидуальной защиты и проходить соответствующие инструктажи.
Способы получения
Выбрать метод получения основания можно исходя из его принадлежности к определенной группе (растворимых или нерастворимых веществ). Если это щелочь, ее легко получить в реакции активного металла с водой.
Металл должен относиться к группам щелочных либо щелочноземельных металлов.
По сути это реакция замещения, в которой металл взаимодействует с H2O при обычных условиях. Классическим примером является уравнение реакции натрия с водой:
Еще одним способом получения основных гидроксидов является реакция основного оксида с водой. Оксид щелочного или щелочноземельного металла, вступает в реакцию с водой (реакция протекает, если образующийся гидроксид растворим). Происходит реакция соединения, например,
В отличие от гидроксида кальция, который именно таким образом получают в промышленных целях, гидроксиды натрия и калия получают электролитическим путем. Пропуская постоянный электрический ток через раствор NaCl, можно получить гидроксид натрия в результате протекания следующей реакции:
В ходе трудовой деятельности часто возникает необходимость получения нерастворимых гидроксидов. В частности гидроксид меди (II) получают, прибавляя к раствору его соли раствор щелочи. При этом происходит реакция, которая в химии называется реакцией обмена:
Таким же образом получают гидроксид железа (II):
И тот, и другой гидроксид — нерастворимое твердое вещество, выпадающее в ходе реакции в осадок.
Основания
Урок 20. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Основания»
В нем металл и кислород,
Да еще плюс водород,
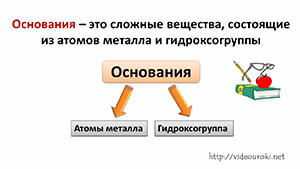
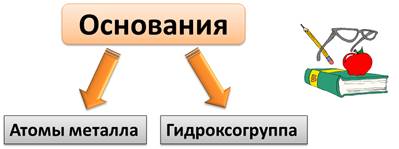
Основания – это сложные вещества, состоящие из атомов металла и гидроксогруппы. Гидроксогруппа – это группа ОН.
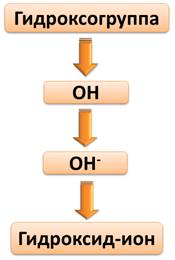
Степень окисления О (-2), Н (+1), поэтому суммарный заряд этого иона (1-). Т.е. гидроксогруппа представляет собой сложный ион, который еще называют гидроксид-ионом.
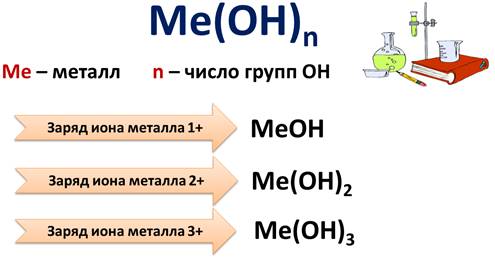
Состав оснований можно записать формулой Ме(ОН)n, где Ме – это металл, а n – число групп ОН.
Название оснований состоит из слова гидроксид + название металла в родительном падеже. Например, КОН – гидроксид калия, Ва(ОН)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия.
Если металл проявляет переменную степень окисления, то после названия в скобках римскими цифрами ставят численное значение степени окисления. Например: Cu(OH)2 – гидроксид меди (II), Fe(OH)3 – гидроксид железа (III), Mn(OH)2 – гидроксид марганца (II).
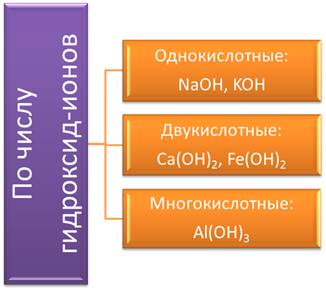
По числу гидроксид-ионов основания подразделяют на: однокислотные, в формулах которых 1 гидроксид-ион (NaOH, KOH); двукислотные, в формулах которых 2 гидроксид-иона (Ca(OH)2, Fe(OH); многокислотные основания, в которых три и более гидроксид-ионов (Al(OH)3).
По растворимости в воде основания делятся на растворимые в воде, или щёлочи и нерастворимые в воде. Растворимыми основаниями являются основания, образованные металлами I A группы и некоторыми металлами II A группы. Например, NaOH, Ba(OH)2, KOH. Растворимые в воде основания хорошо растворяются в воде, не образуя, осадка, а нерастворимые, наоборот, выпадают в виде осадка и нерастворимы в воде. Например, Cu(OH)2, Al(OH)3, Fe(OH)2.
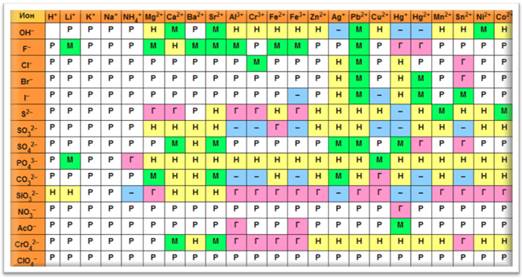
Для того чтобы определить растворимо или нерастворимо основание в воде, можно воспользоваться таблицей растворимости. Если в таблице на пересечении иона металла и гидроксид-иона стоит буква «Р», значит, это основание растворимо в воде, если на пересечении стоит буква «М», значит, основание мало растворимо в воде, а если буква «Н», значит, основание нерастворимо в воде.
Рассмотрим некоторые щёлочи. Одной из наиболее распространённых щелочей является гидроксид натрия – NaOH. Это твердое белое вещество, гигроскопично, т.е. поглощает влагу из воздуха, поэтому оно расплывается на воздухе, хорошо растворимо в воде с выделением тепла.
Раствор гидроксида натрия мыльный на ощупь и очень едкий, поэтому его ещё называют едкий натр. Он разъедает ткани, кожу, бумагу и др. органические материалы. С гидроксидом натрия и его раствором обращаться нужно осторожно, при попадании на кожу вызывает долго не заживляющие раны. Гидроксид натрия широко используется в мыловарении, кожевенной, фармацевтической промышленности, бумажной и текстильной промышленности. Его техническое название – «каустическая сода».
Гидроксид калия – КОН – является тоже твердым белым веществом, которое хорошо растворимо в воде, при этом выделяется большое количество теплоты.
Его раствор мыльный на ощупь и очень едкий, поэтому гидроксид калия тоже называют едкое кали. Его применяют при производстве мыла и тугоплавкого стекла.
Гидроксид кальция Са(ОН)2 называют еще гашёной известью. Его получают реакцией негашёной извести с водой. Гидроксид кальция представляет собой рыхлый белый порошок, малорастворимый в воде. Этот гидроксид используют при кладке и штукатурке стен, побелке деревьев, для получения хлорной извести.
Прозрачный раствор гидроксида кальция называют известковой водой. Если через нее пропустить углекислый газ, то она помутнеет, вследствие образования нерастворимого карбоната кальция. Эта реакция является качественной на углекислый газ. Качественные реакции – это реакции, с помощью которых распознают определенные вещества. Следовательно, углекислый газ распознают по помутнению известковой воды.
Для того чтобы определить щёлочи, используют специальные вещества, которые называют индикаторами. Индикаторы – это вещества, которые изменяют свою окраску под действием различных веществ. Сравним окраску индикаторов в нейтральной среде, или в воде и в растворах щелочей.
Наиболее распространенными индикаторами являются: лакмус, метиловый оранжевый и фенолфталеин. В нейтральной среде лакмус – фиолетовый, метиловый оранжевый – оранжевый, фенолфталеин – бесцветный.
Если мы капнем в щелочь лакмуса, то он станет синим, метиловый оранжевый – желтым, а фенолфталеин и вовсе станет малиновым. Поэтому c помощью индикаторов можно отличить щелочи от других классов соединений.
Изменение окраски индикаторов в зависимости от среды
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
ОСНОВАНИЯ
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
Классификация оснований
Щёлочи – это основания растворимые в воде.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований: