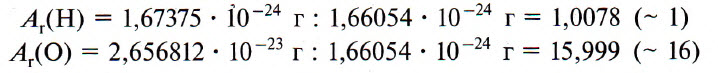Что такое относительная атомная масса определение
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Что такое относительная атомная масса определение
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
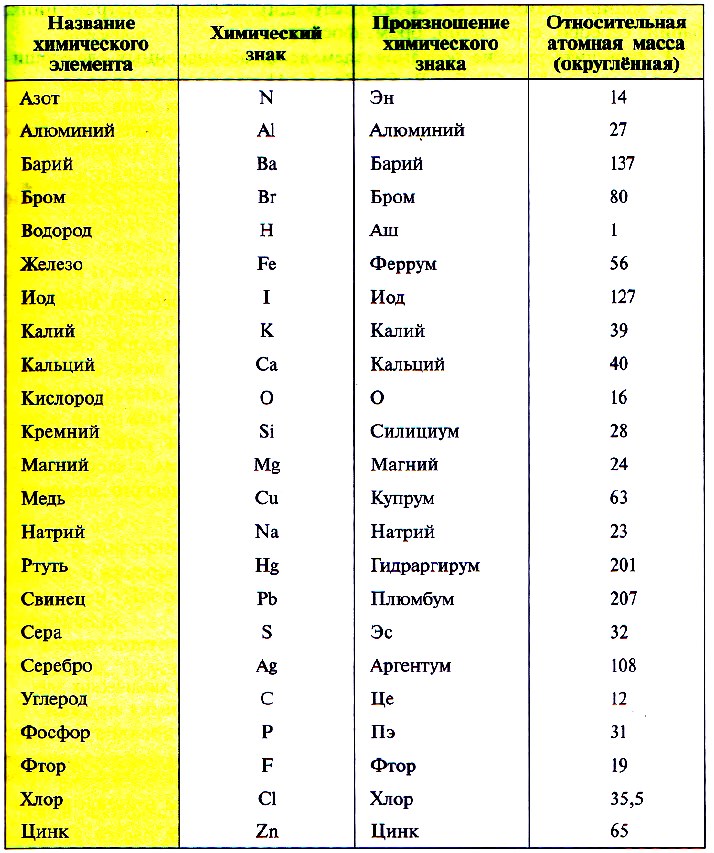
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Относительная атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. только для свинца изотопа атомная масса не является целым числом, хотя и близка к массовому числу данного изотопа (т. е. суммарному количеству нуклонов — протонов и нейтронов — в его ядре). Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Поэтому один моль атомов железа (т. е. их количество, равное числу Авогадро, 6,022·10 23 ) содержит 55,847 граммов.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы изотоп кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).
Относительная атомная масса элемента
Абсолютные массы атомов Одним из фундаментальных свойств атомов, является их масса. Абсолютная (истинная) масса атома – величина чрезвычайно малая. Взвесить атомы на весах невозможно, поскольку таких точных весов не существует. Их массы были определены с помощью расчетов.
Например, масса одного атома водорода равна 0,000 000 000 000 000 000 000 001 663 грамма!
Масса атома урана – одного из самых тяжелых атомов, составляет приблизительно 0,000 000 000 000 000 000 000 4 грамма. Записывать и читать эти числа непросто; можно ошибиться, пропустив ноль или добавить лишний. Существует другой способ записи – в виде произведения: 4 ∙ 10−22 (22 – количество нулей в предыдущем числе).
Точное значение массы атома урана – 3,952 ∙ 10−22 г, а атома водорода, самого легкого среди всех атомов, – 1,673 ∙ 10−24 г. Производить расчеты с малыми числами неудобно. Поэтому вместо абсолютных масс атомов используют их относительные массы.
Относительная атомная масса
О массе любого атома можно судить, сравнивая ее с массой другого атома (находить отношение их масс). С момента определения относительных атомных масс элементов использовались различные атомы в качестве сравнения. Своеобразными эталонами для сравнения в свое время были атомы водорода и кислорода.
Единая шкала относительных атомных масс и новая единица атомной массы, принята Международным съездом физиков (1960) и унифицирована Международным съездом химиков (1961). По сегодняшний день эталоном для сравнения является 1/12 часть массы атома углерода. Данное значение называют атомной единицей массы, сокращенно а.е.м
Атомная единица массы (а.е.м.) – масса 1/12 части атома углерода
Сравним, во сколько раз отличается абсолютная масса атома водорода и урана от 1 а.е.м., для этого разделим эти числа одно на другое:
Полученные при расчетах значения и являются относительными атомными массами элементов – относительно 1/12 массы атома углерода.
Так, относительная атомная масса водорода приблизительно равна 1, а урана – 238. Обратите внимание, что относительная атомная масса не имеет единиц измерения, так как при делении единицы измерения абсолютных масс (граммы) сокращаются. Относительные атомные массы всех элементов указаны в Периодической Системе химических элементов Д.И. Менделеева. Символ, при помощи которого обозначают относительную атомную массу – Аr (буква r – сокращение от слова relative, что означает относительный).
Значения относительных атомных масс элементов используются во многих расчетах. Как правило, значения, приведенные в Периодической Системе, округляются до целых чисел. Обратите внимание, что элементы в Периодической Системе размещены в порядке увеличения относительных атомных масс. Например, при помощи Периодической Системы определим относительные атомные массы ряда элементов:
Ar(Na) = 23;
Относительную атомную массу хлора принято записывать равной 35,5!
Относительная атомная масса
Относительная атомная масса определяется средней атомной массой или средневзвешенным значением атомных масс всех атомов определенного химического элемента, обнаруженного в конкретном образце, которое затем сравнивается с атомной массой углерода-12. [5] Это сравнение представляет собой частное двух весов, что делает значение безразмерным (без единицы измерения). Это частное также объясняет слово « относительный» : значение массы образца считается относительно массы углерода-12.
Текущее определение
Преобладающие определения IUPAC (взятые из « Золотой книги »):
Определение относительной атомной массы ИЮПАК [1] таково:
Историческое использование
Более старые (до 1961 г.) исторические относительные шкалы, основанные на атомной единице массы (символ: аму или аму ), использовали либо относительную изотопную массу кислорода-16, либо относительную атомную массу кислорода (т. Е. Атомную массу) для справки. См. Статью об истории современной единой атомной единицы массы для решения этих проблем.
IUPAC комиссия CIAAW поддерживает ожидание интервала значения относительной атомную массу (или атомный вес) на Земле под названием стандартного атомного веса. Стандартный атомный вес требует, чтобы источники были наземными, естественными и стабильными в отношении радиоактивности. Также есть требования к исследовательскому процессу. Для 84 стабильных элементов CIAAW определил этот стандартный атомный вес. Эти значения широко публикуются и свободно называются «атомным весом» для реальных веществ, таких как фармацевтические препараты и коммерческая торговля.
Кроме того, CIAAW опубликовал сокращенные (округленные) значения и упрощенные значения (для случаев, когда земные источники систематически меняются).
Относительная изотопная масса является конкретно отношением массы одного атома к массе объединенной единицы массы атома. Эта величина тоже относительна, а потому безразмерна.
| Изотоп | Атомная масса [13] | Изобилие [14] | |
|---|---|---|---|
| Стандарт | Диапазон | ||
| 28 Si | 27,976 926 532 46 (194) | 92,2297 (7)% | 92,21–92,25% |
| 29 Si | 28,976 494 700 (22) | 4,6832 (5)% | 4,67–4,69% |
| 30 Si | 29,973 770 171 (32) | 3,0872 (5)% | 3,08–3,10% |
Расчет выглядит следующим образом:
A r (Si) = ( 27,976 93 × 0,922297) + ( 28,976 49 × 0,046832) + ( 29,973 77 × 0,030872) = 28,0854
Оценка неопределенности затруднена [16], особенно потому, что распределение выборки не обязательно симметрично: стандартные относительные атомные массы ИЮПАК указаны с расчетными симметричными неопределенностями [17], а значение для кремния составляет 28,0855 (3). Относительная стандартная неопределенность этого значения составляет 1 × 10 –5 или 10 ppm.
Помимо этой погрешности измерения, некоторые элементы имеют вариации по источникам. То есть разные источники (океанская вода, скалы) имеют разную радиоактивную историю и разный изотопный состав. Чтобы отразить эту естественную изменчивость, ИЮПАК в 2010 году принял решение перечислить стандартные относительные атомные массы 10 элементов как интервал, а не фиксированное число. [18]