Что такое относительные единицы в химии
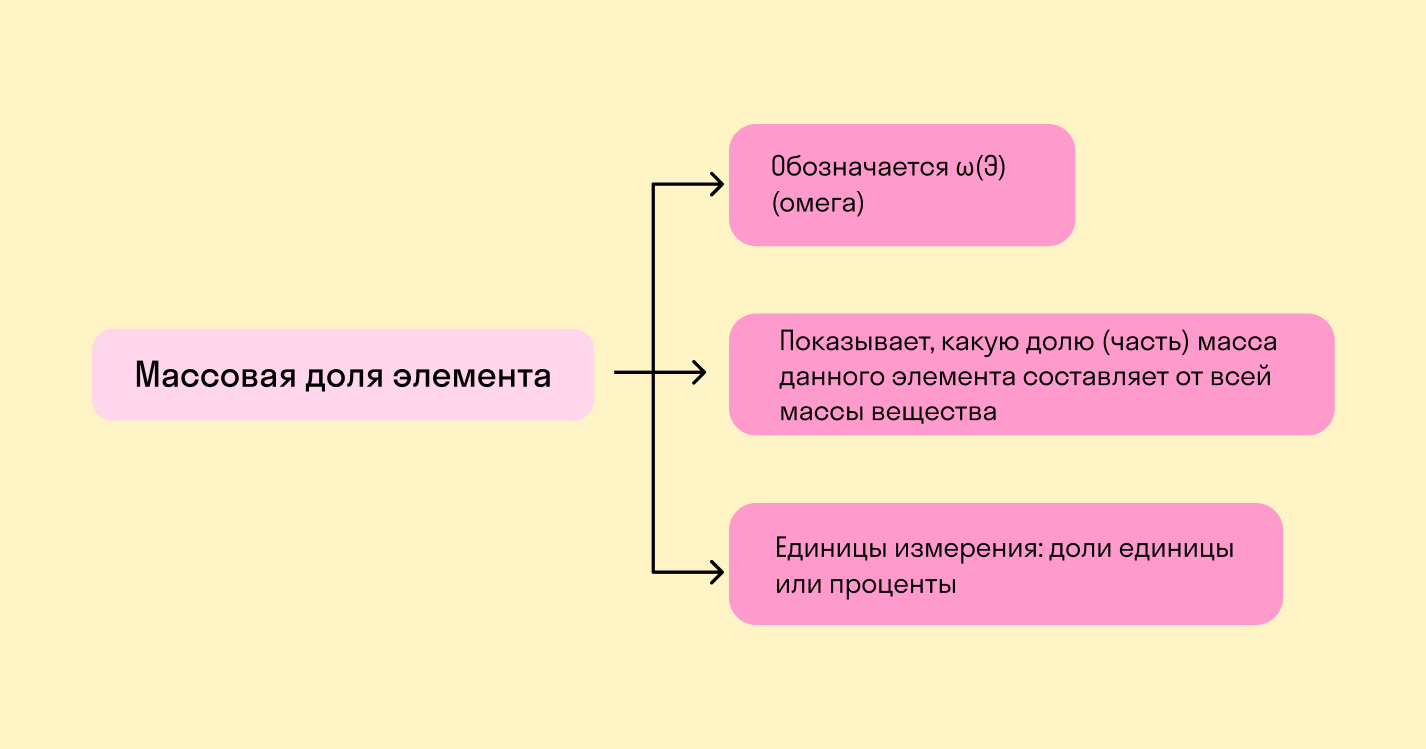
Массовая доля
Что такое массовая доля
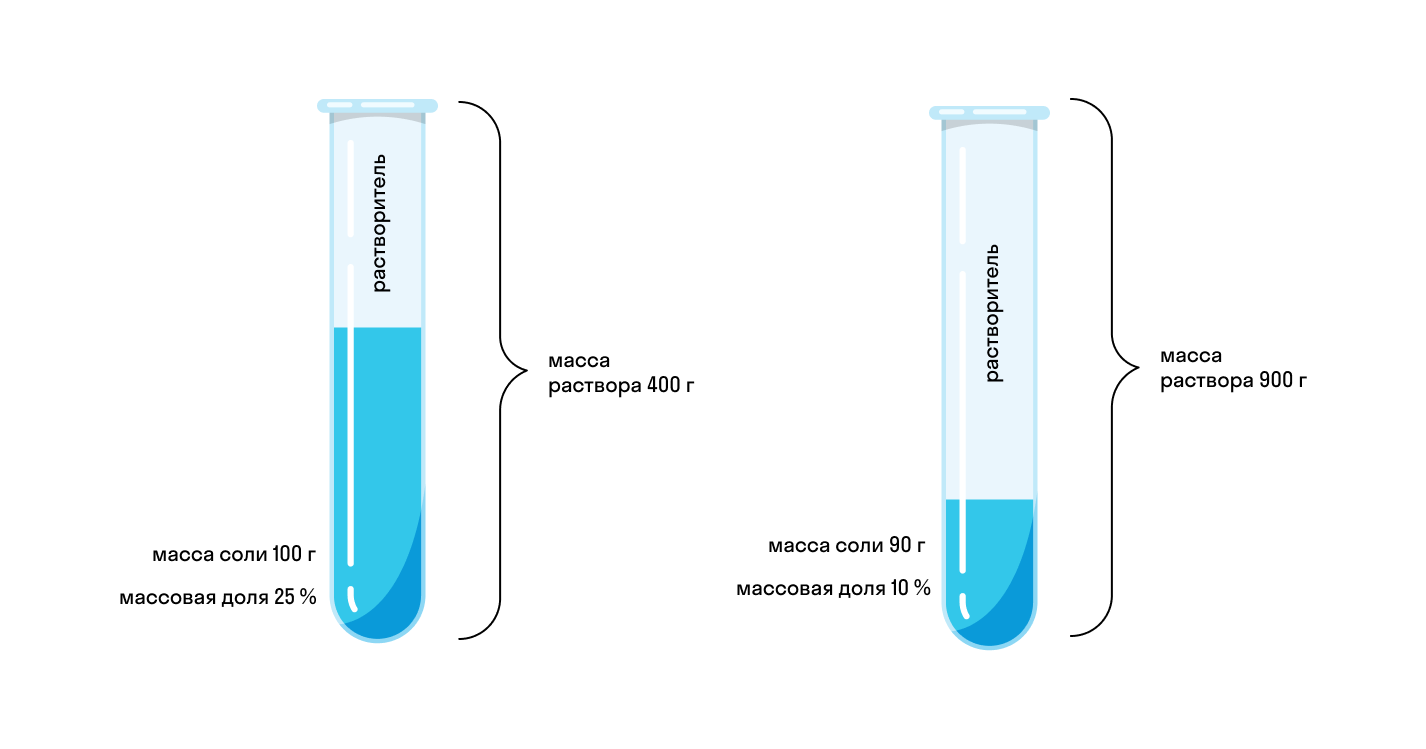
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где — обозначение массовой доли;
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
— количество атомов искомого элемента;
— относительная атомная масса элемента;
— относительная молекулярная масса сложного вещества.
Если нужен показатель в процентах, результат надо умножить на 100%.
Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 212 + 6 1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Относительная атомная и молекулярная массы

Всего получено оценок: 926.
Всего получено оценок: 926.
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а. е. м.). Относительная молекулярная масса складывается из относительных атомных масс веществ.
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).

Как видно, эти два понятия имеют несколько общих характеристик:
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10 −24 г. Следовательно, формула относительной атомной массы имеет следующий вид:
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа – 16 О, 17 О, 18 О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Относительная молекулярная масса – сумма масс атомов вещества:
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Что мы узнали?
Из урока 8 класса узнали об относительной атомной и молекулярной массе. За единицу относительной атомной массы принята 1/12 часть массы углерода, равная 1,66⋅10 −24 г. Для вычисления массы необходимо абсолютную атомную массу вещества разделить на атомную единицу массы (а. е. м.). Значение относительной атомной массы указано в периодической системе Менделеева в каждой клетке элемента. Молекулярная масса вещества складывается из суммы относительных атомных масс элементов.
Относительная атомная и молекулярная масса
Для измерения массы атома используется относительная атомная масса, которая выражается в атомных единицах массы (а. е. м.). Относительная молекулярная масса складывается из относительных атомных масс веществ.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr.
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u. Например, если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr. При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u.
Как определить массу молекулы?
Хотя идеи о том, что все вещества состоят из мельчайших частиц, то есть атомов, высказывались ещё Демокритом в Античности, доказать подобные гипотезы было невозможно. Однако в начале XIX в. произошел научный прорыв. Джон Дальтон открыл сразу три важных закона:
Объяснить открытые закономерности можно было только с помощью гипотезы об атомной строении вещества. Эти же законы позволяли Дальтону сравнивать массы атомов и молекул между собой. Ученый принял массу атома водорода за единицу (так как он оказался самым легким атомом), и через нее (то есть через водородную единицу) в 1803 г. выразил массы многих других атомов и молекул. Впрочем, оказалось, что значительная часть вычислений была проведена с ошибками.
На тот момент для определения масс атомов чаще всего использовались реакции образования оксидов, то есть кислородных соединений. По этой причине в ходе опытов фактически в качестве единицы измерения использовалась масса не атома водорода, а атома кислорода. Изначально грубые расчеты показывали, что кислородный атом в 16 раз тяжелее водородного атома, то есть его масса, по системе Дальтона, составляла 16 единиц. Однако потом выяснилось, что всё же атом кислорода тяжелее только в 15,874 раза. Эти данные потребовали пересчета всех атомных масс. Но химики поступили проще – они договорились, что теперь масса кислородного атома принимается в точности равной 16 атомным единицам. Так возникла новая, кислородная единицы атомного веса. В результате пересчитывать пришлось лишь массу водорода – она теперь составляла не единицу, а 16:15,874≈ 1,0079 атомных единиц.
Уже в начале XX в. выяснилось, что в природе могут существовать изотопы – разные по массе атомы одного и того же элемента. В частности, в природе встречается три различных стабильных изотопов кислорода (и ещё 10 – нестабильных). Встал вопрос – масса какого из этих изотопов будет приниматься за единицу? Физики стали использовать массу изотопа кислород-16, а химики – среднюю массу всех изотопов (с учетом их распространенности в природном кислороде). Возникли разночтения, которые были решены лишь в 1960-1961 г. Тогда была принята договоренность, что масса изотопа углерода-12 принимается равной 12 атомным единицам массы (а. е. м.). Таким образом появилась углеродная единица.
Понятия
Для осознания, что такое относительная атомная масса в химии, следует понимать, что абсолютная масса атома слишком мала, чтобы выражать её в граммах, а тем более в килограммах. Поэтому в современной химии за атомную единицу массы (а. е. м.) взята 1/12 часть массы углерода. Относительная атомная масса равна отношению абсолютной массы к 1/12 абсолютной массы углерода. Другими словами относительная масса отражает, во сколько раз масса атома конкретного вещества превышает 1/12 массы атома углерода. Например, относительная масса азота – 14, т.е. атом азота содержит 14 а. е. м. или в 14 раз больше, чем 1/12 часть атома углерода.
Рис. 1. Атомы и молекулы.
Среди всех элементов водород самый лёгкий, его масса равна 1 единице. Самые тяжёлые атомы имеют массу в 300 а. е. м.
Молекулярная масса – значение, показывающее, во сколько раз масса молекулы превышает 1/12 часть массы углерода. Также выражается в а. е. м. Масса молекулы складывается из массы атомов, поэтому для вычисления относительной молекулярной массы необходимо сложить значения масс атомов вещества. Например, относительная молекулярная масса воды равна 18. Это значение складывается из относительных атомных масс двух атомов водорода (2) и одного атома кислорода (16).
Рис. 2. Углерод в периодической таблице.
Как видно, эти два понятия имеют несколько общих характеристик:
Молярная и молекулярная массы совпадают численно, но отличаются по размерности. Молярная масса – это отношение массы вещества к количеству молей. Она отражает массу одного моля, который равен числу Авогадро, т.е. 6,02 ⋅ 10
. Например, 1 моль воды весит 18 г/моль, а Mr(Н2О) = 18 а. е. м. (тяжелее в 18 раз одной атомной единицы массы).
Как рассчитать
Чтобы выразить относительную атомную массу математически, следует определить, что 1/2 часть углерода или одна атомная единица массы равна 1,66⋅10
г. Следовательно, формула относительной атомной массы имеет следующий вид:
где ma – абсолютная атомная масса вещества.
Относительная атомная масса химических элементов указана в периодической таблице Менделеева, поэтому её не нужно рассчитывать самостоятельно при решении задач. Относительные атомные массы принято округлять до целых. Исключение составляет хлор. Масса его атомов равна 35,5.
Следует обратить внимание, что при расчёте относительной атомной массы элементов, имеющих изотопы, учитывается их среднее значение. Атомная масса в этом случае высчитывается следующим образом:
где Ar,i – относительная атомная масса изотопов, ni – содержание изотопов в природных смесях.
Например, кислород имеет три изотопа –
О. Их относительная масса равна 15,995, 16,999, 17,999, а их содержание в природных смесях – 99,759 %, 0,037 %, 0,204 % соответственно. Поделив проценты на 100 и подставив значения, получим:
Ar = 15,995 ∙ 0,99759 + 16,999 ∙ 0,00037 + 17,999 ∙ 0,00204 = 15,999 а.е.м.
Обратившись к периодической таблице, легко найти это значение в клетке кислорода.
Рис. 3. Таблица Менделеева.
Относительная молекулярная масса – сумма масс атомов вещества:
При определении значения относительной молекулярной массы учитываются индексы символов. Например, вычисление массы H2CO3 выглядит следующим образом:
Mr = 1 ∙ 2 + 12 + 16 ∙ 3 = 62 а. е. м.
Зная относительную молекулярную массу, можно вычислить относительную плотность одного газа по второму, т.е. определить, во сколько раз одно газообразное вещество тяжелее второго. Для этого используется уравнение D(y)x = Mr(х) / Mr(y).
Определение абсолютной и относительной массы вещества
Абсолютная и относительная масса атомов и молекул
Массу относят к фундаментальным характеристикам атома. Поскольку ее абсолютное значение очень мало, в химии вводится понятие относительной, т.е. условной, атомной массы.
Ничтожный размер атома не исключает наличия у него атомной массы. Вся масса атома сосредоточена в ядре (протон и нейтрон практически в 2000 раз тяжелее, чем электрон). В результате почти вся масса атома приходится на общую массу нейтронов и протонов. К примеру, атомная масса кислорода равняется 2,667·10-23 г. Это его абсолютная атомная масса. Работать с таким числом неудобно. Поэтому было предложено ввести еще одну величину – относительную атомную массу.
В начале XIX века Дж. Дальтон предложил, вычисляя атомную массу, использовать в качестве эталона массу атома водорода, поскольку он является самым легким элементом. Именно по отношению к нему выражались массы атомов прочих элементов.
Однако с учетом того, что на практике чаще использовались кислородные соединения для вычисления атомных масс многих элементов, в качестве эталона удобнее стало использовать атомную массу кислорода. При этом известно, что соотношение атомных масс кислорода и водорода равно 16:1. Так возникло понятие кислородной единицы – 1/16 части его атомной массы.
Таким образом, относительная атомная масса показывает, во сколько раз масса атома конкретного элемента больше массы атома, который принимается за единицу. Сегодня это 1/12 часть массы атома углерода. Это и есть атомная единица массы, которую иногда обозначают как «дальтон».
Относительная атомная масса – отношение массы атома определенного элемента к 1/12 массы атома изотопа углерода-12. По сути относительная атомная масса является безразмерной величиной (при ее расчете единицы измерения сокращаются), но иногда ее значение выражают в атомных единицах массы (а.е.м.).
Абсолютная масса атома углерода составляет 1,993·10-23 г, согласно Периодической таблице Д.И. Менделеева. Его относительная атомная масса равна 12. Следовательно, 1/12 часть массы атома углерода составляет:
Масса одного кислородного атома приблизительно в 16 раз превышает 1/12-ю массы углеродного атома 12С.
Чтобы вычислить относительную молекулярную массу вещества, нужно сложить суммы относительных атомных масс элементов, входящих в состав молекулы, с учетом индексов, которые показывают количество атомов элемента в молекуле. Абсолютная масса одной молекулы равна относительной, умноженной на одну атомную единицу массы (1 а.е.м.).
Относительная атомная масса химического элемента
Например, определение относительной массы атома водорода выглядит так:
Элемент кислород имеет следующую относительную атомную массу:
Из формул следует, что относительная атомная масса является величиной, равной отношению абсолютной атомной массы к единице массы u (или 1 а.е.м.).
Относительная молекулярная масса вещества
Если молекула состоит из атомов нескольких химических элементов, то ее относительная молекулярная масса равна сумме их относительных атомных масс с учетом индексов в формуле вещества.
Рассмотрим пример. Молекула воды имеет в своем составе два атома водорода и один – кислорода. Чтобы определить относительную молекулярную массу, нужно сложить произведения относительной атомной массы каждого элемента на соответствующее количество атомов:
Знание относительной молекулярной массы веществ в газообразном состоянии помогает в решении задач по сравнению их плотности. Для этого высчитывается относительная плотность газов друг по другу, которая равна соотношению их относительных молекулярных масс:
Поскольку закон Авогадро применим исключительно к газообразным веществам, а ученым-химикам часто необходимо знать, сколько молекул, атомов или ионов заключено в определенных порциях твердых веществ или жидкостей, введено понятие молярной массы. Ее значение численно равно относительной молекулярной массе.
Как вычислить абсолютную массу, формулы, примеры
Найти молекулярную массу серной кислоты, используя таблицу Менделеева.
Известно, что молекулярная масса вещества равна сумме атомных масс веществ, входящих в состав молекулы. Поэтому:
M r ( H 2 S O 4 ) = 1 · 2 + 32 + 16 · 4 = 98 г / м о л ь
Решение химических задач по нахождению абсолютной массы может сводиться к использованию следующих методов:
При этом молярную массу можно найти путем сложения атомных масс элементов, входящих в состав соединения. Молярная масса находится также как отношение массы вещества к его соответствующему количеству: