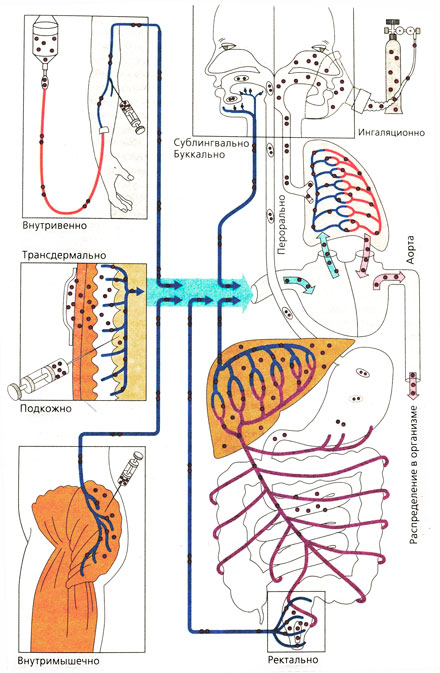
Что такое парентеральное введение лекарственных средств
Парентеральное введение лекарственных средств
Парентера́льное введение лекарственных средств — это такие пути введения лекарственных средств в организм, при которых они минуют желудочно-кишечный тракт, в отличие от перорального способа применения лекарств. Это прежде всего инъекции и ингаляции. Существуют и другие, более редкие, парентеральные способы введения: субарахноидальный, внутрикостный, интраназальный, субконъюктивальный, — однако они используются в немногих особых случаях.
Различают инъекции малого объёма (до 100 мл) и большого объема, которые называют инфузиями. [1]
Содержание
Преимущества парентерального способа введения
При парентеральном введении лекарственных средств
См. также
Литература
Примечания
Полезное
Смотреть что такое «Парентеральное введение лекарственных средств» в других словарях:
Пероральный приём лекарственных средств — Пероральный приём лекарственных средств приём лекарства через рот (лат. per os, oris), путём проглатывания лекарства. Содержание 1 Применение 2 Недостатки … Википедия
парентеральный способ введения лекарственных средств — Парентеральное введение (подкожное, внутримышечное, непосредственно в кровеносную или лимфатическую системы). [МУ 64 01 001 2002] Тематики производство лекарственных средств Обобщающие термины общие, специфические и прочие … Справочник технического переводчика
Инфузионный насос — производства Фрезениус (Fresenius). Инфузионный насос изделие медицинского назначения для вливания растворов, лекарственных препаратов, питательных веществ в пациента. Обычно инфузионные насосы применяются для в … Википедия
Лютеинизирующий гормон — β полипептид лютеинизирующего гормона Овуляторный всплеск ЛГ (зелёная линия) Обозначения … Википедия
ИНЪЕКЦИЯ — (от лат. injectio вбрасывание), парентеральное введение растворов или жидких лекарственных веществ с лечебной, диагностической или профилактической целями. Для И. используют инъекционные иглы, шприцы, аппарат Боброва и др. И. большого… … Ветеринарный энциклопедический словарь
Туберкулёз — I (tuberculosis; лат. tuberculum бугорок + ōsis) болезнь, вызываемая микобактериями туберкулеза. Наиболее часто поражаются органы дыхания (см. Туберкулез органов дыхания (Туберкулёз органов дыхания)), среди других органов и систем преимущественно … Медицинская энциклопедия
Роды — I Роды Роды (partus) физиологический процесс изгнания из матки плода, околоплодных вод и последа (плаценты, плодных оболочек, пуповины) после достижения плодом жизнеспособности. Жизнеспособным Плод, как правило, становится по истечении 28 нед.… … Медицинская энциклопедия
Способ введения — (путь заражения) в фармакологии, токсикологии и медицине путь введения лекарственного средства, жидкости, отравляющего вещества, инфекционного агента или другого вещества в организм.[1] Содержание 1 Классификация 1.1 … Википедия
Уход — I Уход за больными. Уход совокупность мероприятии, обеспечивающих всестороннее обслуживание больного, выполнение врачебных назначений, создание оптимальных условий и обстановки, способствующих благоприятному течению болезни, быстрейшему… … Медицинская энциклопедия
Тиамин (лекарственное средство) — См. также: Тиамин … Википедия
Парентеральный путь введения лекарств
Содержание
Парентеральное введение [ править | править код ]
Парентеральный дословно переводится как «минуя кишечник». Основные способы парентерального пути введения лекарственных средств — внутривенный, подкожный и внутримышечный. При п/к и в/м введении препараты всасываются путем простой диффузии по градиенту концентрации между местом введения и плазмой. Скорость диффузии зависит от площади диффузионной поверхности (эндотелий капилляров) и растворимости препарата в интерстициальной жидкости. Благодаря довольно крупным порам в мембране эндотелиальных клеток скорость диффузии не зависит от растворимости препарата в жирах. Более крупные молекулы (например, белки) поступают в системный кровоток медленнее, по лимфатическим сосудам.
При любом способе парентерального введения (за исключением внутриартериального) лекарственное средство, прежде чем достичь ткани-мишени, может элиминироваться легкими. Некоторые лекарственные средства (особенно слабые основания, которые в крови находятся преимущественно в неионизированной форме) накапливаются в легких благодаря своей высокой жирорастворимости. Кроме того, легкие задерживают введенные в/в твердые частицы и элиминируют летучие вещества.
Пути ведения лекарственных веществ и их распределение в организме
Внутривенное введение [ править | править код ]
При в/в введении препарат сразу и полностью поступает в системный кровоток. Это самый быстрый и точный способ введения лекарственных средств, позволяющий надежно регулировать их концентрацию. В некоторых случаях, например при вводной анестезии, дозу не определяют заранее, а подбирают в зависимости от реакции на препарат. Некоторые лекарственные средства, обладающие раздражающим действием, можно вводить только в/в, так как стенка сосудов менее чувствительна к ним. К тому же при медленном введении препарат успевает разбавиться кровью.
Наряду с достоинствами в/в введение имеет и свои недостатки. Быстрое повышение концентрации лекарственного средства в крови и ткани-мишени увеличивает риск побочных эффектов, поэтому препараты следует вводить медленно, тщательно наблюдая за больным. Если препарат введен по ошибке, исправить ее уже нельзя. Для многократного введения необходимо наладить надежный венозный доступ. В/в нельзя вводить масляные растворы и препараты, вызывающие осаждение растворенных в крови веществ или гемолиз.
Подкожное введение [ править | править код ]
Это распространенный способ введения лекарственных средств. Благодаря медленному, равномерному всасыванию обеспечивается длительный терапевтический эффект. Скорость всасывания можно регулировать, используя разные лекарственные формы (например, суспензия инсулина всасывается медленнее, чем раствор) или добавляя в раствор сосудосуживающие средства, замедляющие всасывание. Для введения некоторых гормональных средств успешно используют подкожные имплантаты, выделяющие препарат очень медленно, в течение нескольких недель или месяцев. П/к введение непригодно для лекарственных средств, которые обладают раздражающим действием и могут вызвать сильную боль и некроз тканей.
Внутримышечное введение [ править | править код ]
Водорастворимые лекарственные средства всасываются при в/м введении достаточно быстро. Скорость всасывания зависит от интенсивности кровотока в месте инъекции. Согревание и массаж в месте инъекции, а также физические упражнения усиливают всасывание. Так, если инсулин вводят в бедро, а не в плечо, бег может вызывать резкое падение уровня глюкозы плазмы за счет значительного увеличения кровотока в ногах. При инъекции в латеральную широкую мышцу бедра и дельтовидную мышцу водорастворимые препараты, как правило, всасываются быстрее, чем при инъекции в большую ягодичную мышцу. У женщин эта разница еще заметнее, так как у них более выражена подкожная клетчатка, которая довольно плохо кровоснабжается. При тяжелом ожирении и истощении скорость всасывания лекарственных средств после в/м и п/к введения меняется. Масляные растворы и другие препараты длительного действия для в/м введения (например, некоторые антибиотики) всасываются очень медленно и равномерно. Лекарственные средства, которые из-за раздражающего действия нельзя вводить п/к, зачастую пригодны для в/м введения.
Внутриартериальное введение [ править | править код ]
Этот способ используют в тех случаях, когда необходимо обеспечить высокую концентрацию лекарственного средства только в определенной ткани или органе (например, при лечении злокачественных новообразовании печени, головы и шеи). Иногда внутриартериально вводят рентгеноконтрастные средства. При внутриартериальном введении нужно соблюдать особую осторожность, а выполнять его должен опытный специалист. При внутриартериальном введении лекарственное средство попадает в системный кровоток, минуя легкие.
Интратекальное введение [ править | править код ]
Многие лекарственные средства медленно проникают через гематоэнцефалический барьер или вовсе не проходят через него. Поэтому в тех случаях, когда необходимо обеспечить быстрое воздействие на ЦНС (например, при спинномозговой анестезии, острых инфекциях ЦНС), препарат вводят непосредственно в субарахноидальное пространство спинного мозга. При опухолях головного мозга лекарственные вещества можно вводить в желудочки мозга.
Технология «все в одном» в практике парентерального питания
Новые возможности применения жировых эмульсий в практической хирургии открыло появление концепции парентерального питания «все в одном». Технология «все в одном» была впервые разработана С.Solasson с соавторами еще в 1974 году. Основной идеей создания системы «все в одном» являлось стремление к стандартизации парентерального питания с целью достижения максимального клинического эффекта и минимизации возможных осложнений, особенно у больных в критических состояниях с синдромом гиперметаболизма. Использование двух и трех компонентных мешков для парентерального питания, где уже подобраны необходимые количества и метаболически верные соотношения аминокислот, глюкозы, липидов и электролитов показало целый ряд принципиальных преимуществ перед использованием изолированной инфузии макронутриентов: высокая технологичность, удобство и простота применения, одновременное и безопасное введение всех необходимых нутриентов; оптимально сбалансированный состав макронутриентов; снижение риска инфекционных осложнений; возможность добавлять необходимые микронутриенты (витамины/микроэлементы). При использовании технологии «все в одном» врачу не нужно специально рассчитывать соотношение вводимых аминокислот и энергии и соотношение глюкозы и жиров. Технические преимущества использования систем «все в одном» состоят в том, что для одного пациента используется всего один контейнер, одна инфузионная система и один инфузионный насос. Принципиально важно, что система «все в одном» гарантирует стабильную скорость введения нутриентов, снижает риск ошибок, в том числе связанных с неправильными манипуляциями, препятствует дополнительной микроьной контаминации и значительно снижает нагрузку на медицинский персонал больницы. Мультицентровые исследования, посвященные оценке риска инфицирования и фармакоэкономической эффективности парентерального питания с применением системы «три в одном» по сравнению с традиционной модульной (флаконной) методикой доказали снижение риска контаминации на 50–60% и уменьшение стоимости парентерального питания на 12–23 % (К. Achach et al., 2002). Именно данные обстоятельства сделали парентеральное питание для пациентов хирургических отделений не «теоретически возможным», а практически осуществимым.
Следует заметить, что необходимость и потенциальные преимущества совместного и одновременного введения основных нутриетнов стали очевидными для клиницистов достаточно давно. Исторически промышленному производству двух- и трехсекционных мешков системы «все в одном» предшествовал в своем роде кустарный способ комплексного введения препаратов парентерального питания, при котором все необходимые в течение суток питательные вещества смешивали в одном пластиковом мешке в аптеке больницы непосредственно перед началом парентерального питания. Очевидная трудоемкость и ответственность приготовления подобных инфузионных сред определялась необходимостью привлечения опытных и хорошо обученных провизоров, а также выделения специально оборудованных помещений в аптеке для соблюдения строгой асептики, что, естественно, ограничивало применение метода в клинической практике. За последние десятилетия компании-производители препаратов для парентерального питания, используя новейшие биохимические технологии, освоили промышленное производство двух- и трехсекционных пластиковых мешков, содержащих макро- и микронутриенты в различных комбинациях.
В настоящее время реализация программы нутритивной поддержки «все в одном» принципиально возможна в двух вариантах: системы «два в одном», содержащие раствор аминокислот с электролитами и раствор глюкозы, и системы «три в одном», содержащие раствор аминокислот с электролитами, раствор глюкозы и жировую эмульсию.
Нутрифлекс содержит в своем составе изолейцин, лейцин, лизина гидрохлорид, метионин, фенилаланин, треонин, триптофан, валин, аргинина моноглютамат, гистидина гидрохлорида моногидрат, аланин, аспарагиновая кислота, глютаминовая кислота, глицин, пролин, серин, магния ацетата тетрагидрат, натрия ацетата тригидрат, натрия дигидрофосфата дигидрат, калия дигидрофосфат, калия гидроксид, натрия гидроксид, глюкозы моногидрат, натрия хлорид, кальция хлорида дигидрат, электролиты: натрий, калий, кальций, магний, хлорид, фосфат, ацетат; азот.
Нутрифлекс липид 40/80 предназначен для введения в периферические вены. Полноценное содержание белков в стандартном объеме жидкости. Минимальный риск гипергликемии. 1 литр Нутрифлекс липид 40/80 содержит: аминокислоты 40 г, углеводы 80 г, липиды 50 г. Общая калорийность 955 (4000) ккал (кДж); небелковая калорийность 795 (3330) ккал (кДж); калорийность жиров 475 (1990) ккал (кДж); калорийность углеводов 320 (1340) ккал (кДж); осмолярность 840 мОсм/л.
Нутрифлекс липид 48/150 предназначен для введеня в центральные вены. Повышенное содержание энергии и белка в стандартном объеме жидкости. 1 литр Нутрифлекс липид 48/150 содержит: аминокислоты 48 г, углеводы 150 г, липиды 50 г. Общая калорийность 1265 (5300) ккал (кДж); небелковая калорийность 1075 (4500) ккал (кДж); калорийность жиров 475 (1990) ккал (кДж); калорийность углеводов 600 (2510) ккал (кДж); осмолярность 1215 мОсм/л.
Нутрифлекс липид 70/180 предназначен для введения в центральные вены. Повышенное содержание энергии и белка в ограниченном объеме жидкости. 1 литр Нутрифлекс липид 70/180 содержит: аминокислоты 71,8 г, углеводы 180 г, липиды 50 г. Общая калорийность 1475 (6176) ккал (кДж); небелковая калорийность 1195 (5005) ккал (кДж); калорийность жиров 475 (1990) ккал (кДж); калорийность углеводов 720 (3015) ккал (кДж); осмолярность 1545 мОсм/л.
Как нетрудно заметить аминокислотный и электролитный состав Нутрифлекс-липид аналогичен таковому в препарате Нутрифлекс. К очевидным преимуществам проведения парентерального питания препаратом Нутрифлекс-липид следует отнести:
— высокую безопасность, надежность и удобство в применении;
— возможность индивидуального подхода обеспечивается различными вариантами мешков;
— оптимальную концентрацию аминокислот, позволяющую ввести достаточное количество белка без риска перекармливания;
— сбалансированное содержание глюкозы, предупреждающее развитие гипергликемии у пациента;
— быстрое, безопасное и полное усвоение жиров, благодаря наличию Липофундина МСТ/ЛСТ;
— активацию репаративных процессов (в том числе заживления ран), благодаря цинку, который содержится в физиологической концентрации;
— удовлетворение основной потребности пациента в электролитах без дополнительных инфузий солевых растворов.
Характеристика зарегистрированных в России двух (Нутрифлекс) и трехкамерных (Нутрифлекс Липид) контейнеров для парентерального питания.
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.