Что такое пассивная диффузия
Активный и пассивный транспорт через мембрану
Ты уже шаришь какое строение у биологических мембран, так что можно переходить к тому, как вся эта система работает. И начнем мы с транспорта веществ через мембрану. Довольно важная тема, без нее мы не поймем, как формируется потенциал действия, как в клетку попадают энергетические субстраты и вода. Так что присаживаемся поудобнее и поехали!
Виды транспорта через мембрану
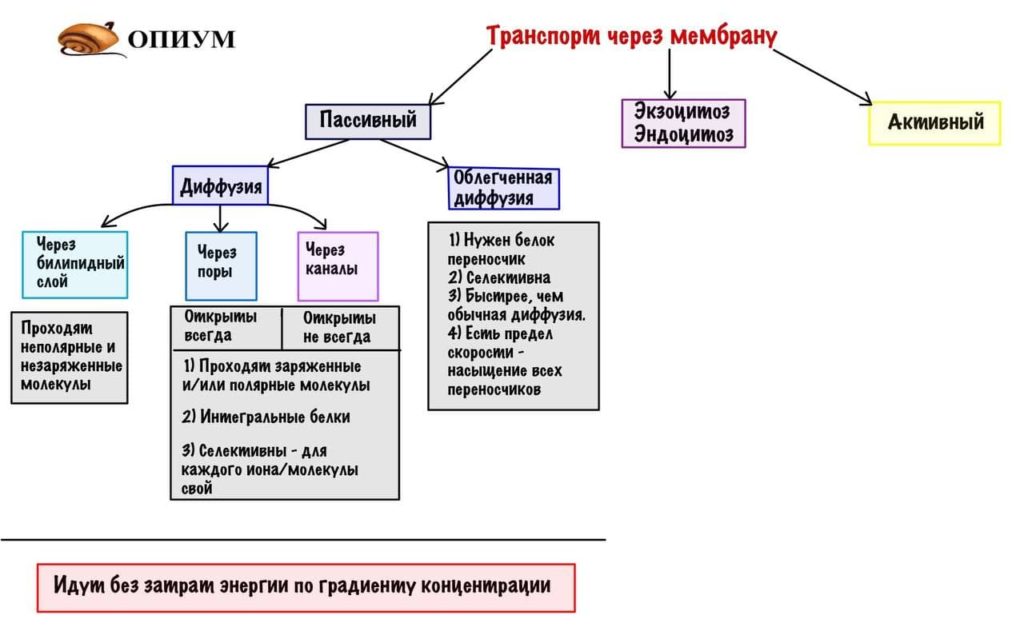
Начнем с небольшой классификации. Транспорт можно разделить на пассивный и активный (никаких шуток про геев мне тут), такое разделение основано на затратах энергии. При пассивном транспорте — затрат энергии нет, а при активном транспорте — есть. Это может быть энергия заключенная в АТФ, либо энергия градиента концентрации. Не пугаемся, дальше все будем разбирать подробнее. Еще есть особенный транспорт — экзоцитоз и эндоцитоз (транспортируются макромолекулы), их скорее можно отнести к активному транспорту, но мы рассмотрим их отдельно.
Пассивный транспорт через мембрану
Здесь всего два вида — простая диффузия и облегченная диффузия. В чем отличие? При облегченной диффузии для молекулы, которая будет проходить через мембрану нужен проводник — белок переносчик. Для простой диффузии же переносчик не требуется, она и сама справляется.
Диффузия
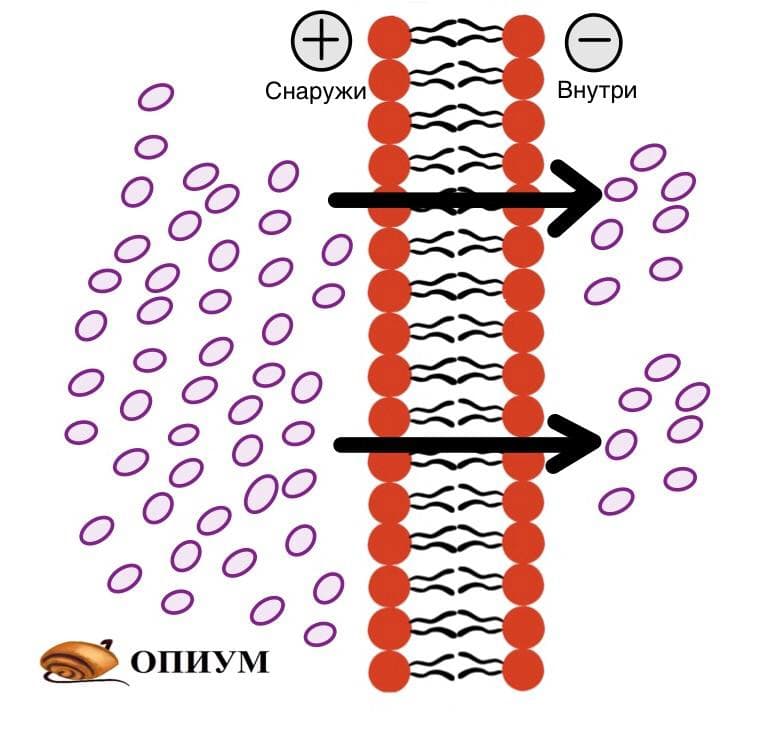
Она идет по градиенту концентрации — если на одной стороне мембраны вещества много, то оно будет стремиться перейти на другую сторону. На самом деле диффузия зависит не только от градиента концентрации — еще на нее влияет заряд мембраны и частиц, которые пытаются пройти через мембрану, и давление.
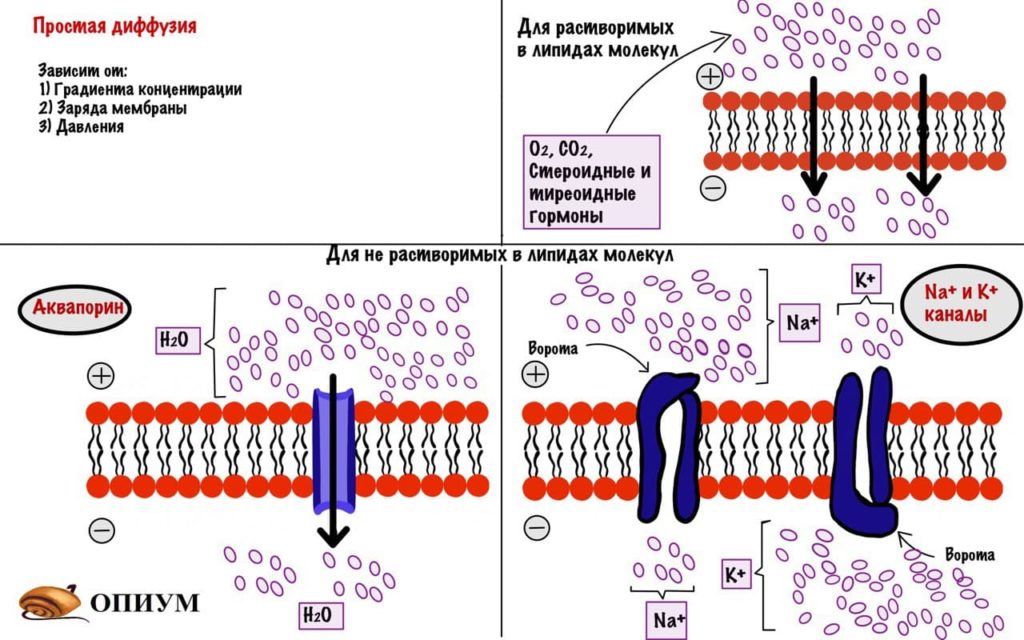
Вспоминаем, что основа мембраны — это амфифильные липиды. Если вещество растворимо в липидах, то оно без проблем перейдет на другую сторону. Лучше всего растворимы в липидах неполярные и незаряженные молекулы (CO2,O2, стероидные гормоны). Но через мембрану могут проходить полярные молекулы и незаряженные (тонированные), но здесь все решает размер. Вода пройдет через мембрану, а вот глюкоза — нет. Вода хоть и проходит через мембрану, но хуже чем неполярные и незаряженные молекулы, поэтому для нее есть специальные поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония.
А вот совсем не могут пройти заряженные и полярные молекулы — ионы натрия, калия, гидроксония. Поэтому простую диффузию разделим еще на два варианта:
1) Диффузия жирорастворимых веществ. Молекула растворима в мембране, то есть она неполярная и незаряженная. Она спокойно проходит через мембрану. Избранные молекулы проходят так — O2, CO2, стероидные и тиреоидные гормоны.
Отличие каналов и пор
Отличие каналов и пор в том, что первые открыты не всегда, а вторые постоянно. У натриевых и калиевых каналов есть шляпка (или ворота), которая открывается двумя способами — в зависимости от типа клетки. Первый способ — изменение электрического заряда мембраны (или ее потенциала). Потеря отрицательного заряда клеткой ведет к открытию натриевых каналов — это важно для потенциала действия. Второй способ — действие химического вещества. Есть ацетилхолиновые каналы, которые открываются под действием(угадайте сами чего)… Так нервные клетки передают сигнал о сокращении мышцам.
Представьте два входа в клуб и один отдельный выход из него. Перед каждым входом стоит фейсер, но в первом нет двери — там просто дверной проем, а у второго и третьего дверь есть и для нее нужен ключик. Первый вход — это пора, молекула воды подходит к нему и фейсер пропускает ее, но иногда в толпе воды может затеряться другая молекула, например, мочевина. Фейсер по ошибке пропускает ее, ну а что — за всеми не углядишь, и она попадает внутрь клетки. Ко второму входу подходит ион натрия, фейсер его пропускает, но войти он не может пока дверь не откроют ключом — изменением потенциала или ацетилхолином. У выхода из клуба тоже стоит фейсер, вот такой вот странный клуб, к нему подходит ион калия и ждет пока дверь откроется таким же ключом. Фейсеры — это часть канала или поры, которая отвечает за узнавание ионов и молекул, а дверь или проем — это сам канал. Ну вы поняли.
Почему клеткам просто не забить: убрать фейсеров и держать двери постоянно открытыми? Смотрите — внутри клетки много калия, но мало натрия. В межклеточном веществе наоборот, очень много натрия и мало калия. А это значит, что калий стремится сбежать из клетки, а натрий войти в клетку.
Во-первых, такая разница ионов создает заряд внутри клетки — отрицательный, если бы каналы были постоянно открыты, то такой разницы бы не существовало, клетка стала бы незаряженной. Что не очень хорошо, так как она не сможет создать потенциал действия. Во-вторых, натрий это любимчик воды и если в клетке его будет много, то будет много и воды. Клетка просто лопнет от такой тусовки.
Облегченная диффузия
Здесь молекуле, которая идет тоже по градиенту концентрации, необходим переносчик. Все это из-за того, что молекула слишком большая для перехода через мембрану самостоятельно. Переносчик — это интегральный белок, который пронизывает мембрану, у него тоже есть фейсер (только здесь это участок связывания). При взаимодействии молекулы с переносчиком — он изменяет свою структуру (конформационные изменения белка) и переносит молекулу в клетку, а затем возвращается обратно.
Такой механизм характерен для переносчиков глюкозы — ГЛЮТов в жировой и мышечной ткани. Однако ГЛЮТы не всегда находятся на поверхности клетки, а только после еды — повышенный уровень глюкозы в крови вызывает секрецию инсулина из Б-клеток островков Лангерганса. Инсулин действует на жировую и мышечную ткань и взывает к ГЛЮТам, которые встраиваются в мембрану. Ой, как-то на автомате получилось. Еще таким способом транспортируются аминокислоты.
Смотрите, еще один прикол. Эти переносчики могут работать в обе стороны, все зависит от градиента концентрации глюкозы. Если ее будет слишком много в клетке, то они могут выкидывать ее в кровь. Прикольненько?
Если интересно, что быстрее: диффузия или облегченная диффузия, то вот график. Видим, что вначале быстрее облегченная диффузия, а потом обычная. Почему? Просто белки могут связать только одну молекулу, когда молекул глюкозы становится очень много, то все переносчики связаны с ней. Наступает насыщение переносчиков, и они не могут быстрее работать. Диффузия же не зависит от переносчиков, но она немного медленнее.
Пассивный транспорт все, поэтому давайте суммируем все и добавим в нашу начальную схему.
Активный транспорт
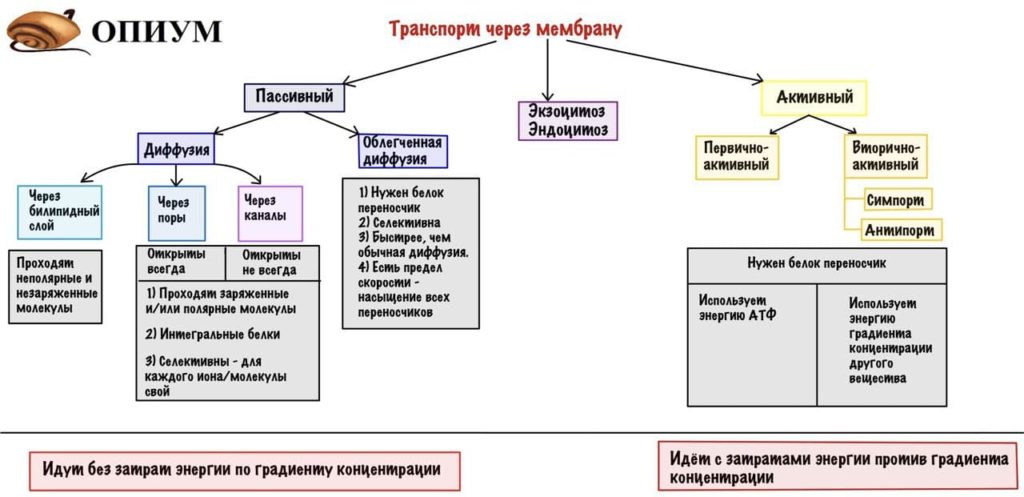
Здесь для переноса вещества через мембрану необходимо приложить энергию. Но зачем, а главное почему? Потому что такой транспорт идет против градиента концентрации, а без прикладывания энергии молекулу или ион просто не вытолкнуть. Разделяется на два варианта: первично-активный транспорт и вторично-активный транспорт, отличие между ними поймете чуть ниже.
Первично-активный транспорт
Здесь для того, чтобы перенести молекулы/ионы вещества на другую сторону мембраны используется энергия молекул АТФ. Классический вариант — натрий-калиевый насос. Этот насос представляет из себя белок, а именно фермент — АТФазу (помните, что «не все белки — ферменты, но все ферменты — белки» — десятая заповедь от кафедры биохимии). Занимается тем, что переносит ионы натрия из клетки, а ионы калия внутрь клетки. То есть работает против градиента концентрации, ведь натрия очень много вне клетки, а калия наоборот мало.
У насоса есть участки связывания — два для калия и три для натрия. Состоит из двух субъединиц — альфа и бета, альфа это и есть переносчик, а бета похоже якорит его в мембране. На один цикл: переноса трех ионов натрия из клетки и двух ионов калия внутрь клетки, требуется одна молекула АТФ. Как видим, этот насос создает разницу потенциалов, так как в обмен на три заряженных иона внутрь клетки поступает только два — этому пареньку мы обязаны за отрицательный заряд внутри клетки. Действует такой насос во всех клетках, он не дает клетке лопнуть из-за избытка натрия (вспоминаем про воду).
Кроме такого насоса есть еще несколько — Ca ++ и H + — АТФазы. Избыток кальция вредит клетке, так как он может запустить апоптоз. Водородный насос действует в париетальных клетках желудка и дистальном отделе канальца нефрона — в первом случае он создает кислую среду в желудке для функционирования пепсина. Да и вообще, из внешней среды поступает много всякой заразы, которой неприятно встречаться с кислотой. Во втором случае насос перемещает ионы водорода в просвет канальца. Полезная штука, а то прикинь — позанимался спортом и умер от ацидоза, не круто.
Вторично-активный транспорт
Тут одна молекула идет по градиенту концентрации и энергия, которая создается ей, используется для переноса другой молекулы. Представляете, сколько всего ионов натрия во внеклеточной жидкости? Вот и я не представляю, но очень много, а в клетке же наоборот его очень мало. Такая разница создает просто огромную энергию, которая идет на работу белка переносчика. Этот белок переносчик, как вы уже поняли — интегральный белок и имеет два участка связывания. Эти участки могут находиться на одной стороне белка или на разных. Поэтому такой транспорт можно разделить на два варианта:
1) Молекула, которая идет против градиента концентрации, переносится в одну сторону с молекулой, которая идет по градиенту концентрации. Это называется котранспорт (или симпорт). Так переносятся молекулы глюкозы и аминокислот из кишечника и канальцев нефрона. Натрий идет по градиенту концентрации внутрь клетки и захватывает с собой глюкозу или аминокислоты. Тут ты можешь сказать : «Чет странно, ведь в кишке много глюкозы после еды, почему она идет против градиента?». И да, это верно, в кишечнике много глюкозы. Но клеток очень много, а глюкоза растянута по всей поверхности кишки. Вот и получается, что в кишке ее много, но возле каждой клетки маловато. Такая же тема с аминокислотами.
2) Молекула идет против градиента концентрации, но не в одну сторону с переносимым по градиенту концентрации веществом — контртранспорт (или антипорт). Так происходит транспорт ионов водорода в проксимальных канальцах нефрона: водород попадает в просвет канальца, а натрий внутрь клетки.
Ну что сведем все это опять в нашу табличку?
Все что мы разбирали до этого относится к небольшим по размерам молекулам, а что делать с большими? Для этого есть две легенды, о которых ниже.
Экзоцитоз и эндоцитоз
Начнем с экзоцитоза и сделаем это на каком-нибудь примере. Пусть это будут пищеварительные ферменты в поджелудочной железе. Синтезировала значит клетка липазу, но она ведь внутри клетки — это значит проку от нее мало. Нужно ее как-то переместить в проток поджелудочной железы, хорошо было бы использовать белок переносчик. А тут проблемка. Липаза слишком большая — ее не засунуть в белок переносчик. Но ничего — у клетки есть выход.
Все ферменты, белки плазмы, пептидные гормоны и так далее, синтезируются в упаковке — пузырьке (по строению он амфифильный). Оно и правильно, представьте — липаза попадает в цитоплазму клетки и просто переваривает ее. Эти пузырьки направляются к мембране, сливаются с ней и попадают в кровь, межклеточное вещество или проток поджелудочной железы. В общем куда им надо, туда они и попадают.
Теперь эндоцитоз. Все тоже самое только наоборот — это мое лучшее объяснение… Ладно, шутки кончились. На клеточной мембране есть определенный участок с рецепторами — окаймленная ямка. На рецепторах накапливаются макромолекулы, а потом ямка погружается в клетку и охватывает их, образуя пузырек. Этот пузырек направляется к лизосоме, где из него образуются мономеры. Эти мономеры клетка использует по своему усмотрению. Посмотрите картинку и все поймете, базарю.
Таким способом идет фагоцитоз лейкоцитами, а еще так в клетку попадают липопротеиды низкой плотности — это переносчики холестерина и жирных кислот.
Транспорт через несколько слоев клеток
Буквально пару слов. Разберем на примере кишки — там несколько слоев (три, ну ладно — четыре, если с подслизистой). Через все должна пройти глюкоза, но как? Это похоже на эстафету: сначала из кишечника вторично-активным транспортом глюкоза попадает в клетку, потом в следующую клетку уже по облегченной диффузии. Так она доходит до крови, а дальше уже идет по своим делам. Всё!
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.
Фармакокинетика. Всасывание, распределение, выведение ЛП
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Фармакокинетика
Глава 1. Фармакокинетика (Т.А. Зацепилова, Д.А. Еникеева)
Фармакокинетические процессы — всасывание, распределение, депонирование, биотрансформация и выведение – связаны с проникновением ЛВ через биологические мембраны (в основном через цитоплазматические мембраны клеток). Существуют следующие способы проникновения веществ через биологические мембраны: пассивная диффузия, фильтрация, активный транспорт, облегченная диффузия, пиноцитоз (рис. 1.1).
Если ЛВ являются слабыми электролитами – слабыми кислотами или слабыми основаниями, то проникновение таких веществ через мембраны зависит от степени их ионизации, так как путем пассивной диффузии через двойной липид-ный слой мембраны легко проходят только неионизированные (незаряженные) молекулы вещества.
Степень ионизации слабых кислот и слабых оснований определяется:
Слабые кислоты в большей степени ионизированы в щелочной среде, а слабые основания — в кислой.
Ионизация слабых кислот
НА = Н + + А- щелочная среда
Ионизация слабых оснований
ВН + = В + Н + Кислая среда
Константа ионизации характеризует способность вещества к ионизации при определенном значении рН среды. На практике для характеристики способности веществ к ионизации используют показатель рКа, который является отрицательным логарифмом Ka(-lg Ka). Показатель рКа численно равен значению рН среды, при котором ионизирована половина молекул данного вещества. Значения рКа слабых кислот, так же как и слабых оснований, варьируют в широких пределах. Чем меньше рКа слабой кислоты, тем легче она ионизируется даже при относительно низких значениях рН среды. Так, ацетилсалициловая кислота (рКа= 3,5) при рН 4,5 ионизирована более чем на 90%, в то же время степень ионизации аскорбиновой кислоты (рКа=11,5) при том же значении рН составляет доли % (рис. 1.2). Для слабых оснований существует обратная зависимость. Чем выше рКа слабого основания, тем в большей степени оно ионизировано даже при относительно высоких значениях рН среды.
Степень ионизации слабой кислоты или слабого основания можно рассчитать по формуле Гендерсона-Гассельбальха:
Эта формула позволяет определить, какова будет степень проникновения ЛВ (слабых кислот или слабых оснований) через мембраны, разделяющие среды организма с различными значениями рН, например при всасывании Л В из желудка (рН 2) в плазму крови (рН 7,4).
Пассивная диффузия гидрофильных полярных веществ возможна через водные поры (см. рис. 1.1). Это белковые молекулы в мембране клеток, проницаемые для воды и растворенных в ней веществ. Однако диаметр водных пор невелик (порядка 0,4 нм) и через них могут проникать только небольшие гидрофильные молекулы (например, мочевина). Большинство гидрофильных лекарственных веществ, диаметр молекул которых составляет более 1 нм, через водные поры в мембране клеток не проходят. Поэтому большинство гидрофильных лекарственных веществ не проникают внутрь клеток.
Фильтрация — этот термин используют как по отношению к проникновению гидрофильных веществ через водные поры в мембране клеток, так и по отношению к их проникновению через межклеточные промежутки. Фильтрация гидрофильных веществ через межклеточные промежутки происходит под гидростатическим или осмотическим давлением. Этот процесс имеет существенное значение для всасывания, распределения и выведения гидрофильных Л В и зависит от величины межклеточных промежутков.
Так как межклеточные промежутки в различных тканях не одинаковы по величине, гидрофильные ЛВ при различных путях введения всасываются в неодинаковой степени и распределяются в организме неравномерно. Например, промежутки между эпителиальными клетками слизистой оболочки кишечника невелики, что затрудняет всасывание гидрофильных ЛВ из кишечника в кровь.
Промежутки между эндотелиальными клетками сосудов периферических тканей (скелетных мышц, подкожной клетчатки, внутренних органов) имеют достаточно большие размеры (порядка 2 нм) и пропускают большинство гидрофильных ЛВ, что обеспечивает достаточно быстрое проникновение ЛВ из тканей в кровь и из крови в ткани. В то же время в эндотелии сосудов мозга межклеточные промежутки отсутствуют. Эндотелиальные клетки плотно прилегают к друг другу, образуя барьер (гематоэнцефалический барьер), препятствующий проникновению гидрофильных полярных веществ из крови в мозг (рис. 1.3).
Активный транспорт осуществляется с помощью специальных транспортных систем. Обычно это белковые молекулы, которые пронизывают мембрану клетки (см. рис. 1.1). Вещество связывается с белком-переносчиком с наружной стороны мембраны. Под влиянием энергии АТФ происходит изменение конформации белковой молекулы, что приводит к уменьшению силы связывания между переносчиком и транспортируемым веществом и высвобождению вещества с внутренней стороны мембраны. Таким образом в клетку могут проникать некоторые гидрофильные полярные вещества.
Активный транспорт веществ через мембрану обладает следующими характеристиками:
Активный транспорт участвует в переносе через клеточные мембраны таких веществ, необходимых для жизнедеятельности клеток, как аминокислоты, сахара, пиримидиновые и пуриновые основания, железо, витамины. Некоторые гидрофильные лекарственные вещества проникают через клеточные мембраны с помощью активного транспорта. Эти Л В связываются с теми же транспортными системами, которые осуществляют перенос через мембраны вышеперечисленных соединений.
Облегченная диффузия — перенос веществ через мембраны с помощью транспортных систем, который осуществляется по градиенту концентрации и не требует затраты энергии. Так же, как активный транспорт, облегченная диффузия — это специфичный по отношению к определенным веществам и насыщаемый процесс. Этот транспорт облегчает поступление в клетку гидрофильных полярных веществ. Таким образом через мембрану клеток может транспортироваться глюкоза.
Кроме белков-переносчиков, которые осуществляют трансмембранный перенос веществ внутрь клетки, в мембранах многих клеток есть транспортные белки — Р-гликопротеины, способствующие удалению из клеток чужеродных соединений. Р-гликопротеиновый насос обнаружен в эпителиальных клетках кишечника, в эндотелиальных клетках сосудов мозга, образующих гематоэнцефалический барьер, в плаценте, печени, почках и других тканях. Эти транспортные белки препятствуют всасыванию некоторых веществ, их проникновению через гистогема-тические барьеры, влияют на выведение веществ из организма.
Пиноцитоз (от греч. pino — пью). Крупные молекулы или агрегаты молекул соприкасаются с наружной поверхностью мембраны и окружаются ею с образованием пузырька (вакуоли), который отделяется от мембраны и погружается внутрь клетки. Далее содержимое пузырька может высвобождаться внутри клетки или с другой стороны клетки наружу путем экзоцитоза.
РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
После поступления в системный кровоток ЛВ распределяются в различные органы и ткани. Характер распределения ЛВ во многом определяется их способностью растворяться в воде или липидах (т.е. их относительной гидрофильноетью или липофильностью), а также интенсивностью регионарного кровотока.
Гидрофильные полярные вещества распределяются в организме неравномерно. Большинство гидрофильных ЛВ не проникают в клетки и распределяются в основном в плазме крови и интерстициальной жидкости. В интерстициальную жидкость они попадают через межклеточные промежутки в эндотелии сосудов. В эндотелии капилляров мозга межклеточные промежутки отсутствуют – эндотелиальные клетки плотно прилегают друг к другу (между клетками имеются так называемые плотные контакты). Такой непрерывный слой эндотелиальных клеток образует гематоэнцефалический барьер (ГЭБ), препятствующий распределению гидрофильных полярных веществ (в том числе ионизированных молекул) в ткани мозга (см. рис. 1.3). Определенную барьерную функцию выполняют, по-видимому, и клетки глии. Через этот барьер немногие гидрофильные ЛВ (например, леводопа) проникают только с помощью активного транспорта.
Однако есть участки мозга, не защищенные гематоэнцефалическим барьером. Триггерная зона рвотного центра доступна для действия веществ, не проникающих через ГЭБ, таких как антагонист дофаминовых рецепторов домперидон. Это позволяет использовать домперидон в качестве противорвотного средства, не оказывающего влияния на другие структуры мозга. Кроме того, при воспалении мозговых оболочек гематоэнцефалический барьер становится более проницаемым для гидрофильных Л В (это позволяет вводить внутривенно натриевую соль бен-зилпенициллина для лечения бактериального менингита).
Кроме ГЭБ, в организме есть другие гистогематические барьеры (т.е. барьеры, отделяющие кровь от тканей), которые являются препятствием для распределения гидрофильных Л В. К ним относятся гематоофтальмический барьер, не пропускающий гидрофильные полярные Л В в ткани глаза, гематотестику-лярный и плацентарный барьеры. Плацентарный барьер во время беременности препятствует проникновению некоторых гидрофильных полярных ЛВ из организма матери в организм плода.
Относительно равномерно распределяются в организме липофильные неполярные вещества. Они проникают путем пассивной диффузии через мембраны клеток и распределяются как во внеклеточной, так и во внутриклеточной жидкостях организма. Липофильные ЛВ проходят через все гистогематические барьеры, в частности, диффундируют непосредственно через мембраны эндотелиаль-ных клеток капилляров в ткани мозга. Липофильные Л В легко проходят через плацентарный барьер. Многие лекарственные средства могут оказывать нежелательное действие на плод и поэтому прием препаратов беременными женщинами должен находиться под строгим врачебным контролем.
Влияние на распределение ЛВ оказывает также интенсивность кровоснабжения органов и тканей. Лекарственные вещества распределяются быстрее в хорошо перфузируемые органы, т.е. органы с интенсивным кровоснабжением, такие как сердце, печень, почки и достаточно медленно — в ткани с относительно плохим кровоснабжением – подкожную клетчатку, жировую и костную ткань.
ДЕПОНИРОВАНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
г При распределении в организме некоторые Л В частично могут задерживаться и накапливаться в различных тканях. Происходит это в основном вследствие обратимого связывания ЛВ с белками, фосфолипидами и нуклеопротеинами клеток. Этот процесс носит название депонирование. Концентрация вещества в месте его депонирования (в депо) может быть достаточно высокой. Из депо вещество постепенно высвобождается в кровь и распределяется по другим органам и тканям, в том числе достигая места своего действия. Депонирование может привести к удлинению (пролонгированию) действия препарата или возникновению эффекта последействия. Так происходит при введении средства для внутривенного наркоза, — тиопентала-натрия, высоколипофильного соединения, которое накапливается в жировой ткани. Препарат вызывает непродолжительный наркоз (порядка 15 мин), после прекращения которого наступает посленаркозный сон (в течение 2-3 ч), связанный с высвобождением тиопентала из депо.
Депонирование ЛВ в некоторых тканях может привести к развитию побочных эффектов. Например, тетрациклины связываются с кальцием и накапливаются в костной ткани. При этом они могут нарушать развитие скелета у маленьких детей. По этой же причине эти препараты не должны назначаться беременным женщинам.
Многие Л В связываются с белками плазмы крови. Слабокислые соединения (нестероидные противовоспалительные средства, сульфаниламиды) связываются в основном с альбуминами (самой большой фракцией белков плазмы), а слабые основания – с α1-кислым гликопротеином и некоторыми другими белками плазмы крови. Связывание ЛВ с плазменными белками – обратимый процесс, который может быть представлен следующим образом:
ЛВ + белок комплекс ЛВ-белок.
Комплексы вещество — белок не проникают через мембраны клеток и через межклеточные промежутки в эндотелии сосудов (не фильтруются они и в капиллярах почечных клубочков) и поэтому являются своеобразным резервуаром или депо данного вещества в крови.
Связанное с белками ЛВ не проявляет фармакологической активности. Но поскольку это связывание обратимо, часть вещества постоянно высвобождается из комплекса с белком (происходит это при снижении концентрации свободного вещества в плазме крови) и оказывает фармакологическое действие.
Связывание Л В с белками плазмы крови не является специфичным. Разные ЛВ могут связываться с одними и теми же белками с достаточно высоким аффинитетом, при этом они конкурируют за места связывания на белковых молекулах и могут вытеснять друг друга. При этом большое значение имеет степень связывания веществ с белками при их терапевтических концентрациях в крови. Так, например, толбутамид (гипогликемическое средство, применяемое при сахарном диабете) приблизительно на 96% связывается с белками плазмы крови (при этом в свободном, а, следовательно, в активном состоянии в крови находится только около 5% вещества). При одновременном назначении сульфаниламидов, которые в терапевтических концентрациях связываются со значительной фракцией белков плазмы крови, происходит быстрое вытеснение толбутамида из мест связывания. Это приводит к повышению концентрации свободного толбутамида tfc крови. Результатом, как правило, является чрезмерное гипогликемическое действие препарата, а также более быстрое прекращение его эффекта, так как одновременно ускоряется биотрансформация и выведение из организма несвязанного с белками вещества. Особую опасность представляет одновременное назначение сульфаниламидов и антикоагулянта варфарина, который связывается с белками плазмы крови на 99%. Быстрое повышение концентрации свободного варфарина (препарата с малой широтой терапевтического действия) приводит к резкому снижению свертываемости крови и кровотечениям.
ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ИЗ ОРГАНИЗМА
Лекарственные вещества и их метаболиты выводятся (экскретируются) из организма в основном с мочой (почечная экскреция), а также с желчью в просвет кишечника.
Почечная экскреция. Выведение лекарственных веществ и их метаболитов почками происходит с участием трех основных процессов: клубочковой фильтрации, активной секреции в проксимальных канальцах и канальцевой реабсорбции.
Клубочковая фильтрация. Лекарственные вещества, растворенные в плазме крови (за исключением веществ, связанных с плазменными белками и высокомолекулярных соединений), фильтруются под гидростатическим давлением через межклеточные промежутки в эндотелии капилляров почечных клубочков и попадают в просвет канальцев. Если эти вещества не реабсорбируются в почечных канальцах, они выводятся с мочой.
Активная секреция. Путем активной секреции в просвет канальцев выделяется большая часть веществ, экскретируемых почками. Вещества секретируются в проксимальных канальцах с помощью специальных транспортных систем против градиента концентрации (этот процесс требует затраты энергии). Существуют отдельные транспортные системы для органических кислот (пенициллины, салицилаты, сульфаниламиды, тиазидные диуретики, фуросемид и др.) и органических оснований (морфин, хинин, дофамин, серотонин, амилорид и ряд других веществ). В процессе выделения органические кислоты (также как органические основания) могут конкурентно вытеснять друг друга из связи с транспортными белками, вследствие чего экскреция вытесняемого вещества снижается.
Реабсорбция (обратное всасывание). Через мембраны почечных канальцев лекарственные вещества реабсорбируются путем пассивной диффузии по градиенту концентрации. Таким образом, реабсорбируются липофильные неполярные соединения, так как они легко проникают через мембраны эпителиальных клеток почечных канальцев. Гидрофильные полярные вещества (в том числе ионизированные соединения) практически не реабсорбируются и выводятся из организма. Таким образом, выведение почками слабых кислот и слабых оснований прямо пропорционально степени их ионизации и, следовательно, в значительной степени зависит от рН мочи.
/Кислая реакция мочи способствует экскреции слабых оснований (например, алкалоидов никотина, атропина, хинина) и затрудняет выделение слабых кислот (барбитуратов, ацетилсалициловой кислоты). Чтобы ускорить выведение почками слабых оснований, следует изменить реакцию мочи в кислую сторону (снизить рН мочи). Обычно в таких случаях назначают хлорид аммония. И наоборот, если необходимо повысить экскрецию слабых кислот, назначают натрия гидрокарбонат и другие соединения, сдвигающие реакцию мочи в щелочную сторону (повышают рН мочи). Внутривенное введение натрия бикарбоната, в частности, используют для ускоренного выведения барбитуратов или ацетилсалициловой кислоты в случае их передозировки.
Реабсорбция некоторых эндогенных веществ (аминокислоты, глюкоза, мочевая кислота) осуществляется путем активного транспорта.
Выведение через желудочно-кишечный тракт. Многие лекарственные вещества (дигоксин, тетрациклины, пенициллины, рифампицин и др.) выделяются с желчью в просвет кишечника (в неизмененном виде или в виде метаболитов и конъюгатов) и частично выводятся из организма с экскрементами. Однако часть веществ может повторно всасываться и при прохождении через печень снова
выделяться с желчью в просвет кишечника и т.д. Этот циклический процесс называется энтерогепатической (кишечно-печеночной) циркуляцией. Некоторые вещества (морфин, хлорамфеникол) выделяются с желчью в виде конъюгатов с глю-куроновой кислотой (глюкуронидов), гидролизующихся в кишечнике с образованием активных веществ, которые снова подвергаются реабсорбции. Таким образом энтерогепатическая циркуляция способствует пролонгированию действия лекарственных веществ. Некоторые лекарственные вещества плохо всасываются из желудочно-кишечного тракта и полностью выводятся из организма через кишечник. Такие вещества в основном применяют для лечения или профилактики кишечных инфекций и дисбактериоза (неомицин, нистатин).
Газообразные и летучие вещества выделяются легкими. Таким образом выводятся средства для ингаляционного наркоза. Некоторые вещества могут выделяться потовыми, слюнными железами (пенициллины, йодиды), железами желудка (хинин) и кишечника (слабые органические кислоты), слезными железами (ри-фампицин), молочными железами в период лактации (снотворные средства, спирт этиловый, никотин и др.). Во время кормления лекарственные вещества, которые выделяются молочными железами, могут вместе с молоком попасть в организм ребенка. Поэтому кормящим матерям противопоказано назначение лекарственных препаратов (цитостатиков, наркотических анальгетиков, хлорамфеникол а, изониазида, диазепама, антитиреоидных средств и др.), которые могут вызвать серьезные нарушения развития и неблагоприятно воздействовать на ребенка.
Для характеристики совокупности процессов, в результате которых активное лекарственное вещество удаляется из организма, вводится понятие элиминация, которое объединяет два процесса: биотрансформацию и выведение. Количественно процесс элиминации характеризуется рядом фармакокинетических параметров (см. раздел «Математическое моделирование фармакокинетических процессов»).