Что такое печеночная энцефалопатия при циррозе печени
ПЕЧЕНОЧНАЯ ЭНЦЕФАЛОПАТИЯ в практике врача скорой медицинской помощи
Какие клинические симптомы позволяют диагностировать ПЭ? Каковы проявления неврологических нарушений на разных стадиях развития ПЭ? В чем заключаются особенности развития ПЭ при алкоголизме? Каких ошибок должен избежать врач при лечении ПЭ?
Какие клинические симптомы позволяют диагностировать ПЭ?
Каковы проявления неврологических нарушений на разных стадиях развития ПЭ?
В чем заключаются особенности развития ПЭ при алкоголизме?
Каких ошибок должен избежать врач при лечении ПЭ?
Этиология и патогенез
Печеночная энцефалопатия (ПЭ) представляет собой потенциально обратимое расстройство нервной и психической деятельности, возникающее при любом из заболеваний печени, протекающем с недостаточностью печеночно-клеточной функции. В большинстве случаев ПЭ осложняет течение терминальной стадии хронических диффузных заболеваний печени или острого некротизирующего (фульминантного) гепатита. Установлено, что при поражении печени любой этиологии ПЭ может привести к развитию комы и стать непосредственной причиной смерти пациента (см. таблицу 1).
| Таблица 1. Причины развития ПЭ. | ||
| Вариант энцефалопатии | Выживаемость | Этиология |
| Острая энцефалопатия без фиброза/цирроза печени | 20–45% | Вирусный гепатит. Алкогольный гепатит. Острые отравления (химические и биологические яды, лекарства). Абстинентный синдром |
| Острая энцефалопатия на фоне фиброза/цирроза печени | 70-80% | Форсированный диурез Рвота, понос Кровотечение ЖКК Инфекции Прием алкоголя Абстинентный синдром Запор Избыток белка в рационе Хирургические вмешательства Прием седативных средств |
| Хроническая портосистемная энцефалопатия при терминальном заболевании печени | 100% | Портосистемное шунтирование Контраминация кишечника Избыток белка в рационе |
 |
| Рисунок 1. Механизм развития ПЭ. |
Патогенез ПЭ не до конца установлен. Считается, что развитие ПЭ является результатом сочетанного влияния на ЦНС нескольких механизмов, активность которых инициируется и поддерживается выраженным нарушением печеночного клиренса токсинов и метаболитов (см. рисунок 1). Наиболее существенным для развития ПЭ считают:
Клинические симптомы и диагноз ПЭ. Тип и количество избыточных, «токсических» метаболитов, циркулирующих в плазме и ЦНС, в той или иной степени коррелируют с различными симптомами ПЭ, к числу которых относят:
Механизм развития ПЭ
К ранним признакам нарушений сознания (НС) при ПЭ относят уменьшение спонтанных движений, фиксированный взгляд, заторможенность, апатию. Для нарушения сознания при ПЭ в принципе характерны сонливость и инверсия нормального ритма сна и бодрствования. При этом ухудшение состояния и переход сонливости в кому могут произойти в течение очень короткого времени. Для определения степени НС нередко применяют шкалу Глазго (см. таблицу 2). Однако в клинической практике для оценки глубины НС именно при ПЭ используют более простую качественную шкалу, в соответствии с которой:
Неврологические нарушения при ПЭ в целом не носят специфического характера и могут также развиваться при уремии, выраженной дыхательной и сердечной недостаточности. Однако одним из наиболее патогномоничных неврологических симптомов ПЭ считают развитие «хлопающего» тремора (астериксиса), отличительной чертой которого является неспособность пациента удерживать фиксированную позу. Наибольшая выраженность гиперкинеза мышц конечностей при поддержании постоянной позы и его уменьшение при движении позволяют дифференцировать астериксис от тремора при алкогольном делирии и нейроэнцефалопатии.
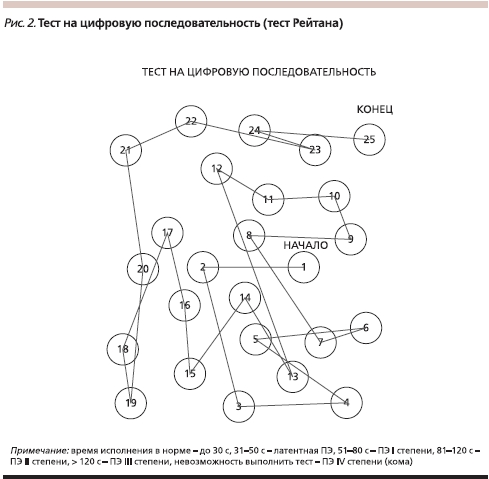
Наиболее надежным способом определить степень нарушений интеллекта при ПЭ является проведение теста связывания чисел (тест Рейтана). Изменения личности и интеллекта при ПЭ наиболее трудны для диагностики, поскольку всегда накладываются на конституциональные, приобретенные ранее нарушения и всегда требуют оценки в динамике. Наибольшие трудности в клинической практике встречаются при дифференциальной диагностике ПЭ и нарушений личности, развивающихся при хроническом злоупотреблении алкоголем (токсическая или алкогольная энцефалопатия, наличие которой прямо не влияет на исход острой ПЭ, однако определяет риск развития делирия на фоне алкогольного абстинентного синдрома). Важно, что при алкоголизме острая ПЭ может развиться при любой из клинико-морфологических форм алкогольной болезни печени (см. рисунок 2).
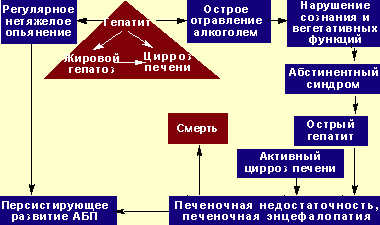 |
| Рисунок 2. Естественная история развития алкогольной болезни печени при хроническом злоупотреблении алкоголем. |
ПЭ у больных алкоголизмом в целом имеет те же характерные признаки, что и в остальных случаях, однако у них часто наблюдается мышечная ригидность, гиперрефлексия, клонус стоп. Алкогольный делирий отличается от «чистой» ПЭ продолжительным двигательным возбуждением, повышенной активностью вегетативной нервной системы, бессонницей, устрашающими галлюцинациями и быстрым мелким тремором (см. таблицу 3). Часто наблюдается выраженная анорексия, сопровождающаяся тошнотой и рвотой.
Характерной особенностью ПЭ является изменчивость клинической картины. Диагностировать ПЭ легко, например, у больного с циррозом печени,
с массивным желудочно-кишечным кровотечением или сепсисом, при обследовании которого определяют спутанность сознания и хлопающий тремор. В случае, когда очевидных причин ухудшения состояния выявить не удается и признаков цирроза печени также нет, распознать начало ПЭ невозможно, если не придать должного значения малозаметным признакам синдрома. Большое значение при этом могут иметь данные анамнеза, полученные от членов семьи, заметивших изменения в состоянии или поведении больного.
У больных с острой ПЭ без признаков хронической портальной гипертензии (варикозные вены передней стенки живота, отечно-асцитический синдром, спленомегалия, заболевание печени или алкоголизм в анамнезе) диагностика на догоспитальном этапе особенно затруднена. В этих случаях она должна базироваться, во-первых, на тщательном изучении анамнеза, если это возможно; во-вторых — на анализе эффективности применения стандартной неспецифической терапии комы. Дифференциальный диагноз у больных без цирроза печени необходимо проводить с рядом заболеваний, приводящих к внезапному и выраженному нарушению сознания (см. таблицу 4).
| Таблица 4. Причины острых нарушений сознания у больных без признаков портосистемного шунтирования. | ||
| Заболевание | Характерные симптомы и анамнестические данные | Неотложная терапия |
| Гипогликемия | Гипотония, брадикардия, сахарный диабет или сахаросни-жающая терапия в анамнезе | Введение концентри-рованной декстрозы |
| Острое отравление алкоголем | Запах алкоголя, гипертония, одышка, гиперемия лица, тахикардия, указания на прием алкоголя | Массивная инфузионная и поддерживаю-щая терапия |
| Алкогольный синдром отмены с делирием | Хроническое злоупотребление алкоголем, последний прием алкоголя не более трех-пяти дней назад, острый психоз с возбуждением и галлюцинациями | Введение маннитола концентри-рованной глюкозы и диазепама, поддерживаю-щая терапия |
| Острое отравление диазепинами | Глубокое нарушение сознания, указание на психоэмоцио-нальные проблемы, попытки самоубийства | Введение флумазенила, поддерживаю-щая терапия |
| Острое отравление парацетамолом | Указание на недавнее воспалительное заболевание, психоэмоцио-нальные проблемы, попытки самоубийства | Введение ацетил-цистеина, поддерживаю-щая терапия |
| Острое отравление опиатами | Указание на наркоманию, симптомы опиатного опьянения | Введение налоксона, поддерживаю-щая терапия |
| Энцефалопатия Вернике | Нистагм, двусторонний парез отводящих мыщц, указания на голодание, алкоголизм в анамнезе | Введение тиамина |
| Внутричерепные патологические процессы (травма, инфаркт, аневризма, менингит, энцефалит) | Анамнестические указания, характерные сипмтомы, отсутствие эффекта от экстренной терапии комы | Поддерживаю-щая терапия, экстренная госпитализация |
| Эндогенные интоксикации и гипоксические состояния (уремия, ОРДС, острые инфекционные заболевания) | Анамнестические указания, характерные симптомы, отсутствие эффекта от экстренной терапии комы | Поддерживаю-щая терапия, экстренная госпитализация |
У больных циррозом печени и активным портосистемным шунтированием важнейшим вопросом диагностики также является определение причин, приведших к развитию ПЭ (см. таблицу 5).
В большинстве случаев любой из перечисленных выше факторов либо напрямую подавляет функции ЦНС, либо нарушает их опосредованно — угнетая функцию печени, увеличивая концентрацию азотсодержащих продуктов в кишечнике и количество крови, протекающей, минуя печень, через портокавальные анастомозы.
Лабораторные данные занимают довольно скромное место в диагностике ПЭ. Известно, что ни функциональные печеночные пробы, ни повышенная концентрация аммиака в плазме прямо не коррелируют с выраженностью нарушений сознания.
Лечение ПЭ
Лечение ПЭ преследует три базовые цели:
Схематично лечение ПЭ (III и IV стадии) представлено в таблице 6.
Объем лечебных мероприятий при ПЭ относится к числу стандартных и выверенных клинической практикой алгоритмов неотложной помощи, поскольку эффективность лечения прямо зависит от как можно более раннего начала терапии. В этом смысле фармакотерапия ПЭ прямо относится к презумпции скорой медицинской помощи. Тем не менее на практике оказывается, что пациенты с ПЭ, как на догоспитальном этапе, так и в условиях стационара, нередко не получают адекватного лечения. Более того, во многих случаях больным назначают фармакотерапию, которая способна спровоцировать ухудшение состояния сознания и нарушение вегетативных функций. К числу наиболее распространенных ошибок лечения можно отнести:
Одной из наиболее существенных причин проведения неадекватного лечения нередко является часто неудовлетворительная диагностика ПЭ. Как ни парадоксально, сегодня во всех звеньях здравоохранения на фоне реально существующих регламентирующих врачебную деятельность документов выявление и точная квалификация ПЭ как угрожающего жизни осложнения основного заболевания печени в значительной степени утратила практический смысл. Например, при алкогольной болезни печени и в практике СМП, и в стационаре ПЭ нередко вообще не диагностируется, поскольку включена в редко используемые рубрики «острая или подострая печеночная недостаточность», «острый гепатит», «острое отравление алкоголем» или «абстинентное состояние». В подавляющем большинстве случаев при выявлении алкогольной болезни печени с нарушением сознания на практике ставятся диагнозы, соответствующие рубрикам К.70.0 — К.70.2, что нисколько в случае с ПЭ не отражает реального положения дел (см. таблицу 7). Кроме того, термин «ПЭ» при диагностике часто подменяется термином «токсическая (алкогольная) энцефалопатия», что влечет за собой недооценку тяжести состояния больного и риска летального исхода и позднее начало специфического лечения.
При выявлении ПЭ на догоспитальном этапе пациенты с III и IV стадиями нарушения сознания должны быть немедленно госпитализированы в отделение интенсивной терапии.
Прогноз ПЭ
Прогноз ПЭ всецело зависит от выраженности печеночно-клеточной недостаточности и времени начала лечения. При циррозе печени у больных с относительно сохранной функцией паренхимы и интенсивным коллатеральным кровообращением прогноз лучше, а у больных с острым гепатитом — хуже. Прогноз существенно улучшается, если удается быстро устранить факторы, ведущие к усугублению ПЭ: инфекцию, передозировку диуретиков или кровопотерю. Однако наиболее эффективным способом улучшить прогноз является как можно более точная диагностика и раннее начало лечения ПЭ.
Литература
Е. И. Вовк
МГМСУ, ННПОСМП, Москва
Что такое печеночная энцефалопатия при циррозе печени
Кафедра терапии и профессиональных заболеваний ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ, Москва
Печеночная энцефалопатия (ПЭ) – это синдром, объединяющий комплекс потенциально обратимых неврологических и психоэмоциональных нарушений, возникающих в результате острых или хронических заболеваний печени (с явлениями острой или хронической печеночноклеточной недостаточности соответственно) и/или портосистемного шунтирования крови [1]. В клинической практике наиболее часто явления ПЭ наблюдаются среди больных циррозом печени различной этиологии (вирусной, аутоиммунной, алкогольной и др.), будучи проявлением хронической печеночноклеточной недотаточности и нередко дополняясь ПЭ шунтового происхождения в связи с формированием выраженных портокавальных коллатералей [2].
Механизм развития печеночной энцефалопатии
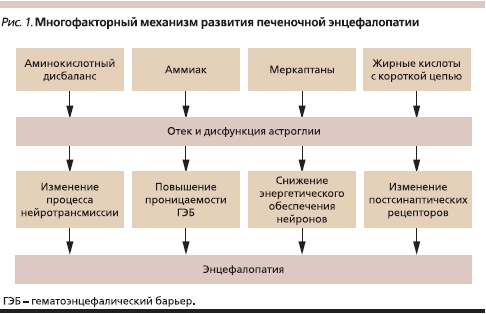
Наиболее полно объясняющей механизмы ПЭ при циррозе печени является “теория глии”, согласно которой эндогенные нейротоксины и аминокислотный дисбаланс, возникающие в результате печеночноклеточной недостаточности и/или портосистемного шунтирования крови, вызывают отек и функциональные нарушения астроглии [3]. Вслед за этим развиваются повышение проницаемости гематоэнцефалического барьера, изменение активности ионных каналов, нарушение процессов нейротрансмиссии и обеспечения нейронов макроэргическими соединениями, что и приводит к клиническим симптомам ПЭ [4].
Среди эндогенных нейротоксинов ведущее место отводится аммиаку, баланс которого строго контролируется в организме [5]. В физиологических условиях наибольшее количество аммиака образуется в толстой кишке при гидролизе кишечной флорой белка и мочевины и в скелетной мускулатуре при физической нагрузке. Детоксикация аммиака в организме осуществляется по двум механизмам: биосинтез мочевины в печени в орнитиновом цикле и образование глутамина. Орнитиновый цикл – основной механизм связывания аммиака. В противоположность синтезу глутамина обезвреживание аммиака в орнитиновом цикле является окончательным, поскольку мочевина представляет собой продукт, выделяющийся почками [6].
Значение аммиака в патогенезе ПЭ подтверждается усилением симптомов ПЭ при приеме аммиакпродуцирующих веществ (например, белка) и исчезновением или уменьшением при назначении безбелковой диеты. Однако отсутствует четкая взаимосвязь между концентрацией аммиака в сыворотке крови и выраженностью симптомов ПЭ.
Кроме аммиака к группе эндогенных нейротоксинов относятся также меркаптаны, коротко- и среднецепочечные жирные кислоты, фенолы [7]. Другой причиной нарушения функции глиальных клеток является аминокислотный дисбаланс, лежащий в основе биосинтеза “ложных” нейротрансмиттеров, обладающих угнетающим действием на клетки головного мозга [8]. В патогенезе ПЭ также имеет большое значение повышение концентрации серотонина и γ-аминомасляной кислоты, количества рецепторов к ним в головном мозге.
Суммируя представленные данные, можно утверждать, что патогенез ПЭ является комплексным и включает действие нескольких факторов: эндогенных нейротоксинов (в первую очередь аммиака), аминокислотного дисбаланса, изменения в функционировании нейротрансмиттеров и их рецепторов (рис. 1).
Клиническая картина печеночной энцефалопатии
Проявления ПЭ варьируются от субклинических, выявляемых лишь специальными психометрическими тестами, до глубокой печеночной комы, являющейся наиболее частой причиной смерти при циррозе печени [9]. Большинство проявлений ПЭ обратимо при их лечении, однако у некоторых больных она прогрессирует с развитием деменции, спастического парапареза, церебральной дегенерации и экстрапирамидных двигательных нарушений, обусловленных органическими нарушениями центральной нервной системы. В таком случае следует говорить о необратимой ПЭ, которая может частично регрессировать после ортотопической трансплантации печени.
Клиническая диагностика ПЭ включает оценку нейропсихических симптомов: изменений интеллекта, поведения, нейромышечных нарушений, однако основной критерий диагностики и подразделения ПЭ на стадии – это изменение сознания (табл. 1). К ранним признакам изменения сознания относятся уменьшение числа спонтанных движений, фиксированный взгляд, заторможенность и апатия, краткость ответов. Дальнейшее ухудшение сознания ведет к тому, что больной реагирует только на интенсивные стимулы, затем развивается кома. Расстройства интеллекта характеризуются неспособностью больных повторять элементарные действия; нарушается почерк, страдает речь. Характерным неврологическим проявлением ПЭ является “хлопающий” тремор (астериксис) [10].
В настоящее время особое внимание уделяют латентной ПЭ, поскольку, клинически не проявляясь, данное состояние характеризуется снижением быстроты познавательной деятельности и точности тонкой моторики, что может реализовываться в невозможность обеспечения должного контроля, например, при управлении сложными механизмами (автотранспортом). Частота латентной ПЭ достигает 80 % среди больных компенсированным циррозом печени, для выявления которой используют психометрическое тестирование. Психометрические тесты также позволяют объективизировать нарушения функции центральной нервной системы при ПЭ I и II стадий. Выделяют тесты, направленные на определение быстроты познавательной деятельности (тест связи чисел – см. рис. 2 и тест число–символ), тесты для определения быстроты и точности тонкой моторики (тест линий и тест обведения пунктирных фигур). Достаточно простым в применении является тест складывания фигур, суть которого состоит в том, что больного просят сложить простые узоры (пятиконечную звезду, квадрат, домик и т. д.) из спичек или специальных палочек. У больных с латентной формой ПЭ в значительной мере страдает оптикопространственная деятельность, одним из вариантов нарушения которой и является конструктивная апраксия, проявляющаяся неспособностью скопировать простой узор из спичек или специальных палочек. Описанный выше тест характеризует как гностические возможности пациента, заключающиеся в узнавании пространственной фигуры, так и конструктивные – воспроизведение предложенной формы. Конструктивная апраксия выявляется также в нарушении почерка [11]. Для выявления этих нарушений целесообразно рекомендовать больному ежедневное ведение дневника, в котором он может отмечать диурез, массу тела и характеризовать свое самочувствие.
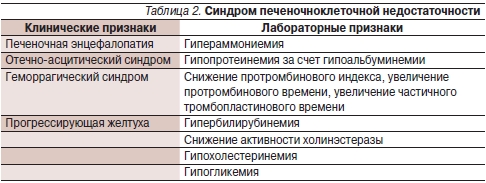
Правильно интерпретировать признаки поражения центральной нервной системы в пользу ПЭ помогают симптомы, свидетельствующие о печеночноклеточной недостаточности, одним из проявлений которой, собственно, и является ПЭ [12]. Принципиально важен факт возникновения симптомов ПЭ на фоне нарушения функции печени (в рамках хронической печеночноклеточной недостаточности – табл. 2).
Диагностика печеночной энцефалопатии
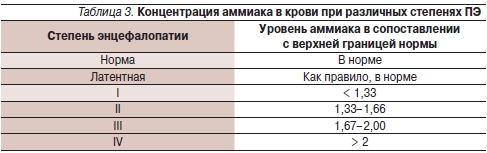
Клиническое подозрение на наличие ПЭ может быть подтверждено определением концентрации аммиака в сыворотке крови, однако необходимо помнить, что отсутствует четкая зависимость между концентрацией аммиака в крови и степенью ПЭ; при этом гипераммониемия выявляется у большинства больных циррозом печени (табл. 3) [13].
Лечение печеночной энцефалопатии
ПЭ – грозный признак поражения печени, имеющий важное прогностическое значение, поэтому необходимым является максимально раннее и адекватное лечение ПЭ [14]. Комплексное лечение ПЭ необходимо осуществлять в совокупности с этиотропной терапией (противовирусная терапия гепатотропных вирусных инфекций), патогенетическим лечением (медьэлиминирующая терапия при болезни Вильсона–Коновалова, иммунодепрессивная терапия при аутоиммунном гепатите, применение урсодезоксихолевой кислоты при холестатических заболеваниях печени и др.), а также симптоматической терапией (мочегонные препараты при отечно-асцитическом синдроме, коррекция других проявлений печеночноклеточной недостаточности) [15].
Общей рекомендацией по лечению ПЭ является необходимость соблюдения больными строгого постельного режима, что позволяет избегать вклада работы скелетной мускулатуры в гипераммониемию. Комплексное лечение ПЭ подразумевает воздействие на различные звенья патогенеза ее развития, в первую очередь направлено на снижение степени гипераммониемии [1, 11, 12].
1. Выявление и устранение факторов, способствующих развитию ПЭ (см. ниже).
2. Уменьшение степени гипераммониемии.
А. Уменьшение количества аммиакогенного субстрата:
• очищение желудочно-кишечного тракта (сифонные клизмы);
• уменьшение потребления белка.
Б. Связывание аммиака в крови:
В. Подавление образования аммиака:
• нерезорбируемые антибиотики или по показаниям антибиотики широкого спектра действия;
• ацидификация кишечного содержимого лактулозой, ацидифицирующие клизмы.
Г. Постельный режим.
3. Восстановление баланса аминокислот (инфузии растворов аминокислот с разветвленной цепью).
4. Комплексная поддерживающая терапия (лечение инфекций, коррекция анемии и гипоксии, коррекция нарушений электролитного баланса и рН и др.).
Необходим тщательный поиск факторов, провоцирующих развитие ПЭ, поскольку нередко их устранение в короткие сроки позволяет ликвидировать симптомы ПЭ [16]. Это особенно важно в случае желудочно-кишечного кровотечения.
Факторы, провоцирующие развитие ПЭ у больных циррозом печени:
• желудочно-кишечное кровотечение из варикозно расширенных вен пищевода или язвенных дефектов слизистой оболочки желудочно-кишечного тракта;
• назначение психотропных препаратов;
• назначение препаратов, способных вызывать лекарственное поражение печени;
• форсированная диуретическая терапия (в первую очередь петлевыми диуретиками);
• инфекции (в первую очередь спонтанный бактериальный перитонит, бронхо-легочные инфекции, инфекции мочевыводящих путей);
• наложение портокавальных анастомозов;
• избыточное употребление пищевого белка;
• хирургические вмешательства по поводу интеркуррентных заболеваний;
• лапароцентез с удалением большого количества асцитической жидкости (особенно без восполнения объема циркулирующей крови раствором альбумина);
Поскольку источником образования аммиака, не обезвреживающегося в печени и/или проникающего в системный кровоток через портокавальные шунты, является просвет желудочно-кишечного тракта, до настоящего времени самым эффективным методом уменьшения количества аммиакогенного субстрата остается очищение кишечника [17]. Этого достигают при использовании слабительных средств для очищения верхних отделов кишечника и клизм для нижних отделов. Пероральные слабительные лучше применять через назогастральный зонд – 10 %-ный раствор маннитола в объеме 500–1000 мл за 60–120 минут, 20 %-ный магния сульфат 50–100 мл. Однако эти препараты могут вызывать дегидратацию, гипонатриемию, гипокалиемию и метаболический алкалоз, что в свою очередь может способствовать развитию печеночной комы, поэтому в клинической практике применяются редко. Более доступно и наиболее адекватно удаление содержимого толстого кишечника с помощью сифонных клизм, что быстро уменьшает количество азотистого субстрата. Желательно использовать подкисленную воду (например, с добавлением 0,25–1,0 % уксусной кислоты) с целью связывания как можно большего количества аммиака. Нельзя применять мыльные и другие щелочные клизмы, поскольку они вызывают переход аммиака из просвета кишечника в кровеносное русло, где рН ниже. Наиболее целесообразно применение клизм с лактулозой: 300 мл лактулозы + 700 мл воды, а после них – с чистой водой.
Ограничение потребления белка с пищей – также доступный путь уменьшения образования аммиака в толстой кишке и снижение тем самым степени гипераммониемии [18]. При тяжелой степени ПЭ суточное потребление белка уменьшают до 20–30 г. В первые дни допустимо ограничение суточного количества потребляемого белка до 10 г, однако при более длительном ограничении возможен гиперкатаболизм эндогенных белков с нарастанием уровня аммиака в сыворотке крови. Необходимые для жизнедеятельности 1200 (до 2000) ккал восполняют приемом 5 %-ного раствора глюкозы внутрь или введением 10 %-ного раствора глюкозы внутривенно. После улучшения состояния больных содержание белка в диете можно постепенно увеличивать до 1 г/кг массы тела в сутки, обеспечивая его прирост на 10 г каждые сутки. Растительный белок переносится легче, чем животный; содержит небольшое количество метионина и ароматических аминокислот (при его приеме образуется меньше аммиака). Используют также молочный белок, содержащий в большом количестве аминокислоты с разветвленной цепью.
Другим путем уменьшения образования аммиака является подавление бактерий, способствующих образованию аммиака в просвете кишечника [19, 20]. Для выполнения этой задачи в терапии ПЭ могут быть использованы любые антибиотики широкого спектра действия, подавляющие кишечную флору, выделяющиеся с желчью или накапливающиеся в просвете кишечника в необходимой концентрации. С этой целью широко применяются фторхинолоны. Однако по возможности, особенно при начальных степенях ПЭ, необходимо проведение селективной деконтаминации кишечника путем назначения невсасываемых антибиотиков с широким спектром действия (на 4–7 дней, а иногда длительно – до 6–12 месяцев), что позволяет резко снижать уровень образования аммиака кишечными бактериями за счет санации кишечника. С этой целью применяется неомицин 4–6 г/сут или, более предпочтительно, рифаксимин 800–1200 мг/сут.
Слизистая оболочка кишечника человека не содержит ферменты, расщепляющие синтетические дисахариды, к которым относится лактулоза [21]. Перорально принимаемая лактулоза достигает слепой кишки, в которой она расщепляется бактериями с образованием преимущественно молочной кислоты. В результате рН каловых масс понижается. Это способствует росту бактерий, расщепляющих лактозу. При этом рост аммониегенных микроорганизмов, в частности бактероидов, подавляется. Лактулоза может “детоксицировать” жирные кислоты с короткой цепью, образующиеся при наличии крови и белков в просвете желудочно-кишечного тракта. В присутствии лактулозы и крови бактерии толстой кишки в основном расщепляют лактулозу. Это имеет особое значение при ПЭ, вызванной кровотечением. Кислая реакция каловых масс может уменьшать ионизацию и, следовательно, абсорбцию аммиака, а также аминов и других токсичных азотсодержащих соединений. В толстой кишке лактулоза более чем в 2 раза увеличивает образование растворимых соединений азота. В результате азот не абсорбируется в виде аммиака и уменьшается образование мочевины. При назначении лактулозы нужно стремиться к образованию кислого кала без диареи у больного. Препарат назначают в дозе 15–30 мл 2–3 раза в сутки, что приводит к 2- или 3-кратной дефекации (но не более) полужидким калом. К нежелательным явлениям относят метеоризм, диарею и боли в кишечнике.
Препараты, направленные на снижение концентрации аммиака в крови, улучшают обезвреживание аммиака в печени и связывают аммиак в крови [21, 22]. Ведущим гипоаммониемическим средством является L-орнитин-L-аспартат (Гепа-мерц). Гипоаммониемическое действие L-орнитина-L-аспартата связано с несколькими механизмами: орнитин стимулирует в перипортальных гепатоцитах карбамоил-фосфат-синтетазу I – ведущий фермент синтеза мочевины; аспартат и α-кетоглутарат стимулируют в перивенозных гепатоцитах, мышцах и головном мозге глутаминсинтетазу; орнитин и аспартат сами являются субстратами цикла синтеза мочевины (орнитин включается в цикл мочевины на этапе синтеза цитруллина, аспартат – на этапе синтеза аргининосукцината). Кроме этого в качестве положительного эффекта этих препаратов при ПЭ для больных циррозом печени рассматривается ингибирование катаболизма белка в мышцах, нормализация соотношения аминокислот в крови и антиоксидантный эффект. Эффективность L-орнитина-L-аспартата колеблется от 40 % при тяжелой ПЭ до 70–100 % при начальных признаках ПЭ.
Наиболее эффективна следующая схема лечения клинически выраженной ПЭ: внутривенные вливания по 20–40 г в сутки в течение 1–2 недель, затем пероральный прием препарата в дозе 9–18 г в сутки (по 3–6 г 3 раза в сутки после еды) в течение 2–3 недель. Больным ПЭ на фоне цирроза печени показано длительное (зачастую пожизненное) лечение этим препаратом.
Снижение уровня аммиака в крови достигается также парентеральным введением L-аргинина-L-яблочной кислоты (500 мл в сутки), участвующей в цикле трикарбоновых кислот и синтезе мочевины [23].
Развитие ПЭ сопровождается изменением соотношения между аминокислотами с разветвленной цепью и ароматическими аминокислотами [6]. Для лечения острой и хронической ПЭ применяются инфузии растворов, содержащих большую концентрацию аминокислот с разветвленной цепью. Механизм их действия связан с нормализацией аминокислотного состава крови. Наиболее широко эти препараты применяются больными циррозом печени с отсутствием белковой толерантности [24].
Важно подчеркнуть, что комплексная терапия ПЭ в сочетании с другими видами лечения (этиотропное, патогенетическое, симптоматическое) позволяет улучшать качество жизни больных циррозом печени различной этиологии и изменять их прогноз [25–27].
Литература
1. Poordad FF. Review article: the burden of hepatic encephalopathy. Aliment PharmacolTher 2007;25(1):3–9.
2. Blei AT. Portal hypertension and its complications. Curr Opin Gastroenterol 2007;23: 275–82.
3. Haussinger D, Schliess F, Kircheis G. Pathogenesis of hepatic encephalopathy. J Gastroenterol Hepatol 2002;17(3): S256–59.
4. Haussinger D, Schliess F. Pathogenetic mechanisms of hepatic encephalopathy. Gut 2008; 57:1156–65.
5. Shawcross D, Jalan R. The pathophysiologic basis of hepatic encephalopathy: central role for ammonia and inflammation. Cell Mol LifeSci 2005;62:2295–04.
6. Norenberg MD. Astroglial dysfunction in hepatic encephalopathy. Metab Brain Dis 1998; 13:319–35.
7. Arias JL, Aller MA, Sanchez-Patan F, Arias J. The inflammatory bases of hepatic encephalopathy. Eur J Gastroenterol Hepatol2006;18:1297–310.
8. Abou-Assi S, Vlahcevic ZR. Hepatic encephalopathy. Metabolic consequence of cirrhosis often is reversible. Postgrad Med2001;109:52–54,57–60.
9. Mullen KD. Review of the final report of the 1998 Working Party on definition, nomenclature and diagnosis of hepatic encephalopathy. Aliment Pharmacol Ther 2007; 25(1):11–16.
10. Amodio P, Gatta A. Neurophysiological investigation of hepatic encephalopathy. MetabBrain Dis 2005;20:369–79.
11. Butterworth RF. Hepatic encephalopathy. Alcohol Res Health 2003;27:240–46.
12. Menon KV, Kamath PS. Managing the complications of cirrhosis. Mayo Clin Proc 2000; 75:501–09.
13. Quero Guillen JC, Herrerias Gutierrez JM. Diagnostic methods in hepatic encephalopathy. Clin Chim Acta 2006;365:1–8.
14. Cordoba J, Minguez B. Hepatic encephalopathy. Semin Liver Dis 2008;28:70–80.
15. Bosch J, Bruix J, Mas A, et al. Rolling review: the treatment of major complications of cirrhosis. Aliment Pharmacol Ther 1994;8:639–57.
16. Bass NM. Review article: the current pharmacological therapies for hepatic encephalopathy. Aliment Pharmacol Ther 2007; 25(1):23–31.
17. Wright G, Jalan R. Management of hepatic encephalopathy in patients with cirrhosis. Best Pract Res Clin Gastroenterol 2007;21:95–110.
18. Ferenci P. Treatment of hepatic encephalopathy in patients with cirrhosis of the liver. Dig Dis 1996;14(1):40–52.
19. Festi D, Vestito A, Mazzella G, et al. Management of hepatic encephalopathy: focus on antibiotic therapy. Digestion 2006;73(1):94–101.
20. de Melo RT, Charneski L, Hilas O. Rifaximin for the treatment of hepatic encephalopathy. Am J Health Syst Pharm 2008;65:818–22.
21. Kircheis G, Haussinger D. Management of hepatic encephalopathy. J Gastroenterol Hepatol 2002;17(3):S260–67.
22. Auzinger G, Wendon J. Intensive care management of acute liver failure. Curr Opin Crit Care 2008;14:179–88.
23. Heidelbaugh JJ, Sherbondy M. Cirrhosis and chronic liver failure: part II. Complications and treatment. Am Fam Physician 2006; 74:767–76.
24. Tsiaousi ET, Hatzitolios AI, Trygonis SK, Savopoulos CG. Malnutrition in end stage liver disease: recommendations and nutritional support. J Gastroenterol Hepatol 2008;23:527–33.
25. Gerber T, Schomerus H. Hepatic encephalopathy in liver cirrhosis: pathogenesis, diagnosis and management. Drugs 2000;60: 1353–70.
26. Mas A. Hepatic encephalopathy: from pathophysiology to treatment. Digestion 2006; 73(1):86–93.
27. Riordan SM, Williams R. Treatment of hepatic encephalopathy. N Engl J Med 1997;337:473–79.