Что такое перинодулярный кровоток узла в матке
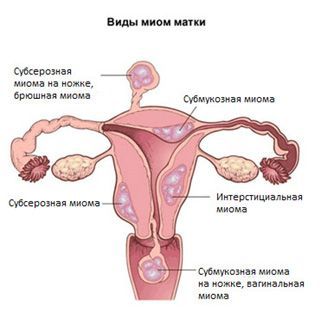
Миома матки
Миома матки — доброкачественное узловое образование в миометрии (мышечной стенке матки).
Опухоль относится к самым распространённым гинекологическим заболеваниям и наиболее часто встречается у женщин позднего репродуктивного возраста, перед климаксом. Частота заболевания составляет примерно 25% от всех патологий по гинекологическому профилю.
Причины
Специалисты по всему миру не могут со 100% точностью назвать причину возникновения патологии. Повлиять на рост новообразования может повреждение ткани яичников. Это ухудшает их основную функцию, что приводит к усиленной выработке женских половых гормонов. В ходе исследований было доказано, что эстрогены способствуют росту новообразования. Как только женщины прекращали прием оральных контрацептивов, рост миомы прекращался, а в дальнейшем она полностью рассасывалась. Но и это не является точной причиной, так как миома матки может развиваться при отсутствии эндокринных нарушений. Среди остальных причин эксперты выделяют:
Симптомы заболевания
Симптомы миомы матки разнообразны и зависят от локализации миоматозных узлов, величины и индивидуальных особенностей организма. Самые характерные проявления таковы:
Неспецифические симптомы, сопутствующие в отдельных случаях миоме матки, — бесплодие, неспособность выносить ребёнка. Они не всегда являются признаками опухоли, но часто — её следствием при выраженном увеличении узлов.
Миома матки: диагностика
В первую очередь, необходимо, конечно, обратиться к врачу-гинекологу для осмотра. Самое простое и информативное (до 95 % точности) исследование на предмет наличия/отсутствия опухоли — УЗИ. В ходе исследования миома проявляет себя округлыми очагами с пониженной эхогенностью. Точное расположение узлов можно получить с помощью 3D-исследования.
Чтобы дифференцировать миоматозные узлы и опухоли яичника, при необходимости назначают МРТ. Для диагностики малых субмукозных узлов применяют гистероскопию — малоинвазивное эндоскопическое исследование полости матки гистероскопом.
Подслизистая (субмукозная) миома матки
У 20-32% больных миоматозные узлы имеют субмукозную локализацию, что в большинстве случаев является показанием к хирургическому лечению вследствие ярко выраженной клинической симптоматики.
Симптомы Подслизистой (субмукозной) миомы матки:
Длительные, обильные менструации со сгустками и метроррагии, анемизирующие больную. Наряду с маточными кровотечениями бывают схваткообразные боли. Субмукозная миома матки нередко сопровождается бесплодием и невынашиванием беременности.
Подслизистая миома быстро растет и сопровождается высоким риском малигнизации (0,13-0,29%; по данным некоторых авторов, до 2%).
Диагностика Подслизистой (субмукозной) миомы матки:
Метрография. Первым методом (в историческом аспекте) диагностики подслизистых миоматозных узлов у пациенток с жалобами на обильные менструации, схваткообразные боли во время менструации, маточные кровотечения в постменопаузе была гистеросальпингография. Совпадение рентгенологического и гистологического диагнозов при субмукозной миоме матки составляет от 58 до 85%. Метрография в настоящее время с целью диагностики миомы матки используется редко.
На основании данных метрографии J. Donnez и соавт. (1993) подразделяют субмукозные узлы на преимущественно расположенные в полости матки, преимущественно расположенные в стенке матки и множественные (более 2) субмукозные узлы.
Большинство авторов указывают, что рентгенологические симптомы непатогномоничны, они встречаются и при крупных полипах эндометрия, узловой форме аденомиоза, раке матки. Диагностическую ценность метрографии снижает невозможность ее проведения при продолжительных кровяных выделениях. В настоящее время в связи с возможностями УЗИ и гистероскопии нет необходимости использования метрографии для диагностики субмукозных узлов.
Ультразвуковое сканирование. УЗИ применяют наиболее часто как один из наиболее информативных методов диагностики подслизистой миомы матки. Информативность УЗИ в диагностике субмукозной миомы, по данным разных авторов, достигает 92,8-95,7%.
Подслизистые узлы миомы внутри расширенной полости матки имеют вид округлых или овальных образований средней эхогенности с ровными контурами. Звукопроводимость подслизистых узлов миомы выше, чем полипов эндометрия.
Трансвагинальное УЗИ с использованием контрастного вещества называется гидросонографией. Гидросонография позволяет дифференцировать узел с полипом эндометрия, более четко определить локализацию подслизистого узла и деформацию полости матки.
Информативность ультразвуковой диагностики субмукозной миомы матки значительно возрастет при внедрении в практику внутриматочной эхографии с помощью специальных датчиков при расширенной полости матки. Условия метода максимально приближены к таковым при трансцервикальной резекции миоматозных узлов. Этот метод может дать наиболее ценную информацию о величине интрамурального компонента субмукозного узла при предоперационном обследовании.
Более объективную информацию при миоме матки можно получить и с помощью трехмерной эхографии, которую все шире используют в гинекологии.
Допплерография при УЗИ позволяет исследовать кровообращение в структуре узла. Особенности интра- и перинодулярного кровотока позволяют прогнозировать рост узла и оценивать структурные изменения в нем.
Гистероскопия. Гистероскопия с большой точностью диагностирует даже небольшие субмукозные узлы. Дефект наполнения в полости матки обычно выявляется при УЗИ или метрографии, но гистероскопия необходима для определения природы этого дефекта Субмукозные узлы имеют сферическую форму, четкие контуры, белесоватого цвета, деформируют полость матки, консистенция плотная при прикосновении кончиком гистероскопа. На поверхности узла могут быть мелкоточечные или обширные кровоизлияния, иногда просматривается сеть растянутых и расширенных кровеносных сосудов, покрытых истонченным эндометрием. При изменении скорости подачи жидкости в полость матки подслизистые миоматозные узлы не меняют форму и размеры, что позволяет отличить от полипа эндометрия.
Интерстициально-подслизистые миоматозные узлы при гистероскопии определяются в виде выбухания одной из стенок матки. Степень выбухания зависит от величины и характера роста миоматозного узла.
При обнаружении подслизистого узла определяют его величину, локализацию, ширину основания, величину интрамурального компонента.
При диагностической гистероскопии определяется тип подсли-зистого миоматозного узла:
От типа подслизистого узла зависят метод лечения и необходимость предоперационной гормональной подготовки.
Помимо диагностики миомы матки, диагностическая гистероскопия необходима для оценки состояния эндометрия и исключения других видов внутриматочной патологии (пороки развития матки, инородные тела, внутриматочные синехии). С внедрением в практику гидросонографии появилась возможность избежать диагностической гистероскопии у пациенток с подслизистой миомой матки.
Лечение Подслизистой (субмукозной) миомы матки:
Подслизистая (субмукозная) миома матки является показанием к оперативному лечению. Вопрос об объеме операции и хирургическом доступе решается индивидуально. Это зависит от возраста женщины, ее желания сохранить репродуктивную и менструальную функции, размера и типа подслизистого миоматозного узла, клинических проявлений и осложнений, сопутствующих гинекологической и экстрагенитальной патологии. Возможна как органосохраняющая (миомэктомия), так и радикальная (гистерэктомия) операция.
Операции можно выполнять как традиционным доступом (чревосечение), так и эндоскопическим доступом (лапароскопический, гистероскопический).
Гистероскопическая миомэктомия (механическая, электрохирургическая и с помощью лазера) стала оптимальным методом для удаления субмукозных миоматозных узлов.
Выбор метода трансгистероскопической миомэктомии зависит от:
Механическая миомэктомия возможна при субмукозных узлах 0 и 1 типов с незначительным интерстициальным компонентом. При этом можно удалить даже большие подслизистые узлы. Возможность удаления механическим путем зависит также от локализации узла, легче всего удалять узлы в дне матки. Для удаления субмукозных узлов можно прицельно фиксировать узел аборцангом и применять откручивание, с последующим гистероскопическим контролем или под контролем гистероскопа рассечь капсулу узла или его ножку резектором и извлечь узел из полости матки.
Преимущества механической миомэктомии: небольшая длительность операции (5-10 мин), не требуется дополнительного оборудования и специальной жидкой среды, исключены осложнения электрохирургической операции (жидкостная перегрузка сосудистого русла, возможные повреждения крупных сосудов и ожоги соседних органов).
Электрохирургическая миомэктомия показана при субмукозных узлах I и II типов с большим интрамуральным компонентом, небольших сферических узлов, а также расположенных в углах матки, которые практически невозможно удалить при механической миомэктомии. В зависимости от характера узла (субмукозный узел на узком основании или субмукозно-интерстициальный узел) операцию выполняют одномоментно или в два этапа. Двухэтапная операция рекомендуется при узлах, у которых большая часть располагается в стенке матки (II типа по гистероскопической классификации).
Радикальные операции при миоме матки заключаются в удалении матки с шейкой (тотальная гистерэктомия, экстирпация матки) или без шейки матки (субтотальная гистерэктомия, надвлагалищная ампутация матки).
Вопрос об оставлении придатков матки решается индивидуально в зависимости от возраста больной и состояния придатков.
Прогноз после удаления миомы благоприятный. После миомэк-томии, а также после субтотальной гистерэктомии показано диспансерное наблюдение с контролем состояния культи шейки матки.
К каким докторам следует обращаться если у Вас Подслизистая (субмукозная) миома матки:
Роль допплеровских методов в дифференциальной диагностике опухолей матки и яичников
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Введение
С внедрением в клиническую практику новых неинвазивных методов исследования, в том числе цветового допплеровского картирования (ЦДК), стало возможным более раннее выявление опухолей 4. Этот метод является простым, доступным, высокоинформативным, позволяющим провести эхографическую дифференциальную диагностику опухолей и опухолевидных образований яичников, а также различных видов онкопатологии матки 10.
A. Kurjak [11], Т. Bourne [12] одними из первых сообщили, что при проведении трансвагинальной цветовой допплерографии была обнаружена выраженная разница допплерометрических показателей в доброкачественных и злокачественных новообразованиях. Данные об информативности пороговых значений индексов при проведении дифференциального диагноза доброкачественного и злокачественного новообразования остаются противоречивыми. Одни авторы [5, 10, 11] высоко оценивают их диагностические возможности, не признавая эффективности показателей скорости, другие предлагают все делать наоборот [12]. Большая группа исследователей склоняется к тому, что только комплексное использование анамнестических данных, различных ультразвуковых методов, а также биохимических онкомаркеров и маркеров ангиогенеза приводит к реальному повышению точности диагностики [7-10, 13, 14]. Тем не менее исследование кровотока в сосудах новообразований имеет свои характерные особенности, что позволяет считать метод ЦДК важным в дифференциальной диагностике доброкачественных и злокачественных опухолей [15].
ЦДК позволяет оценить три параметра кровотока одновременно: направление, скорость и характер потока (однородность и турбулентность). Высокая разрешающая способность современных аппаратов дает возможность в режиме энергетического допплера визуализировать кровоток в мельчайших сосудах вплоть до системы микроциркуляторного русла, невидимых при сканировании в В-режиме [4, 8, 9]. Исследование характера васкуляризации опухолей внутренних половых органов допплеровскими методами открывает большую перспективу в их неинвазивной дифференциальной диагностике по степени злокачественности, а также в прогнозировании быстроты роста опухоли [9, 10, 14].
Материалы и методы
Основными клиническими проявлениями заболевания были болевой синдром у 41 (20,5%) женщины, нарушение менструальной функции у 38 (19,0%), нарушение функции соседних органов у 5 (2,5%), и бесплодие у 8 (4%) пациенток.
Результаты исследования

Рис. 1. Значения ИР (а) и МАС, см/с (б), в маточной артерии и внутриопухолевом образовании при миоме, саркоме и карциноме шейки матки.
Дифференциальным диагностическим критерием между саркомой и миомой матки в режиме ЦДК является визуализация нерегулярных, тонких, хаотично разбросанных сигналов от сосудов с показателями низкой резистентности как внутри, так и вокруг опухоли. Предлагается использовать пороговое значение ИР внутриопухолевого кровотока, равное 0,4, а максимальная систолическая скорость более 45 см/с.
Как и при саркоме матки у больных с раком шейки матки значения ИР в ветви маточной артерии и внутри опухоли были достоверно ниже (0,57 ± 0,14 и 0,37 ± 0,05 соответственно) как по отношению к контролю, так и к значениям, полученным при миоме матки. Скорость кровотока внутри опухоли недостоверно превышала скорость в маточной артерии (58,8 ± 8,64 против 51,9 ± 7,17 и см/с).
Сравнительная характеристика резистентности и скорости кровотока у больных с доброкачественными и злокачественными новообразованиями на уровне эндометрия представлена на рис. 2а,б. Рак эндометрия является довольно частой патологией и занимает второе место среди всех злокачественных заболеваний женских половых органов [2]. Многочисленные исследования свидетельствуют о том, что основное внимание при диагностике рака эндометрия отводится определению толщины М-эхо [6].

Рис. 2. Значения ИР (а) и МАС, см/с (б), в маточной артерии и внутриопухолевом образовании при гиперплазии, полипе и карциноме эндометрия, а также в трофобластических опухолях.
В менопаузе этот показатель, превышающий 5 мм, рассматривается как ведущий эхографический признак данной патологии, что требует комплексного обследования для уточнения диагноза.
Таким образом, применение допплеровских методов позволяет выявить вполне отчетливую зависимость опухолевого кровотока от клеточной пролиферации и ангиогенеза при доброкачественных и злокачественных новообразованиях матки. Однако требуется дальнейшее изучение зависимости показателей кривых скоростей кровотока от гистологического строения и степени дифференцировки опухолей.
При допплерографической оценке патологических состояний яичников имеют большое значение такие особенности нормального интраовариального кровотока в репродуктивном возрасте, как значительное повышение скорости и снижение резистентности в фазу расцвета желтого тела [8].
Рис. 3. Допплерометрические показатели (ИР, ПИ, МАС) внутриопухолевого кровотока в опухолевидных образованиях, доброкачественных и злокачественных опухолях яичников.
У женщин с фолликулярными кистами (15 наблюдений) визуализировался достаточно бедный сосудистый рисунок в стенках кисты, напоминающий интраовариальный кровоток в среднюю и позднюю фолликулярную фазу менструального цикла. Полученные значения MAC, ПИ и ИР составили 12,4 ± 3,67 см/с, 0,76 ± 0,07 и 0,52 ± 0,04 соответственно. Надежных эхографических дифференциальнодиагностических критериев между фолликулярными кистами и однокамерными гладкостенными цистаденомами при помощи допплеровских методов получено не было.
Значение допплерографии в дифференциации эндометриоидных кист или кист желтого тела и злокачественных новообразований яичников очевидно.
Эхографически опухоли представляли собой кистозно-солидные образования с множественными перегородками различной толщины и плотным компонентом средней или повышенной эхогенности (папиллярные разрастания по внутренней поверхности опухоли и на ее перегородках). Во всех наблюдениях образования содержали мелкодисперсную взвесь.
Полезная информация об интерстициальной миоме матки
Одна из разновидностей доброкачественной опухоли – интерстициальная миома матки – возникает в мышечных тканях этого органа и может нанести серьезный вред здоровью женщины, особенно в плане деторождения.
Все о проблеме
95 женщин из ста с диагнозом доброкачественной опухоли являются пациентками с миомой матки, расположенной интерстициально.
Под воздействием гормональных изменений в организме дамы может запуститься процесс перерождения клеток мышечных волокон этого гинекологического органа, что приведет к образованию узелков неонкологической природы.
Тело матки, ее дно – место локализации интерстициального узла миомы матки. Размеры образований – разные, форма их круглая или продолговатая.
Интерстициальная миома тела матки может выглядеть как единичный узел или множество образований, разместившихся в одном месте или «разбросанных» по этому гинекологическому органу.
Существуют и другие типы данного заболевания, порой узелковые опухоли переплетаются и вступают в «коалицию» против женского здоровья. Так возникают субсерозно интерстициальные миомы матки, которые могут неблагоприятно повлиять на детородную функцию женщин.
Это произойдет в случае прорастания опухоли с широким основанием в миометрический слой и обоснования узлов под слизистой оболочкой. Крупная интерсициальносубсерозная миома матки может давить на стенки этого органа, приводя к изменению его формы, влиять негативно на проходимость труб.
Все это не лучшим образом сказывается на беременности. Самопроизвольный выкидыш может возникнуть в случае соприкосновения интерстициальной субсерозной миомы матки с плацентой.
Серьезность ситуации может привести пациентку в уныние. Чтобы такого не произошло, необходимо своевременно бывать на приеме у гинеколога, особенно в период вынашивания плода.
Признаки
Увеличение количества половых гормонов в организме женщины (из-за ряда причин) может стать пусковым механизмом для образования интерстициальной миомы матки. Всплеск гормонов может произойти из-за:
Как распознать признаки интерстициальной миомы матки? У женщин может болеть живот (в нижней его части), появляются «непредвиденные» маточные кровотечения, кишечная и мочеполовая система работают нетипично, анормально.
Боли могут носить как постоянный, так и периодический характер, усиливаясь перед менструацией. Такие неприятные ощущения возникают из-за давления опухоли на сосуды стенки гинекологического органа, тем самым нарушая полноценное питание этого органа.
Длительность кровянистых выделений при месячных может существенно увеличиться, также как и их обильность. В некоторых случаях появляется кровь между циклами. Миома матки интерстицио субсерозной формы с сильными кровопотерями может привести к снижению гемоглобинового уровня и, следовательно, анемии. Общее самочувствие таких пациенток характеризуется снижением жизненных сил, слабостью.
Интерсициальная форма миомы тела матки, при которой опухоль давит на близлежащие внутренние органы, сопровождается различными нарушениями со стороны этих структур организма. Женщина может столкнуться с проблемой мочеиспускания и дефекации.
Опасные последствия
Интерстициосубсерозная миома тела матки – не тот случай, когда можно тянуть с посещением специализированной клиники. Если вовремя не обратиться к врачу, то можно ожидать такие негативные последствия этой болезни:
Интерстициальная миома матки требует самого серьезного отношения к этой проблеме и квалифицированной помощи гинеколога.
Лечебные мероприятия
Заметив какие-либо нарушения в нормальном течении менструального цикла, ощутив болезненность в нижней части живота, почувствовав слабость – спешите на прием к специалисту.
Лечение интерстициальной миомы матки – прерогатива гинеколога, только этот врач после тщательного осмотра, проведения диагностики сможет расписать курс лечебных мероприятий для эффективной борьбы с заболеванием.
Выбор методов лечения зависит от степени прогрессирования болезни, от локализации узлов, возраста и индивидуальных особенностей здоровья пациентки.
При диагнозе интерстициально субсерозная миома матки лечение проводится с применением:
Ранние стадии заболевания особенно хорошо поддаются лечению гормонотерапией. Комбинированные оральные контрацептивы рекомендованы для женщин молодого возраста, желающих в будущем забеременеть. Гестагенные медикаменты назначают дамам более старшего возраста, для которых неактуально зачатие и вынашивание ребенка.
Рассасывания опухоли при интерстициальной миоме матки можно ожидать, если принимать производные андрогенов, которые подавляюще действуют на выработку эстрогенов.
Помните, что интерстициальный узел миомы матки – не приговор, а сигнал к совместному действию с лечащим врачом.
Что такое перинодулярный кровоток узла в матке
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
Прогностическая значимость ультразвукового исследования у женщин с миомой матки на этапе планирования беременности
Журнал: Российский вестник акушера-гинеколога. 2016;16(4): 61-67
Буянова С. Н., Юдина Н. В., Гукасян С. А., Чечнева М. А., Рижинашвили И. Д., Сибряева В. А. Прогностическая значимость ультразвукового исследования у женщин с миомой матки на этапе планирования беременности. Российский вестник акушера-гинеколога. 2016;16(4):61-67.
Buianova S N, Iudina N V, Gukasian S A, Chechneva M A, Rizhinashvili I D, Sibryaeva V A. Prognostic value of ultrasound study in women with uterine myoma at the stage of pregnancy planning. Russian Bulletin of Obstetrician-Gynecologist. 2016;16(4):61-67.
https://doi.org/10.17116/rosakush201616461-67
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
В последнее время из года в год увеличивается число женщин репродуктивного возраста, страдающих доброкачественными опухолями гениталий.
Эхографию в настоящее время считают ведущим методом исследования в гинекологии. Применение данного метода не только способствует выявлению различных патологических процессов в органах репродуктивной системы у женщин, но и в большинстве случаев дает возможность установить их нозологическую принадлежность [1]. Наиболее эффективной неинвазивной методикой для оценки состояния матки, обнаружения миоматозных узлов и оценки динамики их роста в настоящее время являются гистеросонография и допплерография сосудов матки и миоматозного узла [2, 3].
С появлением цветовой допплерографии стало возможным не только проводить исследование в главных артериальных сосудах, питающих органы, но и оценить состояние внутриорганного микроциркуляторного русла. Использование этого метода позволяет обнаружить в миоматозных узлах артериальный кровоток двух видов: периферический (представленный гипертрофированными сосудами собственно миометрия) и центральный (представленный новообразованными сосудами миоматозного узла) [4].
Материал и методы
Для изучения репродуктивного здоровья у пациенток с миомой матки были обследованы 163 женщины в возрасте от 22 до 42 лет (средний возраст 32±0,3 года).
Критериями включения в исследование являлись:
— возраст пациенток от 22 до 42 лет;
— желание женщины реализовать репродуктивную функцию;
— наличие миомы матки больших размеров;
— отсутствие распространенного наружно-внутреннего эндометриоза.
Наиболее частыми жалобами у женщин с миомой матки были маточные кровотечения, приводящие к анемизации, боли внизу живота, нарушение функций смежных органов и детородной функции, увеличение живота в объеме за счет больших и гигантских размеров опухоли. Гинекологические заболевания в анамнезе имели 73 (44,8%) пациентки. Воспалительные заболевания матки и придатков отмечены у 26 (15,9%) пациенток. Мочеполовые инфекции в анамнезе наблюдались у 31 (19%) обследованной.
По данным В.И. Ланчинского [5], репродуктивная функция при миоме матки нарушается у каждой третьей женщины.
При изучении репродуктивной функции нами обнаружено, что у 60 (36,8%) пациенток в анамнезе имелись самопроизвольные аборты и неразвивающиеся беременности, причем у 39 (65%) из них неблагоприятные исходы беременности отмечены на фоне миомы матки, срок гестации при потере предыдущей беременности у которых колебался от 5 до 21 нед. При этом рост узлов во время беременности достигал от 10 до 25 см в диаметре при исходных размерах миомы до наступления беременности от 4 до 4,5 см.
Таким образом, у 83 (50,9%) пациенток с миомой матки отмечалось нарушение репродуктивной функции.
По клиническому течению и характеру роста миоматозных узлов все обследуемые пациентки были разделены на три группы: в 1-ю включены 32 (19,6%) больные со «стабильной» по клиническому течению миомой матки; 2-ю группу составили 97 (59,5%) пациенток с клинической картиной быстрого роста узлов; к 3-й группе отнесены 34 (20,9%) больные с деструктивными изменениями в миоматозном узле.
Амбулаторно проводились стандартное клиническое обследование, расширенная кольпоскопия, цитологическое исследование, обследование для выявления инфекций, передаваемых половым путем, обязательная санация очагов инфекции.
Всем обследуемым пациенткам репродуктивного возраста с миомой матки на этапе предоперационной подготовки, на 5-7-е сутки после операции, через 2 и 6 мес после операции было проведено комплексное УЗИ на аппарате ACCUVIXV-20 MEDISON с использованием датчиков трансабдоминального сканирования с частотой 2-6 МГц и трансвагинального исследования с частотой датчика 4-9 МГц в реальном времени, в процессе которого уточняли анатомические особенности и состояние внутренних половых органов. Исследование проводили в положении больной на спине с опорожненным мочевым пузырем. При этом оценивались общие размеры матки и структура миометрия, выявлялись миоматозные узлы. Особое внимание уделялось изучению локализации, характера роста, количества, размеров, отношения миоматозных узлов к полости матки и их эхоструктуры. Определяли признаки, характерные для аденомиоза. Оценивали структуру и толщину эндометрия, контуры, фиксировали наличие деформации полости матки. Определялась величина переднезаднего размера и его структура. Производилась оценка эхоструктуры шейки матки. При осмотре яичников помимо их общих размеров обращали внимание на признаки функциональной активности (состояние фолликулярного аппарата, наличие желтого тела), а также выявляли патологические структуры в яичниках, вовлеченность их в спаечный процесс. После операции в области послеоперационного рубца оценивались толщина миометрия, наличие или отсутствие деформаций, «ниш», гематом, отека, соединительнотканных включений, жидкостных структур, участков втяжения со стороны брюшины и полости матки, кривые скоростей кровотока.
Проводилось цветовое допплеровское картирование ветвей маточных артерий и внутриопухолевых сосудов с последующей оценкой кривых скоростей кровотока. При цветовой допплерографии оценивался кровоток в периферических и в центральных отделах миоматозного узла. Допплерографическое исследование артерий интактного миометрия проводилось на уровне аркуатных артерий. Для оценки кривых скоростей кровотока применялись следующие показатели:
Обработка данных осуществлялась с помощью пакета прикладных программ Statistica 6.1 и стандартных математических таблиц Microsoft Excel.
Результаты
Диаметр миоматозных узлов, по данным УЗИ, колебался от 0,5 до 21 см при множественной миоме матки, при этом размеры доминантного узла варьировали от 8 до 21 см. Диаметр узла при изолированной миоме матки был в пределах от 5 до 20 см.
Из приведенных данных следует, что преобладали интерстициальные миомы, расположенные в теле матки (рис. 1), тем не менее почти у 50% пациенток имелись перешеечные и интралигаментарные узлы. Применение УЗИ позволило обеспечить точность диагностики миомы матки до 97%.

При эхографии у 48 (29,4%) пациенток нами были выявлены признаки дистрофических изменений в миоматозных узлах в виде отека, кистозной и жировой дегенерации, с наличием кальцификатов и обызвествления.
У большинства женщин размеры яичников, по данным ультразвуковой биометрии, были в пределах нормы. У некоторых пациенток в яичниках обнаружены жидкостные включения, по эхографическим характеристикам расцененные как доминантные фолликулы. У 27 (16,6%) пациенток были выявлены кисты желтого тела, эндометриоидные и фолликулярные кисты.
При анализе кривых скоростей кровотока определяли максимальную систолическую и конечную диастолическую скорости кровотока. Эти показатели использовали для вычисления индекса резистентности (ИР) и систолодиастолического отношения (С/Д), которые являются показателями периферического сосудистого сопротивления. Анализ допплерометрических кривых скоростей кровотока производили в аркуатных артериях тела матки, а также во внутриопухолевых сосудах.
Кровоток в аркуатных артериях регистрировался у всех пациенток с миомой матки, вне зависимости от локализации миоматозных узлов.
На основании полученных при допплерометрии кривых скоростей кровотока были вычислены значения С/Д, И.Р. Была проведена сравнительная оценка полученных результатов кровотока в узлах различной локализации, размера и характера роста и значений допплерометрических измерений в аркуатных артериях миометрия у здоровых женщин, представленных в литературе [6], результаты сопоставлены с клинической картиной миомы матки у обследованного контингента женщин.
Полученные нами данные показателей кривых скоростей кровотока в миоматозных узлах в зависимости от характера роста миомы матки представлены в табл. 1.
Как видно из табл. 1, в 1-й группе параметры кривых скоростей кровотока соответствовали значениям кровотока в аркуатных артериях неизмененного миометрия, что наблюдалось при наличии «стабильной» миомы матки по данным клинического течения.
По полученным данным, во 2-й группе показатели пиковой скорости кровотока были достоверно выше по периферии узла и имели тенденцию к снижению в центре опухоли, а ИР и С/Д были достоверно ниже значений, характерных для аркуатных артерий у здоровых женщин, что соответствовало клинической картине быстрого роста узлов.
В 3-й группе обследованных женщин пиковая скорость кровотока, ИР и С/Д были достоверно ниже, чем значения кровотока у здоровых женщин в аркуатных артериях, что соответствовало наличию деструктивных изменений в миоме.
Нами был исследован внутриопухолевый кровоток в миоматозных узлах в зависимости от их размеров (табл. 2).

Как видно из табл. 3, показатели внутриопухолевого кровотока по периферии опухоли в определенной степени коррелируют с размерами миоматозных узлов.
В результате проведенного нами исследования можно сделать вывод, что прогностическими критериями быстрого роста узла явились повышение ПСК по периферии узла и снижение ИР, С/Д по сравнению со значениями, характерными для здоровых женщин.
Таким образом, применение УЗИ в сочетании с допплерографией миоматозных узлов и матки в целом имеет большое диагностическое значение и позволяет прогнозировать динамику роста и развитие деструктивных изменений в миоме, что может способствовать своевременной тактике лечения, что в свою очередь повлияет на улучшение репродуктивной функции женщин.
Всем пациенткам была выполнена миомэктомия лапаротомным доступом. Ранний послеоперационный период протекал без осложнений.
При УЗИ на 5-7-е сутки визуализация послеоперационного шва была возможна у 159 (97,5%) пациенток (рис. 2).

В области ложа вылущенного миоматозного узла определялись хорошо структурированные лигатуры в виде гиперэхогенных включений. Наличие умеренного отека в области формирующегося рубца на матке отмечено у 12 (7,4%) пациенток, у 7 (4,3%) оперированных визуализировались субсерозные гематомы диаметром до 2 см. Наличие деформаций, «ниш», соединительнотканных включений, жидкостных структур, участков втяжения со стороны периметрия матки ни у одной пациентки диагностировано не было. Мелкие интерстициальные миоматозные узлы диаметром от 3 до 7 мм, которые не были обнаружены интраоперационно, были выявлены при УЗИ у 5 (3%) пациенток. Кроме того, проводилась оценка состояния пузырно-маточной складки, дугласова пространства, параметриев. Наличие свободной жидкости в полости малого таза в количестве от 10 до 50 мл определялось у 23 (14,1%) пациенток на 5-7-е сутки после операции. Инфильтратов и патологических образований в малом тазу выявлено не было.
При допплерометрии проводилась оценка репаративных процессов в миометрии в области послеоперационного шва с учетом кривых скоростей кровотока. Показатели кровотока в области ложа вылущенных узлов на 5-7-е сутки представлены в табл. 3.
При изучении кровотока в области послеоперационного шва на 5-7-е сутки во всех группах показатели скоростей кровотока соответствовали значениям, характерным для аркуатных артерий миометрия здоровых женщин. Показатели кривых скоростей кровотока в 3-й группе пациенток, у которых произведено удаление деструктивно измененных узлов, достоверно выше, чем у женщин 1-й и 2-й групп. Анализируя полученные статистические данные, мы пришли к выводу, что течение репаративных процессов в матке не зависит от характера роста удаленных миоматозных узлов.
Таким образом, для неосложненного течения послеоперационного периода в области формирующегося рубца на матке после миомэктомии характерна тенденция к повышению скоростей кровотока, С/Д и ИР, что соответствует нормальному кровотоку в интактном миометрии.
УЗИ в динамике через 2 и 6 мес после органосохраняющей операции всем пациенткам проводилось в I фазе менструального цикла, а именно на 5-7-й день (рис. 3, 4,).


Визуализация послеоперационного рубца регистрировалась лишь у 8 (4,9%) обследованных в виде единичных гиперэхогенных включений через 2 мес, через полгода после операции ни у одной пациентки рубец на матке не визуализировался. Толщина миометрия в области сформировавшегося рубца соответствовала толщине интактного миометрия во всех случаях как через 2, так и через 6 мес послеоперационного периода. Наличие «ниш» и деформаций отмечено не было. Размеры яичников варьировали в пределах значений у здоровых женщин с обычной неизмененной структурой и наличием фолликулярного аппарата. При эхографии шейки матки структурных изменений выявлено не было.
При оценке кровотока в динамике через 2 и 6 мес по сравнению с кровотоком в миометрии здоровых женщин достоверных отличий не было выявлено, что расценено нами как завершение репаративных процессов в области вылущенных миоматозных узлов.
Весь интраоперационно удаленный материал подвергался гистологическому исследованию. У 163 пациенток была диагностирована лейомиома матки в различных гистологических вариантах.
Были сопоставлены полученные данные допплерографии, процессов неоангиогенеза с результатами гистологического исследования в зависимости от темпа роста миомы матки у оперированных нами пациенток.
Среди 163 обследованных нами пациенток у 33 (20,2%) были выявлены редкие гистологические варианты лейомиомы. Причем, в группе женщин с клинической картиной и данными кривых скоростей кровотока быстрого роста миоматозных узлов и активными процессами неоангиогенеза (Me VEGF-A 575,4 пг/мл) (2-я группа) достоверно чаще встречались такие гистологические варианты лейомиомы, как митотически активная, клеточная и «причудливая», что объясняет быстрый рост опухоли во время гестации у пациенток с потерей беременности в анамнезе. У 7 (7,2%) пациенток 2-й группы была диагностирована лейомиома с дистрофическими изменениями; возможно, быстрый рост миомы у них был обусловлен вторичными изменениями в узле, что также было подтверждено данными УЗИ. В 3-й группе пациенток с клиническими проявлениями деструктивных изменений в узлах уровень содержания VEGF-A был ниже 100 пг/мл, при допплерометрии нами отмечены достоверно низкие показатели кривых скоростей кровотока по сравнению со значениями у здоровых женщин; у 23 из 34 женщин морфологически были подтверждены некротические, дегенеративные и воспалительные изменения в опухоли разной степени давности.
При сравнительном анализе допплерометрических показателей кровотока миомы с ее морфоструктурой нами были выявлены следующие особенности: при высоких показателях пиковой скорости кровотока в капсуле миомы и при ее низких значениях внутри узла по сравнению со значениями у здоровых женщин морфологическая картина соответствовала некротическим изменениям в узле. Низкие показатели пиковой скорости кровотока в капсуле миоматозного узла и ее высокие значения в центре опухоли также по сравнению со значениями в здоровом миометрии были характерны для отека миомы матки по данным гистологического исследования, что подтверждается другими исследователями 8.
Размеры удаленных узлов макроскопически были достоверно больше у женщин 2-й и 3-й групп по сравнению с размерами миомы пациенток 1-й группы, у которых достоверно чаще была выявлена лейомиома без деструкции, что также подтверждено другими исследователями 15.
Ряд авторов [16, 17] в своих исследованиях доказали, что у пациенток после миомэктомии частота наступления беременности и родов была выше, чем у женщин, которые отказались от предложенной миомэктомии.
После миомэктомии детородная функция была восстановлена у 98 (60,1%) пациенток из 163. У 61,3% женщин беременность завершилась родами, в настоящее время беременность прогрессирует в разных сроках почти у 28,8%, неблагоприятные исходы отмечены у 10,1%. Наступление беременности чаще всего отмечено через 2-3 года после проведения органосохраняющей операции. При сравнительной оценке зависимости частоты наступления беременности от диаметра узлов таковой выявлено не было. Достоверно чаще наступление беременности наблюдалось у женщин, которым была произведена изолированная миомэктомия, чем у женщин с множественной миомэктомией, особенно при вылущивании более 6-8 узлов.
При анализе отдаленных результатов рост новых миоматозных узлов был диагностирован у 5 (3%) пациенток. В повторном оперативном лечении ни одна пациентка не нуждалась, за пациентками продолжается динамическое наблюдение.
Выводы
Ультразвуковое исследование с допплерометрией позволяет составить прогноз роста миоматозного узла во время беременности на основе изучения особенностей кровоснабжения в узлах разных размеров, локализации и темпов роста: если в «стабильном» по клиническому течению миоматозном узле небольших средних размеров (не более 300 см 3 ) определяются значения кровотока, соответствующие показателям у здоровых женщин в аркуатных артериях неизменного миометрия, а в больших миомах с деструкцией узла («ложный» быстрый рост) показатели скорости кровотока, индекса резистентности и систолодиастолического отношения достоверно снижены по сравнению с их значениями у здоровых женщин, то прогностическими критериями быстрого роста миоматозного узла при наступлении беременности являются повышение показателей пиковой скорости кровотока и снижение индекса резистентности и систолодиастолического отношения по периферии узла по сравнению с показателями в неизмененном миометрии у здоровых женщин. Высокий уровень сосудисто-эндотелиального фактора роста в плазме крови у женщин репродуктивного возраста с миомой матки (выше 300 пг/мл) является прогностическим критерием быстрого роста миомы матки; ниже 100 пг/мл свидетельствует о начавшихся дистрофических изменениях в узлах. Тактика ведения пациенток репродуктивного возраста с миомой матки на этапе планирования беременности должна включать топическую диагностику миомы с составлением ее прогноза роста во время беременности; предоперационную подготовку с санацией инфекционных очагов и лечением анемии; своевременную миомэктомию при размерах узлов больше 4-5 см с соблюдением хирургической технологии, обеспечивающей условия для формирования полноценного рубца (рубцов) на матке; послеоперационную реабилитацию.