Что такое период полужизни лекарственного средства
Период полувыведения (полужизни)
Период полувыведения [ править | править код ]
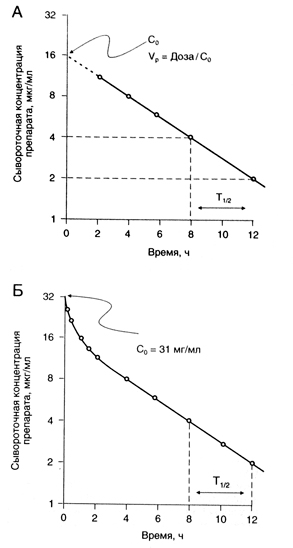
Период полувыведения (Т1/2) — это время, за которое сывороточная концентрация вещества (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели (рис. 1.4, А) определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, так как динамика их сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б). В таких случаях рассчитывают несколько значений Т1/2.
Раньше Т1/2 рассчитывали по участку фармакокинетической кривой, отражающему стадию равновесия (стадию элиминации). С появлением более чувствительных методов измерения концентрации веществ в крови оказалось, что конечный Т1/2 гораздо больше начального. Например, для гентамицина конечный Т1/2 равен 53 ч, тогда как в Приложении II приведен T1/2 2—3 ч. Чрезвычайно длительный конечный Т1/2 индометацина (120 ч) обусловлен, вероятно, активным кишечно-печеночным кругооборотом препарата (в Приложении II приведен Т 1/2 2,4 ч). Клиническая значимость Т1/2 для того или иного периода зависит от того, какая доля вещества выводится из организма и каков объем распределения в этот период, а также от того, какой из показателей — сывороточная концентрация препарата или его общее содержание в организме — лучше коррелирует с фармакологическими эффектами. В Приложении II приведены величины Т1/2, имеющие наибольшее практическое значение.
В прошлом изменение фармакокинетики лекарственных средств при разных патологических состояниях оценивали только на основании Т1/2. В настоящее время общепризнано, что Т1/2 зависит от клиренса и объема рас- пределения вещества. В стационарном состоянии зависимость между Т1/2, клиренсом и объемом распределения приблизительно описывается следующим уравнением:
T1/2 = 0.693 x Vc / Cl(1.12)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 должен увеличиваться. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т1/2 диазепама увеличивается, но не за счет уменьшения клиренса, а вследствие увеличения объема распределения (Klotzetal., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы и тканей, так что предсказать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно. При остром вирусном гепатите Т1/2 толбутамида уменьшается, а не увеличивается, как это можно было бы ожидать, из-за снижения степени связывания препарата с белками плазмы и тканей. Объем распределения толбутамида не меняется, а клиренс увеличивается вследствие увеличения сывороточной концентрации свободного препарата (Williams et al., 1977).
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Сывороточная концентрация, составляющая примерно 94% средней стационарной, достигается за время, равное 4Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полного удаления вещества из организма, и рассчитать интервал между введениями (см. ниже).
Стационарное состояние [ править | править код ]
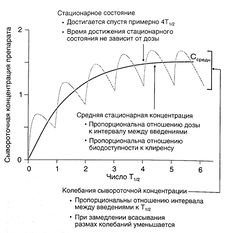
Согласно уравнению 1.1, если вещество вводится путем инфузии с постоянной скоростью, в стационарном состоянии скорость поступления вещества (скорость инфузии) равна скорости его элиминации (произведение клиренса на сывороточную концентрацию препарата — уравнение 1.3). Уравнение 1.1 можно применять и при дробном введении (например, 250 мг каждые 8 ч): в этом случае также устанавливается стационарная сывороточная концентрация препарата, но в промежутках между введениями она колеблется от минимальной до максимальной (рис. 1.5).
Описание к рис. 1.5. Динамика сывороточной концентрации лекарственного средства при дробном введении. Серая кривая описывает накопление препарата при введении с интервалами, равными Т1/2, при условии, что скорость всасывания в 10 раз больше скорости элиминации. При увеличении скорости всасывания максимальная концентрация в стационарном состоянии стремится к 2, а минимальная — к 1. Черная кривая отражает динамику сывороточной концентрации препарата, который вводят в эквивалентной дозе путем инфузии. Обе кривые соответствуют однокамерной фармакокинетической модели. Средняя концентрация в стационарном состоянии вычисляется по уравнению:
Cсредн=F x Доза / (Cl x T)
Это уравнение можно получить путем замены в уравнении 1.1 скорости поступления вещества на выражение F х Доза / Т. Ссредн соответствует концентрации препарата в стационарном состоянии при введении путем инфузии.
Период полувыведения (полужизни)
Период полувыведения [ править | править код ]
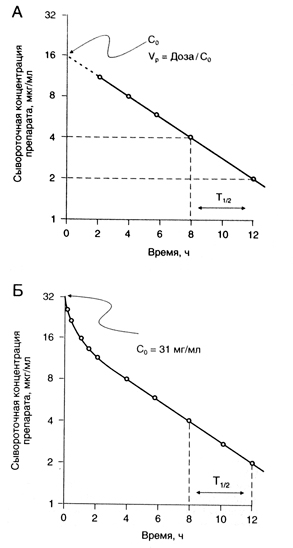
Период полувыведения (Т1/2) — это время, за которое сывороточная концентрация вещества (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели (рис. 1.4, А) определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, так как динамика их сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б). В таких случаях рассчитывают несколько значений Т1/2.
Раньше Т1/2 рассчитывали по участку фармакокинетической кривой, отражающему стадию равновесия (стадию элиминации). С появлением более чувствительных методов измерения концентрации веществ в крови оказалось, что конечный Т1/2 гораздо больше начального. Например, для гентамицина конечный Т1/2 равен 53 ч, тогда как в Приложении II приведен T1/2 2—3 ч. Чрезвычайно длительный конечный Т1/2 индометацина (120 ч) обусловлен, вероятно, активным кишечно-печеночным кругооборотом препарата (в Приложении II приведен Т 1/2 2,4 ч). Клиническая значимость Т1/2 для того или иного периода зависит от того, какая доля вещества выводится из организма и каков объем распределения в этот период, а также от того, какой из показателей — сывороточная концентрация препарата или его общее содержание в организме — лучше коррелирует с фармакологическими эффектами. В Приложении II приведены величины Т1/2, имеющие наибольшее практическое значение.
В прошлом изменение фармакокинетики лекарственных средств при разных патологических состояниях оценивали только на основании Т1/2. В настоящее время общепризнано, что Т1/2 зависит от клиренса и объема рас- пределения вещества. В стационарном состоянии зависимость между Т1/2, клиренсом и объемом распределения приблизительно описывается следующим уравнением:
T1/2 = 0.693 x Vc / Cl(1.12)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 должен увеличиваться. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т1/2 диазепама увеличивается, но не за счет уменьшения клиренса, а вследствие увеличения объема распределения (Klotzetal., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы и тканей, так что предсказать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно. При остром вирусном гепатите Т1/2 толбутамида уменьшается, а не увеличивается, как это можно было бы ожидать, из-за снижения степени связывания препарата с белками плазмы и тканей. Объем распределения толбутамида не меняется, а клиренс увеличивается вследствие увеличения сывороточной концентрации свободного препарата (Williams et al., 1977).
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Сывороточная концентрация, составляющая примерно 94% средней стационарной, достигается за время, равное 4Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полного удаления вещества из организма, и рассчитать интервал между введениями (см. ниже).
Стационарное состояние [ править | править код ]
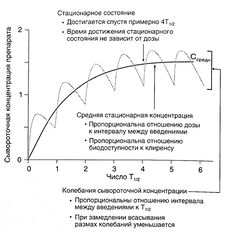
Согласно уравнению 1.1, если вещество вводится путем инфузии с постоянной скоростью, в стационарном состоянии скорость поступления вещества (скорость инфузии) равна скорости его элиминации (произведение клиренса на сывороточную концентрацию препарата — уравнение 1.3). Уравнение 1.1 можно применять и при дробном введении (например, 250 мг каждые 8 ч): в этом случае также устанавливается стационарная сывороточная концентрация препарата, но в промежутках между введениями она колеблется от минимальной до максимальной (рис. 1.5).
Описание к рис. 1.5. Динамика сывороточной концентрации лекарственного средства при дробном введении. Серая кривая описывает накопление препарата при введении с интервалами, равными Т1/2, при условии, что скорость всасывания в 10 раз больше скорости элиминации. При увеличении скорости всасывания максимальная концентрация в стационарном состоянии стремится к 2, а минимальная — к 1. Черная кривая отражает динамику сывороточной концентрации препарата, который вводят в эквивалентной дозе путем инфузии. Обе кривые соответствуют однокамерной фармакокинетической модели. Средняя концентрация в стационарном состоянии вычисляется по уравнению:
Cсредн=F x Доза / (Cl x T)
Это уравнение можно получить путем замены в уравнении 1.1 скорости поступления вещества на выражение F х Доза / Т. Ссредн соответствует концентрации препарата в стационарном состоянии при введении путем инфузии.
Что такое период полужизни лекарственного средства
Значение фармакокинетических и фармакодинамических показателей
Фармакокинетические параметры. Как уже отмечалось, общий режим лечения психофармакологическими средствами во многом определяется особенностями их обмена в организме больного и фармакокинетическими параметрами. К последним относятся всасывание, распределение, биотрансформация и экскреция. Они определяют условия приема препарата и его дозирование.
При приеме лекарства внутрь всасывание осуществляется в желудке и(или) в кишечнике. Скорость всасывания зависит от лекарственной формы препарата (липофильности или липофобности, которые определяют проникновение лекарственных средств через клеточные мембраны), концентрации действующего вещества, состояния среды, в которой происходит растворение (кислотность желудочного и кишечного сока), а также от перистальтики кишечника, состояния и площади поверхности всасывания.
При внутримышечном введении препарат всасывается значительно быстрее, однако, если вещество связано со специальным носителем (часто с липофильным компонентом), то оно поступает в кровь постепенно в течение нескольких часов, дней и даже недель, обеспечивая поддержание одной и той же концентрации. На этом принципе основан эффект депонирования активного начала психофармакологических средств и лечения депо-препаратами.
Наиболее быстро препарат попадает в кровяное русло при внутривенном струйном и капельном введении. При этом, однако, повышается вероятность неожиданных побочных эффектов.
В некоторых случаях способ введения препарата несколько меняет характер его клинического действия.
Лекарственные вещества могут свободно растворяться в плазме (например, ионы лития) либо связываться с белками или клеточными элементами. Распределение лекарственного средства в мозге регулируется проницаемостью гематоэнцефалического барьера, мозговым кровотоком и сродством вещества к рецепторам нервных клеток. Показатель распределения вещества в мозговой ткани ухудшается при слишком плотном связывании его с белками крови, улучшается при усилении мозгового кровотока и высокой аффинности (сродстве) того или иного вещества к рецепторам. В последнем случае речь идет об избирательном распределении, ибо лекарственные вещества связываются с определенным типом рецепторов.
Показатели распределения препарата и его метаболитов в организме зависят от пола, возраста и соматического состояния больного.
Существует 4 основных пути биотрансформации лекарственных веществ в организме — окисление, восстановление, гидролиз и связывание (конъюгация). В этих процессах большую роль играет активность печеночных ферментов. Образующиеся метаболиты могут быть биологически активными и неактивными. У некоторых психотропных средств активные метаболиты в большей степени обеспечивают терапевтический эффект, нежели исходное вещество. Выделение метаболитов происходит с желчью, калом, мочой и значительно в меньшем количестве с потом, слюной, слезами, грудным молоком.
Скорость метаболизма зависит от многих факторов, в том числе генетических, и значительно варьирует у разных больных. Существуют так называемые быстрые и медленные метаболизеры. В связи с этим скорость обмена амитриптилина может варьировать от 6 до 30 ч. Скорость метаболизма у отдельных индивидуумов подвергается некоторым колебаниям в зависимости от состояния организма, времени суток и других причин, однако в целом индивидуальные особенности обмена веществ достаточно стабильны.
Метаболизм и выведение препарата из организма имеют 4 основных параметра: пик концентрации, период полужизни, эффект первичного печеночного прохода, клиренс.
Пик концентрации определяется преимущественно способом введения препарата. Период полужизни — это время, за которое метаболизируется половина введенного вещества (считая от пика концентрации). Период полужизни препарата обусловливает кратность его приема в течение суток. Важный фармакокинетический параметр — стабильная концентрация. Обычно время достижения стабильной концентрации совпадает со временем появления признаков терапевтического эффекта. Расчет времени стабильной концентрации производится следующим образом: если препарат дается повторно через интервалы времени, меньшие, чем период его полужизни, то стабильная концентрация достигается по истечении времени, равного пятикратному периоду полувыведения. Первичный печеночный проход — это начальный этап метаболизма препарата при его прохождении через портальную вену и систему кровоснабжения печени, т.е. до попадания в большой круг кровообращения. В результате этого обычно снижается количество неметаболизированного (исходного) препарата, поступающего в мозг. Клиренс — это количество вещества, выведенного в единицу времени. При отдельных заболеваниях или под влиянием некоторых лекарственных средств клиренс может уменьшаться, что приводит к кумуляции психотропного средства и увеличению его концентрации в крови (вплоть до токсической).
В последнее время особое внимание уделяется специфическим видам печеночных ферментов — цитохромам, участвующим в метаболизме психотропных средств. Известно, что существует генетически обусловленная гетерогенность цитохромов (например, цитохрома Р450), поэтому у больных с низкой активностью этих ферментов возможно неожиданное повышение концентрации препарата в крови, особенно в том случае, если больной принимает два лекарственных средства и оба метаболизируются одним ферментом.
Таким образом, режим дозирования психотропных препаратов зависит прежде всего от периода полужизни лекарственного средства в организме больного, наличия или отсутствия активных метаболитов и от скорости обменных процессов в целом.
Фармакодинамические характеристики. Фармакодинамические показатели свидетельствуют об активности рецепторных механизмов, степени зависимости терапевтического ответа от дозы (кривая терапевтического ответа). Они позволяют определить терапевтический индекс, толерантность к препаратам, а также возможность возникновения феномена зависимости и отмены.
Действие лекарства обусловлено его взаимодействием с рецептором. Оно может быть как агонистом, так и антагонистом рецептора, т.е. усиливать или блокировать его функцию. Большинство психотропных средств имеют сродство, т.е. аффинны, к рецепторам эндогенных нейротрансмиттеров. Лишь для некоторых из них своего рода рецепторами являются ферменты (литий связывается с ферментом инозитол-1-фосфатазой) и/или кальциевые канальцы (верапамил).
Кривая терапевтического ответа показывает соотношение дозы и терапевтического ответа лекарственного средства. Мощность препарата определяется относительной дозой, которая требуется для достижения первых признаков терапевтического ответа.
Побочные эффекты многих лекарственных средств являются прямым следствием их фармакодинамических характеристик. Терапевтический индекс показывает отношение терапевтического эффекта к побочным эффектам, выраженным в условных единицах.
Индивидуальная вариабельность реакции больного на психотропный препарат велика как в отношении общего фармакодинамического эффекта, так и в отношении терапевтической дозы. Больной может иметь нормальную, пониженную или повышенную чувствительность к препарату. В некоторых же случаях возможна и парадоксальная реакция на лечебное средство (например, психомоторное возбуждение при приеме бензодиазепинов).
Особого внимания заслуживает вопрос о плацебо-эффекте. Плацебо называют лекарственную форму, которая не имеет в своем составе действующего вещества. Плацебо-эффект обусловлен психотерапевтическим действием фармакотерапии. Обычно плацебо-эффект обеспечивает от 20 до 40 % эффективности препарата. Плацебо-эффект особенно важно учитывать при испытании новых лекарственных средств и оценке их терапевтической эффективности.
Что такое период полужизни лекарственного средства
К взаимодействию лекарств особенно восприимчивы пожилые люди; лица, принимающие много разных препаратов; пациенты с острым заболеванием (тяжелой анемией, недостаточностью левого желудочка, астматическим статусом, пневмонией), нестабильным состоянием (при эпилепсии, сахарном диабете, сердечной аритмии, деменции), зависимые от фармакотерапии (реципиенты с трансплантатами, лица с коллагенозом и болезнью Аддисона), страдающие серьезными почечными или печеночными патологиями (циррозом, застойной сердечной недостаточностью, уремией) и те, кому назначают лекарства сразу несколько врачей.
Многие люди в возрасте старше 65 лет одновременно принимают лекарства по поводу нескольких хронических болезней — зачастую до 8 препаратов в день, не считая средств, доступных без рецепта.
Симптомы, связанные с фармакогенным отравлением, нередко интерпретируют как признаки старения: дезориентация, тремор, сонливость, депрессия, забывчивость, потеря аппетита, запор и т. д.
Несоблюдение назначенной схемы приема лекарств во многих случаях объясняют непониманием важности терапии и инструкций по приему, частым введением высоких доз, высокой стоимостью лечения и отсутствием четких рекомендаций. Слабое зрение, неспособность прочесть правила применения лекарства, прием неправильно хранившихся препаратов, часто в темноте; резкое прекращение лечения без одобрения врача, перекладывания лекарств из фирменной упаковки в другую и несоблюдение мер предосторожности при пользовании опасными веществами — все это повышает вероятность нежелательных эффектов фармакотерапии у пожилых людей и их смертность от отравлений.

Пути проникновения токсинов в организм в порядке убывания частоты распределяются следующим образом: проглатывание, ингаляция, попадание в глаза и, наконец, на кожу. Большинство отравлений лиц в возрасте 60 лети старше непреднамеренные, и их можно предупредить посредством санитарного просвещения.
Лица пожилого возраста чаще всего страдают от неправильного применения бензодиазепинов, барбитуратов, три циклических антидепрессантов, салицилатов, ацетаминофена и небарбитуратных снотворных средств.
Взаимодействие лекарственных средств у пожилых. Взаимодействия лекарств в пожилом возрасте усиливаются из-за увеличения числа ежедневно принимаемых препаратов, изменения их фармакокинетики, долговременного потребления лекарств, изменения площади всасывающей поверхности кишечника, ослабления двигательной функции желудка и снижения кислотности, применения антацидов и веществ, конкурирующих за участки связывания с сывороточным альбумином, повышения доли жира в массе тела и снижения в ней доли воды, уменьшения размеров печени и ослабления ее способности метаболизировать лекарства, падения их почечного клиренса и повышения чувствительности рецепторов, особенно к сердечно-сосудистым и психотропным средствам.
Факторы риска назначения лекарств пожилым:
1. Несоблюдение правил приема — случайное (при хронической спутанности сознания), умышленное (при депрессии или непонимании важности назначенной схемы лечения) и связанное со стоимостью лекарств.
2. Применение сравнительно сильных средств (сердечных гликозидов) в большем количестве, чем в других возрастных группах.
3. Дыхание: физиологическая инволюция альвеол, курение, астма, неправильное питание или алкоголизм обусловливают гипоксию и гиперкапнию после приема седативных средств.
4. Сердечная проводимость: снижение числа пейсмекерных клеток, увеличение доли жира и соединительной ткани вокруг проводящей системы и атеросклероз венечных сосудов приводят к аритмиям. В связи с этим трициклические антидепрессанты, углеводороды и другие аритмогенные вещества в пожилом возрасте, как правило, переносятся хуже.
5. Кровообращение: функция левого желудочка и сосудистый гомеостаз могут быть нарушены, поэтому не исключено более сильное и продолжительное действие гипотензивных средств и центральных депрессантов на кровяное давление и тканевую перфузию.
Особенности всасывания лекарств у пожилых. Сокращение всасывающей поверхности, увеличение времени опорожнения желудка, ослабление кровотока, увеличение желудочного рН и ухудшение двигательной функции желудка изменяют всасывание пероральных препаратов в пожилом возрасте.
Важные моменты, подлежащие учету при назначении лекарств пожилым людям
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Токсикология»
Публикации в СМИ
Взаимодействие ЛС с этиловым спиртом и напитками, содержащими алкоголь
Алкоголь (этанол, этиловый спирт) и алкогольные напитки оказывают неблагоприятное влияние на фармакокинетику многих лекарственных средств (ЛС) в организме. Раздражая слизистую оболочку желудка, этиловый спирт и алкогольные напитки изменяют секрецию хлористоводородной (соляной) кислоты и могут задерживать эвакуацию содержимого желудка. А это в свою очередь может изменить всасывание ксенобиотиков (чужеродных соединений), в том числе и ЛС. Алкоголь может изменять также и распределение ЛС в организме, так как он не связывается белками плазмы крови и поэтому способен видоизменять фиксацию белков на лекарствах. А это в свою очередь может повысить их токсичность. Наиболее сильно алкоголь влияет на уровень метаболизма ЛС.
Алкоголь в организме, подвергаясь окислению и ацетилированию, почти полностью метаболизируется. Он может оказывать угнетающее действие на ферменты, в частности, на систему цитохрома Р-450, который участвует в метаболизме многих групп ЛС: анальгетиков, антигистаминных, антидепрессантов, седативных, снотворных, гипотензивных и др. Вследствие блокады алкоголем цитохром Р-450 зависимой микросомальной этанолокисляющей системы концентрация в плазме крови лекарств увеличивается, удлиняется период их полужизни, что способствует усилению фармакологического, а также токсического или нежелательного действия препаратов. При дальнейшем введении алкоголя у страдающих хроническим алкоголизмом или при острой форме алкогольной интоксикации возникает адаптация (привыкание) организма и увеличение в матриксе митохондрий содержания гемопротеинов (цитохромов Р-450). Ускоряется окисление этанола на 50–70% за счет гипертрофии эндоплазматического ретикулума и индукции цитохрома, изменяется фармакокинетика и фармакодинамика ЛС.
Фармакологические эффекты антипсихотических средств, антидепрессантов, снотворных и многих других ЛС, действующих на ЦНС, могут изменяться при совместном их применении с алкоголем или алкогольсодержащими напитками, а также при применении их хроническими алкоголиками, об этом желательно помнить.
Взаимодействие ЛС с алкоголем или препаратами, содержащими этанол (этиловый спирт)
Барбитураты: фенобарбитал, снотворные средства (нитрозепам, зопиклон, золпидем и др.)
Потенцирование угнетающего действия на ЦНС
Нарушается концентрация внимания
Противоэпилептические средства (вальпроевая кислота, карбамазепин)
Усиление угнетения ЦНС
Ингибиторы МАО угнетают метаболизм алкоголя
Опасная комбинация с возможным летальным исходом
Клонидин (клофелин, гемитон)
Резкое падение артериального давления, снижение психомоторной реакции, усиление депрессивного эффекта. Угнетение жизненно важных центров продолговатого мозга (дыхательного и сосудодвигательного)
Прием алкоголя на фоне лечения приводит к коллапсу, нередко возникает тяжелое отравление, которое может закончиться смертельным исходом
Противопаразитарные средства (Левамизол, Декарис) с иммуностимулирующими), Никлозамид (фенасал)
Антабусоподобная реакция 1
Усиление нежелательных побочных реакций никлозамида
Потенцирование угнетающего действия на ЦНС
Н1-гистаминоблокаторы (димедрол, супрастин, тавегил, диазолин и др.) и стабилизатор мембран тучных клеток кетотифен (задитен)
Усиление угнетающего действия на ЦНС
Развитие дисульфирамоподобной реакции 1
Дисульфирамоподобная реакция 1
Повышение риска поражения печени
У лиц, злоупотребляющих алкоголем, снижается эффективность лечения противотуберкулезной терапии
Метронидазол, тинидазол, трихомоноцид
Тетурамоподобный эффект 1
Противогрибковые препараты (кетоконазол, гризеофульвин) Тербинафин (ламизил, экзифин)
Возможно развитие дисульфирамоподобной реакции 1
Повышение риска гепатотоксичности
1 Название дисульфирамоподобная реакция, антабусоподобная реакция или тетурамоподобный эффект происходят от фармакологических эффектов под действием ЛС для лечения хронического алкоголизма Дисульфирама (синонимы: Тетурам, Антабус). При применении этих ЛС блокируется фермент альдегиддегидрогеназа, накапливается токсичный ацетальдегид, возникает чувство страха, озноб или жар, затрудняется дыхание, усиливается сердцебиение. Возникает ощущение нехватки воздуха, падение артериального давления, больного мучает неукротимая рвота.
Код вставки на сайт
Взаимодействие ЛС с этиловым спиртом и напитками, содержащими алкоголь
Алкоголь (этанол, этиловый спирт) и алкогольные напитки оказывают неблагоприятное влияние на фармакокинетику многих лекарственных средств (ЛС) в организме. Раздражая слизистую оболочку желудка, этиловый спирт и алкогольные напитки изменяют секрецию хлористоводородной (соляной) кислоты и могут задерживать эвакуацию содержимого желудка. А это в свою очередь может изменить всасывание ксенобиотиков (чужеродных соединений), в том числе и ЛС. Алкоголь может изменять также и распределение ЛС в организме, так как он не связывается белками плазмы крови и поэтому способен видоизменять фиксацию белков на лекарствах. А это в свою очередь может повысить их токсичность. Наиболее сильно алкоголь влияет на уровень метаболизма ЛС.
Алкоголь в организме, подвергаясь окислению и ацетилированию, почти полностью метаболизируется. Он может оказывать угнетающее действие на ферменты, в частности, на систему цитохрома Р-450, который участвует в метаболизме многих групп ЛС: анальгетиков, антигистаминных, антидепрессантов, седативных, снотворных, гипотензивных и др. Вследствие блокады алкоголем цитохром Р-450 зависимой микросомальной этанолокисляющей системы концентрация в плазме крови лекарств увеличивается, удлиняется период их полужизни, что способствует усилению фармакологического, а также токсического или нежелательного действия препаратов. При дальнейшем введении алкоголя у страдающих хроническим алкоголизмом или при острой форме алкогольной интоксикации возникает адаптация (привыкание) организма и увеличение в матриксе митохондрий содержания гемопротеинов (цитохромов Р-450). Ускоряется окисление этанола на 50–70% за счет гипертрофии эндоплазматического ретикулума и индукции цитохрома, изменяется фармакокинетика и фармакодинамика ЛС.
Фармакологические эффекты антипсихотических средств, антидепрессантов, снотворных и многих других ЛС, действующих на ЦНС, могут изменяться при совместном их применении с алкоголем или алкогольсодержащими напитками, а также при применении их хроническими алкоголиками, об этом желательно помнить.
Взаимодействие ЛС с алкоголем или препаратами, содержащими этанол (этиловый спирт)
Барбитураты: фенобарбитал, снотворные средства (нитрозепам, зопиклон, золпидем и др.)
Потенцирование угнетающего действия на ЦНС
Нарушается концентрация внимания
Противоэпилептические средства (вальпроевая кислота, карбамазепин)
Усиление угнетения ЦНС
Ингибиторы МАО угнетают метаболизм алкоголя
Опасная комбинация с возможным летальным исходом
Клонидин (клофелин, гемитон)
Резкое падение артериального давления, снижение психомоторной реакции, усиление депрессивного эффекта. Угнетение жизненно важных центров продолговатого мозга (дыхательного и сосудодвигательного)
Прием алкоголя на фоне лечения приводит к коллапсу, нередко возникает тяжелое отравление, которое может закончиться смертельным исходом
Противопаразитарные средства (Левамизол, Декарис) с иммуностимулирующими), Никлозамид (фенасал)
Антабусоподобная реакция 1
Усиление нежелательных побочных реакций никлозамида
Потенцирование угнетающего действия на ЦНС
Н1-гистаминоблокаторы (димедрол, супрастин, тавегил, диазолин и др.) и стабилизатор мембран тучных клеток кетотифен (задитен)
Усиление угнетающего действия на ЦНС
Развитие дисульфирамоподобной реакции 1
Дисульфирамоподобная реакция 1
Повышение риска поражения печени
У лиц, злоупотребляющих алкоголем, снижается эффективность лечения противотуберкулезной терапии
Метронидазол, тинидазол, трихомоноцид
Тетурамоподобный эффект 1
Противогрибковые препараты (кетоконазол, гризеофульвин) Тербинафин (ламизил, экзифин)
Возможно развитие дисульфирамоподобной реакции 1
Повышение риска гепатотоксичности
1 Название дисульфирамоподобная реакция, антабусоподобная реакция или тетурамоподобный эффект происходят от фармакологических эффектов под действием ЛС для лечения хронического алкоголизма Дисульфирама (синонимы: Тетурам, Антабус). При применении этих ЛС блокируется фермент альдегиддегидрогеназа, накапливается токсичный ацетальдегид, возникает чувство страха, озноб или жар, затрудняется дыхание, усиливается сердцебиение. Возникает ощущение нехватки воздуха, падение артериального давления, больного мучает неукротимая рвота.