Что такое периодическая система
Периодическая система элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от массового числа атомов (или их атомной массы). Всего предложено несколько сот [1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Содержание
История открытия
К середине XIX века были открыты почти 60 химических элементов, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий, хлор, бром и йод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества); ещё ранее (февраль 1869 г.) научное извещение об открытии было им разослано ведущим химикам мира.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов, празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которая со временем была несколько усовершенствована.
Научная достоверность Периодического закона получили подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. Седьмой период периодической системы до сих пор не завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Структура периодической системы
Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
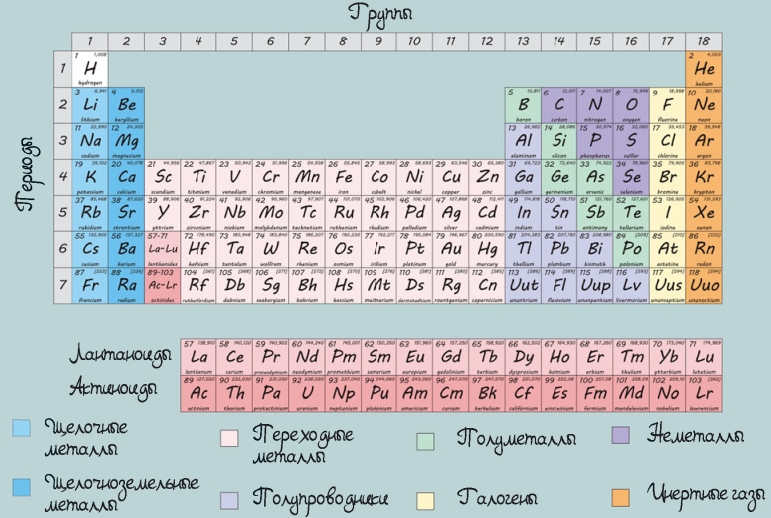
Периодическая система химических элементов Менделеева
Химические элементы являются «строительными блоками» любого вещества на нашей планете. Отличительной особенностью любого элемента является тот факт, что к нему относятся атомы только одного вида.
Атомный номер
Очень важной характеристикой элемента является его атомный номер. Этот номер соответствует числу протонов каждого атома. Например, у кислорода 8 протонов, поэтому его атомный номер равен 8. Количество протонов серебра — 47, в связи с этим и атомный номер серебра равен 47.
Разные формы элемента
Несмотря на то что элементы включают атомы одного вида, они могут находиться в разных формах. На это влияет не только температура, но и связь атомов в молекуле. В химии такое явление, т.е. существование одного и того же элемента в двух или более формах, называется аллотропия.
Группа инертных газов
Химические элементы со схожими свойствами объединяются в группы. Например, газы без цвета, вкуса и запаха, с крайне низкой химической активностью входят в группу инертных газов. Это аргон, неон, гелий, криптон, ксенон и радон. Внешние электронные оболочки их атомов заполнены целиком, поэтому инертные газы могут участвовать лишь в ограниченном количестве химических реакций. Этим и объясняется их низкая активность.
Группа щелочных металлов
Металлы, на внешней оболочке атомов которых находится всего один электрон, проявляют высокую химическую активность. Калий, натрий, литий и другие входят в группу щелочных металлов. Выделяют также группы щелочноземельных, переходных и постпереходных металлов, полуметаллов и неметаллов, галогенов и др.
Что такое периодическая система элементов?
Периодическая система элементов представляет собой таблицу, в которой каждый элемент помещен в специальную ячейку в зависимости от структуры его атома. Как и в любой таблице, в периодической системе элементов есть строки, идущие слева направо, и столбцы, расположенные сверху вниз. У каждых строки и столбца — свои характеристики, при этом все элементы распределены в соответствии со своими атомными номерами, которые равны количеству протонов в атомах.
Почему таблица называется периодической?
Таблица называется периодической, поскольку все ее элементы представлены в так называемых периодах.
Период — это строка таблицы, где элементы расположены в порядке увеличения зарядов их ядер.
В системе семь периодов. Первый — самый малый: в нем содержатся только два элемента — водород и гелий, а в шестом и седьмом их по 32.
Многие химические элементы были открыты к середине XIX в. Однако к тому времени еще не существовало единой системы, при помощи которой можно было бы объяснить свойства всех известных на тот момент элементов. К концу 60-х гг. XIX в. русский ученый Д.И. Менделеев проанализировал всю имеющуюся информацию и пришел к выводу, что свойства химических элементов и образуемых ими веществ зависят от атомной массы элементов. В 1869 г. он разработал периодическую систему химических элементов, расположив их в порядке возрастания атомных масс.
Группы элементов
Вертикальные колонки (столбики) в периодической системе называются группами. Всего таких колонок 18. У элементов, находящихся в каждом столбике, сходные конфигурации электронов.
Давай рассмотрим две группы: крайнюю слева и крайнюю справа. Крайняя слева группа — щелочные металлы. Они объединены в эту группу, так как на их внешней оболочке находится лишь 1 электрон, и все эти элементы обладают повышенной химической активностью.
Крайняя группа справа — инертные, или благородные, газы, внешняя оболочка которых целиком заполнена электронами. Именно этот показатель говорит о химической стабильности элементов правой группы.
Наименования и произношение символов химических элементов нужно выучить наизусть! Например: железо — Ferrum (символ элемента — Fe) произносится как «феррум», золото — Aurum (символ — Аи) произносится как «аурум», медь — Cuprum (символ — Си) произносится как «купрум».
Символы элементов
Каждый элемент периодической системы имеет наименование и символ, которые признаны Международным союзом теоретической и прикладной химии и понятны всем, кто занимается или интересуется химией.
Как правило, химические элементы обозначаются первой буквой их латинского названия. Например, водород на латыни именуется hydrogenium, поэтому химический элемент получил символ Н. А если названия нескольких элементов начинаются на одну и ту же букву, то в символе указывается еще одна буква, имеющаяся в названии этого элемента, например ртуть (hydrargyrum) — Hg.
Что можно узнать о каждом элементе из таблицы?
В таблице каждый элемент занимает определенную ячейку, в которой представлена следующая информация: название элемента, его символ, порядковый номер, а также относительная атомная масса.
Наименования, их произношение и знаки химических элементов нужно выучить наизусть! Например:
Металлы
Почти две трети химических элементов периодической системы являются металлами. Они отличаются высокими тепло- и электропроводностью, пластичностью, ковкостью и характерным металлическим блеском. Все эти свойства присущи металлам благодаря свободному перемещению электронов в кристаллических решетках.
Неметаллы
Неметаллы считаются самыми распространенными элементами не только в земной коре, но и в живых организмах, атмосфере и в целом во всей Вселенной. В основном все неметаллы расположены в правой верхней части периодической системы.
Все неметаллы проявляют типично неметаллические свойства:
Периодическая система химических элементов
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен [1] вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Содержание
История открытия
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и иод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества); ещё ранее (февраль 1869 г.) научное извещение об открытии было им разослано ведущим химикам мира.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, описал целый ряд физических и химических свойств.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Структура периодической системы
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
| Группа → Период ↓ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | 1 H | 2 He | ||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe |
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Fl | 115 Uup | 116 Lv | 117 Uus | 118 Uuo |
| 8 | 119 Uue | 120 Ubn | *** | |||||||||||||||
| Лантаноиды * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||
| Актиноиды ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |||
| Суперактиноиды *** | 121 Ubu | 122 Ubb | 123 Ubt | 124 Ubq | 125 Ubp | 126 Ubh | ||||||||||||