Что такое периорбитальная отечность
Некоторые считают, что мешки под глазами являются только косметической проблемой, однако причин припухлостей на лице довольно много.
Чтобы было понятно, почему возникают мешки под глазами, нужно немного остановиться на анатомических особенностях глазницы. Само глазное яблоко является хрупким органом, который нуждается в постоянной защите. В связи с этим со всех сторон глаз окружен слоем жировой ткани, который защищает его и обладает амортизирующим свойством. Эта периорбитальная клетчатка отделена от кожи век только тонким слоем соединительной ткани. Эта мембрана предотвращает проникновение содержимого глазницы за ее пределы.
Причины появления мешков под глазами
Мешки под глазами появляются при снижении эластичности мембраны, в результате чего снижается ее прочность, а содержимое глазницы выбухает с образованием грыжевого мешка.
Не так давно была доказана другая теория, которая связывает появление мешков под глазами с увеличением количество самой клетчатки. Из-за этого она также выпячивается за пределы глазницы. Если бы эта клетчатка не накапливала в себе жидкость, то она была бы не столь заметна.
За счет отеков объем жировой прослойки вокруг глаза значительно увеличивается, что приводит к формированию грыжевого выпячивания. Причины отеков включают излишнее употребление соли, значительную инсоляцию (кожа накапливает влагу, защищаясь от иссушения), переутомление глаз.
Если мешки под глазами появились из-за задержки жидкости, то к вечеру они обычно становятся менее заметными. Это связано с тем, что в период бодрствования активизируется лимфоотток и кровообращение. В результате избыток жидкости удаляется из верхних отделов тела.
Если в течение суток величина мешков под глазами остается неизменной, то причиной является разрастание клетчатки. Нередко это состояние носит наследственный характер. При этом кожа в этой области приобретает более темный оттенок.
У пожилых пациентов эластичность кожи также снижена, а количество клетчатки вокруг глаза постепенно увеличивается. Кроме того, у пациентов этого возраста имеется больше факторов риска, приводящих к задержке жидкости.
Заболевания, при которых появляются мешки под глазами
Почечная недостаточность
Первое, что нужно исключить у пациента с мешками под глазами, это заболевание почек. При этом отеки нарастают стремительно (в течение нескольких часов). Другими симптомами являются лихорадка, слабость, боль в пояснице, изменение характера мочи (прозрачность, количество, цвет). Все эти признаки характеризуют воспалительные заболевания почек, которые возникают при цистите, ангине, простуде.
Также к отекам приводит потеря альбумина с мочой. Этот белок растворен в крови и удерживает жидкость в кровеносном русле. В норме альбумин не проникает через мембрану почечных канальцев, но при патологии этот барьер становится более проницаем, и крупные молекулы белка попадают в мочу. Диагностируют заболевание на основании данных анализа мочи и УЗИ почек. Нередко это сопровождается артериальной гипертензией.
Синусит
При воспалении околоносовых пазух также может развиться отек клетчатки. Пазухи эти располагаются в костных структурах черепа и связаны с полостью носа. При этом появляются и другие симптомы заболевания: насморк, боль в проекции пазух, головная боль, повышение температуры. Причиной воспаления может быть вирусная или бактериальная инфекция. Для постановки диагноза нужно не только осмотреть пациента, но и выполнить рентгеновское исследование. При этом может быть выявлен гайморит, фронтит или же синусит.
Аллергия
Аллергические заболевания также часто сопровождаются отеком глаз. При конъюнктивите причиной аллергии нередко становятся различные вещества, которые приводят к покраснению слизистой оболочки и отеком глаза. Также возникает зуд и раздражение. У многих пациентов имеется сезонный характер этих изменений, который связан с цветением растений. Важно как можно скорее завершить контакт с аллергеном и обратиться к специалисту для проведения лечения.
Конъюнктивит
Воспаление конъюнктивы может быть связано не только с аллергической реакцией, но также с инфекцией или химическим раздражением. Обычно бактерии попадают на поверхность конъюнктивы при нарушении правил гигиены, через загрязненные предметы и руки. Раздражение слизистой глаза вызывают также факторы внешней среды (дым, пыль). Чтобы установить причину воспаления, нужно посетить окулиста.
Отек Квинке
Острый отек аллергической природы (отек Квинке) выделяют в отдельную группу, так как состояние это довольно опасное. Эта реакция развивается стремительно и нередко угрожает жизни пациента. Симптомами отека Квинке являются сухой кашель, отек шеи и лица, одышка и затруднение вдоха, которые возникли после контакта с предполагаемым аллергеном. При появлении таких симптомов следует незамедлительно вызвать скорую помощь, так как отек распространяется не только на подкожную клетчатку, но также на слизистые оболочки и фасции.
При этом в кровь выделяются вещества, значительно увеличивающие проницаемость стенки сосуда для белка и жидкости. За счет отека стенки бронхов, дызательные пути значительно сужаются, что затрудняет дыхание. Нередко причиной отека Квинке становится укус насекомого (оса, пчела).
Острые вирусные инфекции с поражением дыхательных путей тоже могут вызывать отек периорбитальной клетчатки и конъюнктивы. При этом характерными симптомами ОРВИ являются насморк, конъюнктивит, лихорадка, боль в горле. Чаще глаза поражаются при аденовирусной инфекции.
Гипотиреоз связан с дефицитов тиреоидных гормонов в крови пациента. Симптомами заболевания являются отеки рук, лица, клетчатки внутренних органов, замедление метаболических процессов, что приводит к ожирению, снижении внимания и памяти, брадикардии, сухости кожи и волос. В запущенных случаях формируется микседема (отек подкожной клетчатки и кожи). Для подтверждения диагноза нужно провести УЗИ щитовидной железы, анализ на тиреоидные гормоны. Лечение проводят путем заместительной терапии.
Сердечная недостаточность
В том случае, когда появление мешков под глазами сопровождается одышкой, болью в сердце, периферическими отеками, то причина может рыться в сердечной недостаточности. Если нарушена работа сердца, то весь организм страдает от нехватки питательных веществ и кислорода. Сначала отеки формируются на ногах, а затем распространяются в другие ткани и органы. Отеки лица являются признаком анасарки, которая угрожает жизни пациента и является крайним проявлением сердечной недостаточности. Для подтверждения диагноза нужно выполнить УЗИ сердца, ЭКГ и ряд других исследований.
У мужчин и женщин частота развития отеков под глазами примерно одинаковая, однако у детей этот симптом возникает редко, поэтому в ряде случаев остается незамеченным.
Мешки под глазами у ребенка
Мешки под глазами у детей не всегда связаны с заболеванием. В норме этом может возникать при длительном плаче или крике малыша, при чрезмерном употреблении воды или соли, после сна.
Если отеки под глазами у ребенка носят физиологический характер, то они проходят самостоятельно в течение нескольких часов. Также мешки под глазами могут стать симптомом разных заболеваний. В следующих случаях нужно показать ребенка педиатру:
Мешки под глазами у беременных
При беременности мешки под глазами могут появляться в норме. Это связано с задержкой жидкости и соли в организме. Избыток воды откладывается в подкожной клетчатке, что также сопровождается повышенной влажностью кожи и прибавкой веса.
Однако этот симптом также появляется при гестозе, патологии почек и других патологиях беременных. В связи с этим желательно вовремя показаться гинекологу, чтобы исключить грозные и опасные состояния.
Лечение мешков под глазами
В домашних условиях справиться с мешками по глазами можно только при физиологическом отеке клетчатки. Для этого используют нормализацию режима дня, уменьшение количества потребляемой соли и воды, отказ от вредных привычек, употребление витаминов, минералов, клетчатки.
Некоторые косметические средства также помогают устранить отеки глаз. К ним относят холодные или горячие компрессы с настоем трав (фенхель, чай, шалфей, укроп, ромашка). Также помогает самомассаж лица и упражнения, укрепляющие мышцы. Наиболее радикальным методом лечения является блефаропластика, при которой врач хирургическим путем удаляет грыжевые выпячивания.
Однако, без рекомендации врача нельзя применять никакие лекарства, так как это может привести к необратимым и весьма серьезным последствиям. Например, употребление мочегонных средств приводит к нарушению баланса микроэлементов (калий, магний, натрий), что затрудняет работу сердца.
Грыжевое выпячивание окологлазной клетчатки не сопровождается болевыми ощущениями, однако они значительно ухудшают внешний вид. Однако, если причина этого состояния связана с заболеванием организма, то нужно обратиться к врачу. Поздняя диагностика зачастую негативным образом сказывается на здоровье пациента.
К какому врачу обратиться при мешках под глазами?
Чтобы точно ответить на этот вопрос, нужно провести хотя бы минимальное обследование. Обычно помимо косметолога, нужно посетить терапевта, который назначить необходимые анализы и направит к узким специалистам в случае необходимости.
Что такое периорбитальная отечность
Борзых Ольга Борисовна
К.м.н., врач дерматовенеролог, косметолог, научный сотрудник ЦКП «Молекулярные и клеточные технологии» КрасГМУ, Country Expert Teoxane Russia, Воронеж
Периорбитальная область продолжает быть в центре внимания врачей-косметологов, так как, с одной стороны, это один из популярных запросов со стороны пациентов, а с другой — остается много неразрешенных вопросов относительно выбора техник или препаратов. В данной статье я предлагаю несколько расширить фокус нашего внимания и обсудить коррекцию не только подглазничной борозды, но и других областей вокруг глаз — височной области, области лба, средней трети, так как все эти зоны могут влиять на процесс старения в периорбитальной области [1].
Но прежде всего нужно понять, какая цель эстетической коррекции стоит при работе с возрастными изменениями. Цель большинства пациентов — коррекция возрастных проявлений, но без следов вмешательств, при этом наиболее частым опасением пациентов является неестественность результатов, контурирование препарата, отечность в периорбитальной области. По моему мнению, помочь достичь лучшего результата и естественной коррекции возможно, правильно выбрав показания и технику выполнения процедуры, основываясь на подходе Teoxane.
Подход Teoxane был разработан для получения максимально эффективного и естественного результата эстетического лечения с соблюдением безопасности инъекционных процедур. Работая с подходом Teoxane, мы всегда следуем трем основным пунктам (А-Т-П) — анатомия (включая оценку процесса старения и показаний у пациента), техника и выбор препаратов.
Анатомия
Анатомическим особенностям области вокруг глаз недостаточно одной статьи и даже одной книги, поэтому я предлагаю остановиться лишь на некоторых анатомических аспектах, необходимых при работе.
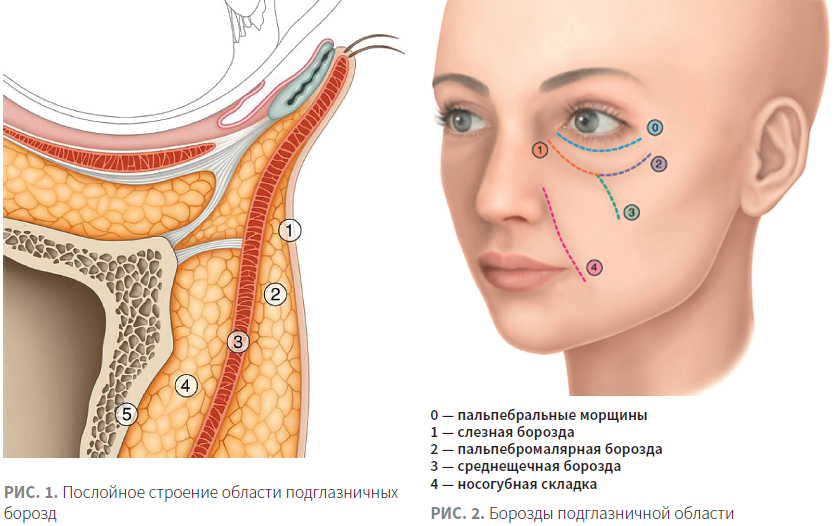
Говоря об области под глазами, в первую очередь необходимо понимать особенности послойного строения зоны нижнего края орбиты (рис. 1) [2].
При работе в этой области выделяют (рис. 2) [3]:
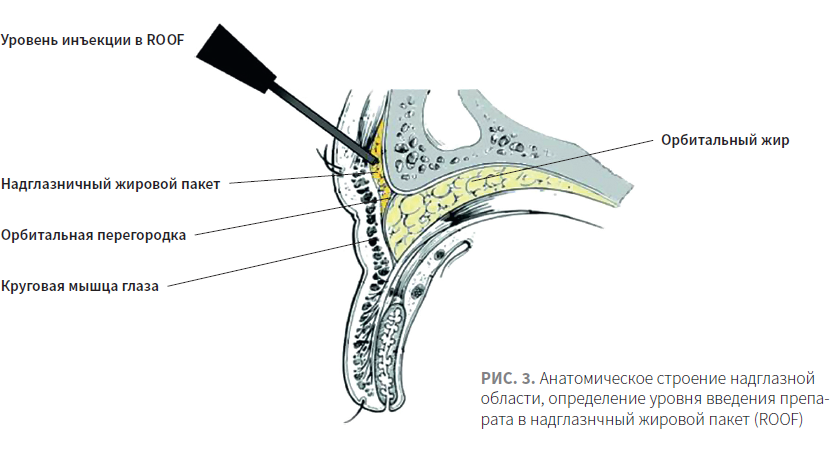
В надглазничной области пятислойное строение сохраняется, но, в отличие от подглазничной области, кожа более толстая, подкожно-жировая клетчатка полноценна, глубокий жировой пакет представлен надглазничным жировым пакетом (ROOF) (рис. 3) [4].
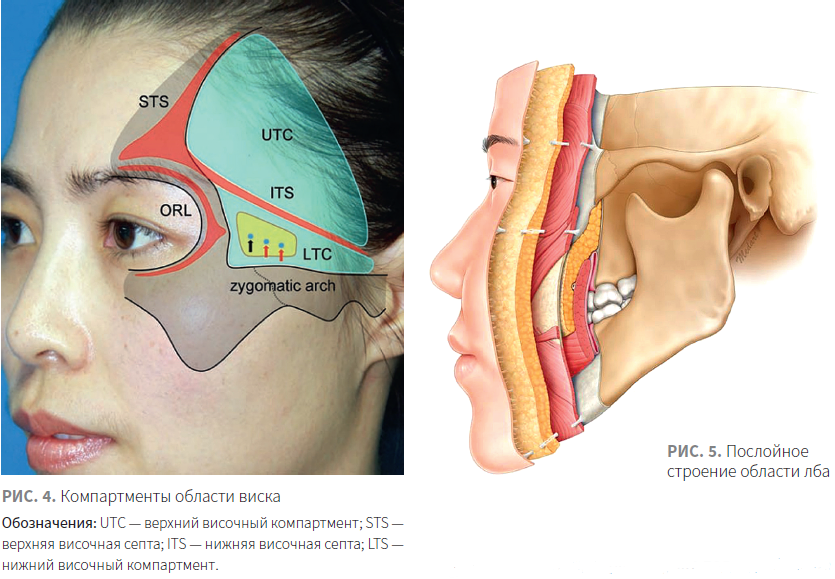
Височная область — это область, где остается много вопросов относительно анатомического строения. Что касается количества слоев тканей в этой области, большинство экспертов считает, что в ней можно выделить 10 слоев.
Важнее в этой области обозначить зоны более безопасные и зоны осторожности (рис. 4) [5]. Так, более безопасным компартментом является верхний височный компартмент (UTC), расположенный между височным гребнем (верхняя височная септа — STS) и нижней височной септой (ITS), в нижнем височном компартменте (LTS) расположены кровеносные сосуды и нервы.

Более безопасным уровнем является слой глубоких жировых пакетов под SMAS, основные сосуды выше линии безопасности (она проходит на 2 см выше костного края орбиты) находятся в поверхностном жировом слое, ниже линии — в глубоком.
В области среднещечной борозды также сохраняется пятислойность: кожа, поверхностные и глубокие жировые пакеты, SMAS, надкостница [7–9]. Основным уровнем при работе с волюмайзерами является уровень глубоких жировых пакетов (медиальный глубокий подглазничный жировой пакет и глубокий медиальный скуловой жировой пакет), при выраженных возрастных изменениях целью коррекции также является поверхностный медиальный жировой пакет.
Кроме анатомии, первый пункт подхода Teoxane предполагает понимание процессов старения в разных слоях:
В результате всех этих процессов мы видим дефициты объема в области верхней и средней трети лица, а также птоз бровей, верхнего века, проявление борозд подглазничной области, появляющихся в результате потери поддержки вышележащих структур.
Таким образом, существует связь между дефицитами объема и птозом тех или иных структур, следовательно, восполнение потерянного объема будет уменьшать проявления птоза.
И последнее, но не менее значимое, на что мы обращаем внимание при работе с подходом Teoxane в первом пункте — это оценка пациента. На самом деле, правильно определенные показания, сделанные на основании жалоб и осмотра пациента, имеют большое значение на пути к идеальной эстетической коррекции периорбитальной области.
При этом важно, чтобы пациент сам указал на зоны, которые ему в себе не нравятся, так как у каждого человека есть свои представления о красоте, и неправильно определенные и скорректированные врачом зоны у пациента могут дать неудовлетворительный результат после процедуры. Если наш пациент не может определиться с волнующими его областями, вы можете дать ему в руки зеркало и «познакомить с собой».
Выбор техники

При работе с верхней и средней третью лица мы должны помнить о расположении угловой артерии (во внутреннем углу глаза), выходе подглазничного и надглазничного сосудисто-нервного пучков (по среднезрачковой линии), супратрохлеарного (на 1 см медиальнее надглазничного), скулового (на 1 см ниже латерального костного края орбиты), расположения поперечной артерии (по нижнему краю скуловой дуги) и височных сосудов (чаще всего визуализируются на лице пациента).
Из линий безопасности нас интересуют среднещечная линия и линия в проекции большой скуловой мышцы — безопаснее работать в верхнелатеральном квадранте при пересечении этих линий. В височной области линия безопасности проходит между козелком и латеральным краем орбиты — отграничивает верхний височный компартмент. В области лба линия безопасности находится на 2 см выше костного края орбиты.
При аугментации области лба мы можем использовать канюлю или иглу. Введение препарата осуществляется на SMAS, перед процедурой важно отметить участки дефицита объема, а также при работе с канюлей определяют точки вкола (между видимыми сосудами) (рис. 7). При работе с канюлей можно использовать одну (при более уплощенной области лба) или 2 точки вкола (при более округлой), более безопасной является канюля 25G, канюля 22G имеет меньший диаметр и приближается по остроте к игле. Препарат распределяется веерно, ретроградной техникой. Зона под SMAS требует распределяемого, динамичного препарата со средними показателями G’, о выборе препарата поговорим в следующем пункте.
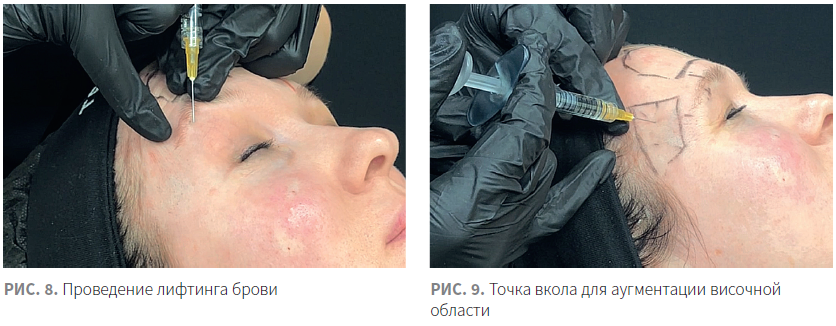
Для лифтинга брови используется точка вкола, расположенная под бровью, латеральнее среднезрачковой линии. Препарат располагается нанадкостнично, в области глубокого надглазничного жирового пакета (ROOF) (рис. 8). Обычно при выполнении данной техники я приподнимаю бровь и использую небольшой болюс препарата (0,2 мл) с высоким G’.
При работе с височной областью более безопасно введение препарата глубоко (под височную мышцу) в верхнем височном компартменте. Точка вкола для техники shot gun находится на 1 см ниже височного гребня и 1 см над латеральным костным краем орбиты (рис. 9). Процедура проводится иглой, безопаснее длиной 25 мм (более короткая игла может не до конца находиться на кости). Вкол осуществляется между видимыми сосудами, до касания кости, затем иглу необходимо наклонить, так чтобы отверстие иглы было максимально приближено к кости. Препарат будет распределяться между волокнами височной мышцы, так как мышца прочно прикреплена к кости и под ней нет пространства. Из-за особенностей расположения препарата требуется препарат с максимальным G’ и показателем когезивности.
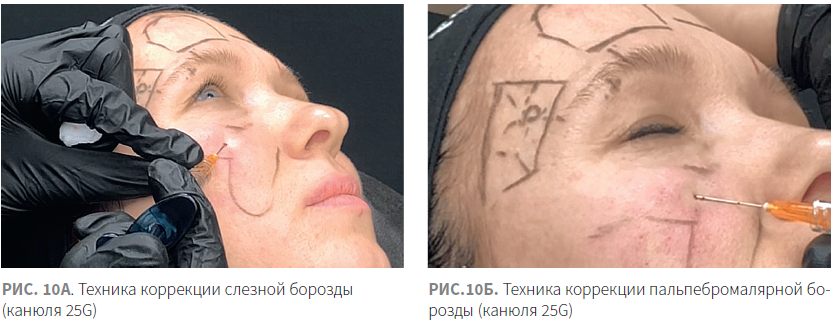
При работе с подглазничными бороздами инъекции осуществляются строго в области дефицита объема, в случае работы с канюлей можно выбрать одну точку вкола между слезной и пальпебромалярной бороздой, обходя проекцию подглазничного отверстия (рис. 10А, Б). При работе с канюлей безопаснее выбирать канюли большего диаметра (25G, 22G). Введение препарата осуществляется под круговую мышцу глаза. Учитывая сложное и деликатное анатомическое строение подглазничной области следует максимально тщательно выбирать препарат по вязко-эластическим свойствам.
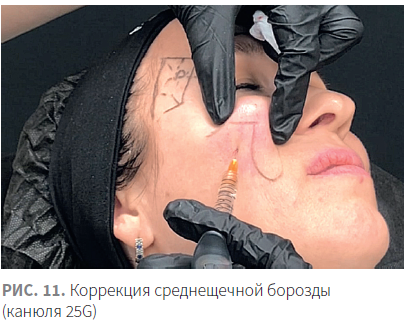
У пациентов средней возрастной группы, у молодых, при начальных проявлениях дефицита объема в области среднещечной борозды в патогенезе возрастных изменений, как правило, задействованы только глубокие жировые пакеты, поэтому у них введение волюмайзера осуществляется только на уровень медиального подглазничного жирового пакета или на уровень глубокого медиального жирового пакета.
У более возрастных пациентов присоединяется потеря объема на уровне поверхностного медиального жирового пакета, поэтому для полноценного результата необходима мультилеерная техника коррекции средней трети, о чем мы упоминали в статье [10].
При работе с иглой болюсы препарата располагаются нанадкостнично, латеральнее и выше линий безопасности. При работе с канюлей точка вкола расположена латеральнее среднещечной линии и канюля проходит на уровне глубоких жировых пакетов. Для удобства можно второй рукой поднять ткани и под ними пройти в области медиального подглазничного жирового пакета и медиального глубокого скулового пакета (рис. 11).
Выбор препарата
Иногда выбору препарата не уделяют должного внимания, в итоге повышаются риски неестественного результата коррекции, получения низкой эффективности проведенной коррекции, контурирования и отечности, особенно в периорбитальной области. Важно понимать, что каждая зона и каждый слой тканей могут требовать разных вязко-эластических свойств препаратов. О реологических свойствах препаратов мы уже говорили достаточно большое число раз [11, 12]. Давайте остановимся подробнее на выборе препаратов исходя из анатомических особенностей каждой области.
При аугментации лба пространство под SMAS достаточно небольшое, над ним нет большого количества тканей, поэтому давление, оказываемое на введенный препарат относительно невысокое, но при этом зона мимически активна (подвижна), поэтому необходим упругий препарат, со средним показателем G’, способный к растяжению. Такими свойствами (табл. 1) обладают препараты Teosyal ® RHA2 и Teosyal ® RHA3. Teosyal ® RHA — это коллекция динамичных филлеров, способных к растяжению и, как результат, максимально адаптированных к динамике лица. При их использовании мы получаем максимальную эффективность в области введения при максимальной естественности результата. При более тонкой коже, тонких мягких тканях и небольшом дефиците объема наиболее подходящим препаратом является Teosyal ® RHA2, при большей толщине, необходимости объема — Teosyal ® RHA3. Я в своей практике иногда использую Teosyal ® RHA4, но только в случае большой толщины мягких тканей и выраженной потери объема в области лба, когда нужны большие волюмизирующие способности препарата при сохранении его упругих свойств. При этом препарат следует вводить максимально деликатно, не допуская гиперкоррекции.
Таблица 1. Сравнительная характеристика препаратов Teosyal ® RHA2 и Teosyal ® RHA3
Teosyal ® RHA2
Teosyal ® RHA3
Идиопатическое воспаление орбиты и глюкокортикостероиды как первая линия терапии: обзор литературы

Воспаление в глазницах может возникать в качестве локальных проявлений системных заболеваний, при инфекционных и неопластических процессах, а также идиопатически. Для разработки новых протоколов ведения пациентов с идиопатическим воспалением орбиты требуе
Abstract. Orbital inflammation may occur as local manifestation of systemic disease, in infections, neoplasms and as idiopathic process. DDx of orbital inflammation is challenging due to low occurrence in general population, isolated anatomy of orbit and various etiologic factors. Idiopathic orbital disease is the diagnosis of exclusion. This is a narrative review of the literature with 30 references. PubMed, Google Scholar and eLIBRARY were used with keywords orbital pseudotumor, idiopathic orbital inflammation, and orbital inflammatory disease. Orbital inflammation may occur in sarcoidosis, Wegener’s granulomatosis, Crohn disease, systemic lupus erythematosus, IgG4-related disease, Churg-Strauss syndrome, Erdheim–Chester disease, histiocytosis X and giant cell arteritis. Despite of numerous studies, there is no unified treatment protocol. Many strategies with steroid treatment are suggested. Other treatment modalities include radiation therapy, nonsteroidal anti-inflammatory drugs, immunosuppressive agents and surgery. Oral steroid therapy with a slow taper was defined as first-line therapy even considering controversy of the study results. Russian clinicians prefer local steroid injections. Development of new therapeutic modalities requires more fundamental comprehension of the disease and collaboration with other medical specialists, especially rheumatologists and transplantologists.
Резюме. Воспаление в глазницах может возникать в качестве локальных проявлений системных заболеваний, при инфекционных и неопластических процессах, а также идиопатически. Дифференциальная диагностика воспалительных заболеваний орбиты является сложной задачей ввиду редкости этих патологий, изолированного анатомического расположения поражаемых структур и крайне разнообразной этиологии воспалительных процессов. Идиопатическое воспаление орбиты (ИВО) является диагнозом исключения при необнаружении системных и локальных заболеваний, способных вызвать воспалительный процесс в орбите. В формате повествовательного обзора проанализировано 30 литературных и сетевых источников при использовании поисковых систем PubMed, Google Scholar и eLIBRARY с ключевыми поисковыми запросами «orbital pseudotumor», «idiopathic orbital inflammation» и «orbital inflammatory disease», «псевдотумор». Воспаление орбиты может быть проявлением различных системных заболеваний, таких как саркоидоз, гранулематоз Вегенера, болезнь Крона, системная красная волчанка, IgG4-ассоциированное заболевание, синдром Черга–Страусса, синдром Эрдгейма–Честера, гистиоцитоз X и гигантоклеточный артериит. Несмотря на большое количество проведенных исследований, не существует единого протокола ведения пациентов с ИВО. Различные авторы предлагают разные схемы использования глюкокортикостероидов (ГКС). В качестве альтернативных методов лечения используются лучевая терапия, нестероидные противовоспалительные средства (НПВС), иммуносупрессоры и хирургия. Пероральный прием высоких доз ГКС с постепенным снижением дозировки признается большинством авторов как терапия первой линии, несмотря на неоднозначную эффективность, продемонстрированную многими исследованиями. В отечественной практике предпочитают использовать локальные инъекции ГКС. Для разработки новых протоколов ведения пациентов с ИВО требуется более глубокое понимание патологических основ заболевания и тесное сотрудничество с врачами других специальностей, в особенности ревматологами и трансплантологами.
Воспаление в глазницах может возникать в качестве локальных проявлений системных заболеваний, при инфекционных и неопластических процессах, а также идиопатически. Дифференциальная диагностика воспалительных заболеваний орбиты является сложной задачей ввиду редкости этих патологий, изолированного анатомического расположения поражаемых структур и крайне разнообразной этиологии воспалительных процессов. При этом диагноз имеет принципиальное значение, так как он определяет необходимость проведения активной противовоспалительной терапии.
В дифференциальной диагностике орбитальной патологии используются инструментальные методы (УЗИ, МРТ, КТ, допплерография), лабораторные тесты (общий и биохимический анализ крови, в том числе на тиреоидные гормоны, серология) и различные виды биопсии (тонкоигольная аспирационная биопсия, трепанобиопсия, инцизионная, эксцизионная).
При воспалении в первую очередь необходимо исключить инфекционные заболевания — пресептальный и орбитальный целлюлит. Эти состояния характеризуются острой клинической картиной и обычно возникают на фоне инфекции или травмы придаточного аппарата глаза или околоносовых пазух. Пресептальный и орбитальный целлюлит обычно сопровождаются системными признаками воспаления в виде фебрильной температуры и лейкоцитоза. Это потенциально жизнеугрожающие состояния, требующие госпитализации и системной антибиотикотерапии.
Одним из самых распространенных состояний [1, 2], сопровождающихся воспалительными изменениями тканей орбиты, является эндокринная офтальмопатия (ЭОП). Это заболевание развивается на фоне болезни Грейвса или хронического аутоиммунного тиреоидита, в его основе лежит взаимодействие специфических антител с рецепторами тиреотропного гормона и орбитальными фибробластами, что вызывает воспаление в экстраокулярных мышцах (ЭОМ), орбитальной клетчатке или слезной железе. В соответствии с рекомендациями EUGOGO [3] оценивается тяжесть заболевания и принимается решение о терапии глюкокортикостероидами (ГКС). Терапевтические опции ГКС включают пероральный прием преднизолона, внутривенное введение метилпреднизолона и парабульбарные инъекции бетаметазона.
Неспецифическое, или идиопатическое, воспаление орбиты — группа заболеваний, основным звеном патогенеза которых также является воспаление. Другое название, псевдотумор, отражает их способность мимикрировать под онкологический процесс. В 1905 г. Birch-Hirschfeld впервые описал феномен новообразования без характерной для опухоли гистологии, назвав его «orbital pseudotumor» [4], и позднее отнес к нему проявления самых различных заболеваний [5, 6]. Термин получил широкое распространение, несмотря на его ограниченную значимость [5], но в настоящее время применяется в узком контексте как синоним идиопатического воспаления орбиты (ИВО).
В отечественной литературе [7] выделяют три клинические формы заболевания: идиопатический миозит, васкулит и дакриоаденит, а склероз орбиты рассматривается как исход всех трех форм. Следует отдельно упомянуть классификацию на основании инструментальных методов исследования [8]. В соответствии с ней выделяют следующие формы заболевания: дакриоаденит, миозит, оптический периневрит, целлюлит, апицит (синдром Толоса–Ханта), перисклерит, склерозирующее воспаление орбиты или наличие локального очага. Неспецифическое воспаление обычно затрагивает сразу несколько структур орбиты.
ИВО является диагнозом исключения при необнаружении системных и локальных заболеваний, способных вызвать воспалительный процесс в орбите.
ИВО представляет 5–6% патологии орбиты [1, 2, 9, 10]. Идиопатический процесс обычно носит односторонний характер, но в 26% случаев может быть и двусторонним (как при первом визите, так и в ходе наблюдения). Заболевание проявляется периорбитальным отеком (75%), покраснением глаз (48%), экзофтальмом (32–79%), птозом (25%), хемозом (18–42%), ограничением подвижности ЭОМ (31–61%) и оптической нейропатией (7%) [1, 11]. Пациенты могут предъявлять жалобы на боль (24–69%), двоение (31%), асимметрию лица, нарушения зрительных функций. Заболевание может начинаться как остро [1, 9], так и иметь постепенное начало [9, 12]. Средний возраст пациентов — 45 лет [13], но не исключены эпизоды ИВО у детей, по разным данным — в 6–17% случаев [14]. ИВО чаще наблюдается у женщин среднего возраста, гендерное соотношение составляет 1,8:1, при этом показатель может варьировать в различных подгруппах псевдотумора, например, в соотношении 5:1 при воспалении верхушки орбиты (синдром Толоса–Ханта) [1].
Гистологически ИВО характеризуется клеточным инфильтратом, состоящим преимущественно из зрелых лимфоцитов, изменениями соединительной ткани по типу отека, фиброза или склероза, периваскулитом и другими изменениями вовлеченных в воспалительный процесс структур орбиты [6]. Гистологическая картина может быть схожа с таковой при системных и локальных воспалительных процессах установленной этиологии, а также отличаться между собой в различных частях пораженных тканей [6], поэтому при ее оценке следует учитывать, что конкретный образец может оказаться нерепрезентативным для всего патологического процесса. Гистологическое заключение не позволяет установить окончательный диагноз ИВО и является элементом его комплексной диагностики.
Материалы и методы исследования
В формате повествовательного обзора проанализировано 30 литературных и сетевых источников при использовании поисковых систем PubMed, Google Scholar и eLIBRARY с ключевыми поисковыми запросами «orbital pseudotumor», «idiopathic orbital inflammation» и «orbital inflammatory disease», «псевдотумор».
Диагнозы исключения
Воспаление орбиты может быть проявлением различных системных заболеваний, таких как саркоидоз, гранулематоз Вегенера, болезнь Крона, системная красная волчанка, IgG4-ассоциированное заболевание, синдром Черга–Страусса, синдром Эрдгейма–Честера, гистиоцитоз X и гигантоклеточный артериит.
Саркоидоз — системное гранулематозное воспалительное заболевание, затрагивающее дыхательные пути, кожу и глаза. Офтальмологические проявления встречаются в половине случаев и представлены гранулемами в конъюнктиве, увеитом, оптической нейропатией или воспалением орбитальных структур [15].
Гранулематоз Вегенера (ГВ, гранулематоз с полиангиитом) — системный васкулит с гранулематозным воспалением, обычно затрагивающий мелкие сосуды в почечной и дыхательной системах при генерализованной форме и околоносовые пазухи и орбиту при локальной форме [15]. Офтальмологические проявления встречаются в 50% случаев ГВ, причем не только в орбите, но и в других тканях глаза. Это тяжелая патология, требующая активного системного лечения.
IgG4-ассоциированное заболевание подтверждается на основании клинических данных о воспалении неизвестной этиологии в одном или нескольких органах и характерных гистологических изменений в виде густого лимфоплазмоцитарного инфильтрата, фокального «плетеного» фиброза и облитерирующего флебита [16]. Повышение уровня IgG4 не является патогномоничным признаком и встречается только в 40% случаев [17].
К другим гранулематозным воспалительным заболеваниям относятся синдромы Черга–Страусса и Эрдгейма–Честера. В обоих случаях в процесс могут вовлекаться самые разные органы и системы, прогноз в плане зрительных функций варьирует. Диагноз синдрома Черга–Страусса основывается на обнаружении антител P-ANCA, а синдрома Эрдгейма–Честера — на иммуногистохимическом маркере CD68 [15].
Наличие этих заболеваний, также как неспецифического воспаления орбиты при сопутствующей болезни Крона, системной красной волчанке, гистиоцитозе X и гигантоклеточном артериите, указывает на аутоиммунную природу патологического процесса.
В ряде случаев воспаление может быть вызвано врожденными новообразованиями, в особенности дермоидной кистой или лимфангиомой [18]. Экстраокулярный рост увеальной меланомы [19] и метастазы в орбиту [20] также могут мимикрировать под ИВО.
Лечение
Обычно ИВО требует незамедлительного лечения, хотя в редких случаях в ходе наблюдательной тактики может наступить самопроизвольная ремиссия заболевания [1, 5, 12]. Первая линия терапии — применение высоких доз ГКС с их постепенным уменьшением.
Одно из наиболее крупных исследований эффективности лечения ИВО анализирует данные 65 пациентов (90 глаз) с использованием ГКС как монометода (69%), ГКС с последующей лучевой терапией (ЛТ) (12%), ГКС в комбинации с нестероидными противовоспалительными средствами (НПВС) (9%), в 1 атипичном случае использовались НПВС с ЛТ, в 2 случаях легкого течения заболевания — НПВС как монометод и 1 редкий случай с использованием хирургии [1]. Среди всех случаев лечения 63% пациентов достигли стойкой ремиссии заболевания, при этом 20% из них потребовалось дополнительное использование иммуносупрессоров. В 37% случаев лечение оказалось неэффективным, хотя у большинства пациентов симптомы были частично облегчены. В этой группе пациентов рецидив заболевания непосредственно во время лечения и постоянная необходимость использования ГКС (стероидная зависимость) встречались в 33% случаев, а развитие побочных эффектов от ГКС — в 13%. Результаты эффективности терапии по исследуемым группам приведены на рис. Важно отметить, что несколько более высокие показатели неэффективности лечения могут быть связаны со спецификой центра, в котором проводилось исследование, и тенденцией к обращению пациентов с более тяжелыми случаями ИВО.
Авторы этой работы разработали свой протокол ведения пациентов с ИВО [1]. После исключения локальной (инфекция, травма, онкология) и системной (заболевания щитовидной железы, саркоидоз, гранулематоз Вегенера, онкология) патологии использовали следующую схему лечения: преднизон внутрь 1–1,5 мг/кг ежедневно в течение 1–2 недель с постепенным уменьшением дозы в течение 5–8 недель и мониторингом побочных эффектов от ГКС. При неэффективности лечения или постоянных рецидивах рекомендовано проведение биопсии. Если результаты биопсии указывают на признаки ИВО, а первый курс ГКС сопровождался терапевтическим ответом, рекомендовано проведение повторного курса ГКС с более медленным снижением дозы. При отсутствии эффекта от первого курса ГКС, при наличии стероидной зависимости или противопоказаниях к применению ГКС целесообразно проведение лучевой терапии в объеме 15–20 Гр, распределенных в течение 10 дней. При отсутствии эффекта и при уверенности в настоящем диагнозе рекомендованы химиотерапия или хирургическое удаление тканей.
По данным другого исследования Mombaerts и соавт. [2], проведенного на 27 пациентах с ИВО, 78% имели выраженный терапевтический эффект от ГКС в начале лечения, но только 37% из них смогли достичь стойкой ремиссии после одного курса терапии. Частота рецидивов (n = 5) заболевания в сочетании с необходимостью прекратить лечение (n = 6) в группе с выраженным начальным эффектом составила 52%.
В качестве начального курса Mombaerts и соавт. [2] использовали ГКС внутрь — по 60 мг ежедневно в течение 2 недель с постепенным уменьшением дозы в течение месяцев. При возникновении рецидива ИВО у 6 пациентов использовались повторные курсы приема ГКС (ремиссия достигнута в 3/6), ЛТ в 10–30 Гр у 5 пациентов (ремиссия достигнута в 4/5), индометацин внутрь — 100 мг ежедневно у 2 пациентов (ремиссия достигнута в 2/2), хирургическое удаление тканей у 2 пациентов (ремиссия достигнута в 2/2), циклофосфамид внутрь — 100 мг ежедневно у 2 пациентов (ремиссия не достигнута).
ГКС имеют внушительный ряд побочных эффектов: гипергликемия, повышение артериального давления, нарушение электролитного баланса, надпочечниковая и гипоталамо-гипофизарная недостаточность, диспепсия, набор лишнего веса, различные психические расстройства и остеопороз [1, 2, 6]. Это может привести к обострению имеющихся или возникновению хронических заболеваний, поэтому применение ГКС обязательно должно быть согласовано с врачами других специальностей. Для профилактики побочных эффектов терапии ГКС со стороны желудочно-кишечного тракта и костной системы целесообразно использование ингибиторов протонной помпы и препаратов кальция.
С офтальмологической стороны прием ГКС может осложниться формированием задней субкапсулярной катаракты и развитием глаукомы, в том числе ее острой закрытоугольной формы на фоне отслойки сосудистой оболочки и смещения кпереди цилиарного тела [21].
В ретроспективном исследовании Char и соавт. [12] применяли преднизон системно внутрь 80–100 мг ежедневно на протяжении 7–10 дней. Стойкий эффект от лечения наблюдался только в 31% случаев, что объясняется низкой эффективностью ГКС для большого объема воспаленных тканей или при наличии фибротического процесса. Использование ЛТ в 20 Гр как в качестве первой линии терапии, так и после безуспешного первого курса ГКС в сумме продемонстрировало эффективность в 64% случаев, что позволило авторам сделать вывод о большей эффективности ЛТ в сравнении с ГКС. Проведенная работа имеет ряд недостатков — отсутствие стандартизированных групп и проведенное лечение по поводу ИВО в анамнезе до начала исследования.
Достаточно подробный протокол лечения предлагают Leone и Lloyd [22]. Преднизон внутрь по 60–80 мг ежедневно в сочетании с топическим применением 1% преднизолона. Если наблюдается улучшение, то дозировка уменьшается на 5 мг в неделю. В случае рецидива необходимо вернуться к той дозировке, на которой наблюдался эффект, и вновь попытаться снижать ее на 5 мг в неделю. При рецидиве следует опять вернуться к эффективной дозировке и затем следовать более медленному снижению по 2,5 мг в неделю. При использовании этой схемы лечения ремиссия ИВО была достигнута в 51% случаев. У остальных пациентов проводилась повторная дифференциальная диагностика. При уверенности в диагнозе ИВО использовался следующий протокол: дексаметазон внутривенно по 4 мг каждые 4–6 часов до снятия воспаления, а затем опять переход на преднизон — по 60–80 мг ежедневно со снижением дозировки на 5 мг в неделю. 23% пациентов из этой группы достигли ремиссии заболевания. Остальным (n = 17) проводилась биопсия, и при наличии признаков ИВО ГКС вводили непосредственно в очаг в сочетании с приемом преднизона внутрь — по 60–80 мг ежедневно. На этом протоколе лечения 33% оставшихся пациентов достигли ремиссии. В отсутствие эффекта на ГКС или при наличии противопоказаний к их применению проводилась ЛТ 10–30 Гр с преднизоном с успешным результатом в 75% случаев (n = 6). Пациенты с наиболее резистентными формами (n = 2) получали циклофосфамид (200 мг) с ГКС ежедневно и также достигли ремиссии (срок наблюдения — 1 год).
Leone и Lloyd [22] использовали результаты терапевтического ответа на ПТ как диагностический критерий ИВО. Это повлекло за собой задержку в диагностике злокачественного новообразования орбиты в 11% случаев. Многие авторы [1, 2, 10, 12] не рекомендуют использовать терапевтический ответ на ГКС в качестве основного диагностического критерия ИВО, так как это не исключает другой патологии орбиты, в том числе первичной опухоли или метастаза. В свою очередь невыраженный терапевтический ответ также не исключает этот диагноз и может указывать на резистентную к ГКС форму ИВО.
На лекции Американского общества офтальмологической пластической и реконструктивной хирургии в 2005 г. G. J. Harris представил свой опыт лечения ИВО [23]: преднизон внутрь по 1–1,5 мг/кг ежедневно 1–2 недели с постепенным снижением в следующие 6–12 недель. Пациентам с вовлечением в воспалительный процесс верхушки орбиты или с потерей зрительных функций рекомендован метилпреднизолон внутривенно — по 1 г ежедневно 1–3 суток. Целесообразность биопсии повышается при атипичных признаках ИВО, наличии орбитальных масс или протекании процесса в слезной железе.
Эффективность локального применения ГКС была оценена в исследовании Leibovitch и соавт. [24] на 10 пациентах. Триамцинолон 20–40 мг/мл вводился внутрь очага или по его периферии. Инъекцию повторяли через 4 недели, если не была достигнута резорбция очага. В средний период наблюдения 9,8 месяца у 8 пациентов произошла полная резорбция воспаленных тканей, у одного достигнуто значительное улучшение и у одного эффект отсутствовал.
В отечественной литературе сообщается об использовании ГКС совместно с ретробульбарным введением миелопида, комплекса иммунорегуляторных пептидов, в верхне-наружный отдел орбиты [25]. По данным А. Ф. Бровкиной, это позволило снизить количество используемых ГКС и достигнуть 100% реабилитации пациентов даже с резистентными формами псевдотумора. В работах Г. Ф. Гайсиной [26] сообщается о достоверной связи между дакриоаденитом и легким течением псевдотумора. В качестве лечения использовались ретробульбарные инъекции 1,0 мл Дипроспана (бетаметазон) 1–4 раза в месяц в зависимости от тяжести течения или ретробульбарные инъекции дексаметазона — по 1,0 мл ежедневно 10 дней с эффективностью 85% и 76% соответственно.
Успех применения пульс-терапии по результатам рандомизированных контролируемых испытаний лечения гигантоклеточного артериита [27] и ЭОП [28] при болезни Грейвса дал основание для апробации этого метода в лечении ИВО. Целесообразность более агрессивной терапии тяжелых случаев ИВО в виде пульс-терапии оспаривается в работе Bijlsma и соавт. [29]. По результатам их исследования в группе пациентов, для лечения которой использовалась пульс-терапия метилпреднизолоном с последующим пероральным приемом преднизона, симптомы были купированы в 73% случаев с медианой продолжительности лечения 160 дней, в то время как в контрольной группе с пероральным приемом преднизона симптомы были купированы в 87% случаев с медианой продолжительности лечения 110 дней. Авторы рекомендуют проведение пульс-терапии только в случае оптической нейропатии для ускоренного купирования симптомов.
Неэффективность использования ГКС в лечении фибротических форм ИВО отмечается многими авторами [9, 12]. Rootman и соавт. [30] определяют идиопатическое склерозирующее воспаление как отдельное клиническое и патологическое явление ввиду выраженного фиброза, тяжести течения, низкой чувствительности к ЛТ и ГКС, а также рекомендуют раннюю и агрессивную терапию иммуносупрессорами.
Оценка эффективности иммуносупрессоров в лечении ИВО крайне затруднительна ввиду их большого разнообразия и использования только в качестве терапии второй или третьей линии. Наиболее часто упоминаются антиметаболиты (метотрексат, азатиоприн, микрофенолата мофетил), алкилирующие препараты (циклофосфамид, хлорамбуцил), ингибиторы T-клеток (циклоспорин А, такролимус) и различные моноклональные антитела (инфликсимаб, ритуксимаб) [1, 2, 10, 11, 23]. При этом главная цель этих назначений состоит не в замене терапии ГКС, а в снижении используемых дозировок. Основная проблема применения этих препаратов заключается в том, что их действие не ограничено клетками в активной фазе воспаления, что влечет за собой поражение здоровой клеточной популяции костного мозга со снижением активности противоопухолевого и противоинфекционного иммунитета [23]. Назначение этих препаратов должно проводиться в рефрактерных или атипичных случаях в тесном сотрудничестве с врачами тех специальностей, которые используют данные средства на постоянной основе, — ревматологами и трансплантологами [10, 23]. Тем не менее, учитывая непостоянный эффект ГКС в лечении ИВО, требуются более глубокое понимание патологических основ заболевания и разработка новых терапевтических опций в его лечении.
Заключение
Терминологическая характеристика ИВО, или псевдотумора, претерпела множество изменений. В настоящее время это заболевание является диагнозом исключения после проведенной дифференциальной диагностики с локальной патологией орбиты и системными аутоиммунными заболеваниями.
Несмотря на множество проведенных исследований, не существует единого протокола ведения пациентов с ИВО. Ввиду отсутствия методов, достоверно устанавливающих наличие ИВО, диагноз зачастую ставится клинически. Проведение биопсии орбиты рекомендуется в атипичных случаях, а также при наличии признаков, позволяющих заподозрить опухолевый процесс.
Пероральный прием высоких доз ГКС с постепенным снижением дозировки признается большинством авторов как терапия первой линии, несмотря на неоднозначную эффективность, продемонстрированную многими исследованиями. В отечественной практике предпочитают использовать локальные инъекции ГКС. К альтернативным методам лечения относятся ЛТ, НПВС, иммуносупрессоры и хирургия. Большое разнообразие последних и их значительные побочные эффекты затрудняют оценку клинической эффективности. Для разработки новых протоколов ведения пациентов с ИВО требуются более глубокое понимание патологических основ заболевания и тесное сотрудничество с врачами других специальностей, в особенности ревматологами и трансплантологами.
Литература / References
И. А. Левашов 1
А. А. Яровой, доктор медицинских наук
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С. Н. Федорова, Москва, Россия
Идиопатическое воспаление орбиты и глюкокортикостероиды как первая линия терапии: обзор литературы/ И. А. Левашов, А. А. Яровой
Для цитирования: Лечащий врач № 6/2020; Номера страниц в выпуске: 69-73
Теги: глазницы, воспаление, системные заболевания, диагностика


.gif)