Что такое пероксид водорода в химии
Общие сведения о перекиси водорода и ее свойствах
Перекись водорода (Н2О2) — химическое соединение из группы, включающей пероксиды. Впервые вещество было получено Луи Тенаром в 1818 году путем подкисления раствора перекиси бария азотной кислотой. Это сильный окислитель во многих химических реакциях, таких как окисление ракетного топлива (80%), мощное дезинфицирующее и отбеливающее средство.
Перекись водорода классифицируется как одна из активных форм кислорода. Химическая формула агента состоит из двух атомов водорода и двух атомов кислорода. Благодаря этой структуре молекула под действием органических и неорганических веществ, тепла, света быстро разлагается с выделением атомарного кислорода. Дезинфицирующее действие самой перекиси водорода довольно слабое, но при распаде, оно проявляется быстро и эффективно благодаря свободным атомам кислорода.
Химическая формула перекиси водорода, строение молекулы
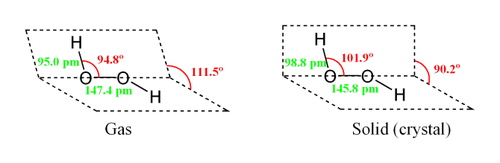
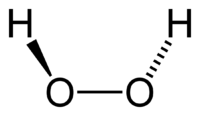
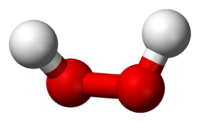
Н-О-O-H-связи вокруг атомов кислорода в молекуле H2O2 расположены под углом (аналогично H-O-H-связям в воде), причем атомы H-O-O-H образуют двугранный угол (в твердой фазе около 90°).
Физические свойства пероксида
Чистый пероксид водорода сильно отличается от знакомого всем 3%раствора, который присутствует в каждой в домашней аптечке.
Хорошо растворяется в полярных (органических) растворителях и до любой концентрации — в воде. Имеет металлический привкус. Молярная масса 34,01 г/моль.
Химические свойства
Пероксид обладает сильными окислительными свойствами, возникающими в результате образования атомарного кислорода:
Чистая перекись водорода без стабилизаторов — очень нестабильна и подвергается экзотермическому разложению, часто взрывчатому. Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом.
Подобное разложение катализируется многими веществами, например, серебром и платиной, оксидом марганца, соединениями йода:
H2O2 + IO → H2O + I+ O2
Эффективным ферментом, который расщепляет перекись водорода, является каталаза.
Благодаря тому, что пергидроль легко реагирует со многими металлами и разлагается при контакте со светом, его следует хранить в герметично закрытой таре, изготовленной из толстостенного полиэтилена или алюминия, не подвергаться воздействию дневного света и источников тепла. Его смесь с карбонатом гидрата натрия (Na2CO3 · 1,5H2O2) является относительно стабильной и безопасной в использовании.
Перекись водорода имеет слабые кислотные свойства. Слабее угольной кислоты. В водных растворах диссоциирует в соответствии с уравнением:
В присутствии восстановителей пероксид водорода ведет себя как окислитель (O-I → O-II), например :
2 NH2OH + 6H2O2 → 2 HNO3 + 8H2O
В присутствии окислителей пероксид показывает восстановительные свойства (O-I → O0), например, в реакции с перманганатом калия в кислых условиях :
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
или с солями серебра (I) в щелочной среде:
2AgNO3 + H2O2 + 2KOH → 2Ag + O2 + 2H2O + 2KNO3
Это агрессивное вещество для живых тканей. При контакте с кожей появляется белый цвет.
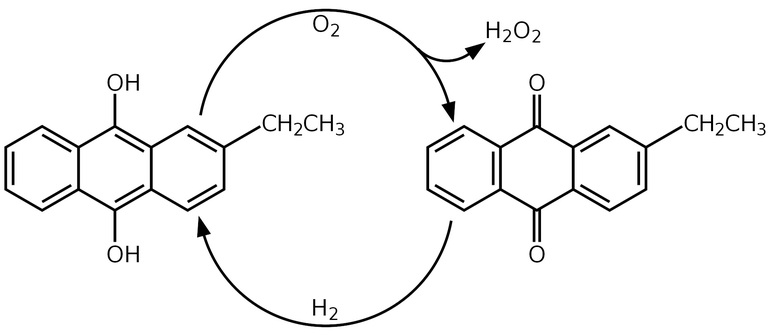
Получение — синтез пероксида водорода с использованием метода антрахинона.
В настоящее время hydrogen получают в промышленности методом антрахинона. путем окисления 2-этил-9,10-антрацендиола кислородным газом, прошедшим через раствор этого соединения в смеси подходящих растворителей. Перекись отделяют экстракцией воды и оставляют в растворе.
Этиллантрахинон регенерируют восстановлением газообразным водородом до 2-этил-9,10-антрацендиола, катализируемого палладием на подходящем носителе или соединениях никеля. В методах промышленного производства цикл обеих реакций (окисление и восстановление) осуществляется поочередно.
Разведенный водный раствор перекиси, полученный в этом процессе, концентрируют осторожным выпариванием воды при пониженном давлении, получая таким образом раствор с максимальной концентрацией 70%. Большая концентрация приводит к взрыву. Более концентрированные растворы и полностью чистый пероксид, может быть получен путем быстрого замораживания его из водного концентрированного раствора.
Интересные химические опыты с перекисью водорода — видео:
Водные растворы перекиси водорода и их применение
Перекись водорода в чистом виде не является коммерчески доступным веществом, поскольку законы большинства европейских стран и США запрещают его продажу по соображениям безопасности. В торговле (максимум 70% растворов) это соединение доступно после соблюдения особых условий (правила RID и ADR), а наиболее распространенной коммерческой формой является пергидроль 30% водный раствор и 3-5% растворы для домашнего использования, называемые перекисью водорода.
Перекись в растворе 3-3,5% используется для дезинфекции ран, и такие растворы для непосредственного использования доступны в аптеках. H2O2 оказывает особенно сильное разрушающее действие на анаэробные бактерии (анаэробы).
Дезинфекция раны с использованием перекиси водорода значительно снижает риск попадания бактерий в организм через поврежденный эпидермис. Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению.
7-15% растворы обычно используются в качестве так называемых «Активных кислородных отбеливателей» в бытовой химии, 5% водный раствор используется для обесцвечивания волос. Очень разбавленные растворы (прибл. 1%) применяются в народной медицине для перорального применения. До сих пор считаются спорным способом лечения некоторых видов рака.
Перекись водорода: помощь или вред?
Перекись водорода была впервые получена химиком Луисом Тенеро в 1818 году и уже очень скоро стала применяться в промышленности. Сейчас ее повсеместно используют в хозяйстве и быту.
1 Что такое перекись водорода: химическая формула и свойства
Перекись водорода это простейший представитель пероксидов. Он представляет собой прозрачную жидкость со своеобразным металлическим вкусом и слабым запахом, способную неограниченно растворяться в спирте, воде и эфире.
Химическая формула

Химические свойства
При взаимодействии с определенными металлами, такими например, как Mn или Fe, происходит активная химическая реакция
Распад вещества быстрее происходит в щелочной среде, кислотная же среда наоборот замедляют процесс. Именно поэтому в раствор часто добавляют фосфорную кислоту. В термических условиях H2O2 быстро разлагается, поэтому не рекомендуется хранить его на свету.
Пероксид водорода хорошо смешивается с C2H5OH (спиртом) и H2O (водой) в любых пропорциях.
Реакция распада перокисда водорода
Кислотная среда более подходящаая среда для распада. Щелочная же более подходит для восстановления
Пример реакции восстановления мы можем наблюдать при взаимодействии H2O2 с серебром
Аналогично, по существу, протекает его взаимодействие с озоном (О3 + Н2О2 = 2 Н2О + 2 О2) и с перманганатом калия в кислой среде:
Последняя реакция применяется для количественного определения пероксида водорода.
2 Основные лечебные свойства
3 Способы применения
Уже многие годы перекись водорода используется в различных областях применения благодаря своей эффективности и доступности. Его применение основывается в первую очередь на его окисляющих свойствах.
В традиционной медицине
В косметологии
Препарат используется на коже, склонной к излишней жирности и появлению акне, черных точек, благодаря способности уничтожать возбудителей инфекции. Для этого 5 капель 3% раствора добавляют к 50 мл тоника. Косметологи советуют его наносить не более 2 раз в неделю.
Людям с веснушками и пигментными пятнами вещество также подойдет за счет его отбеливающего свойства. Чтобы провести процедуру, применяют специальные маски. Взять ст. л. 20% творога, сырой желток и 5 капель перекиси. Все ингредиенты перемешиваются до однородной структуры, а затем кисточкой наносятся на кожный покров. Слегка массируют, оставляя маску на 15 мин. По истечении времени масса смывается, а на лицо накладывают увлажняющий крем.
Применение в быту
Благодаря полезным свойствам Н2О2 можно не только устранить желтые пятна, разводы с белой материи и удалить налет на кафельной плитке, но и избавиться от грибка и плесени.
Чтобы почистить плитку в ванной комнате, взять 40 мл пероксида, ч. л. жидкого мыла и полстакана пищевой соды. Компоненты хорошо перемешать и нанести на влажную губку, которой оттереть проблемные участки. Если загрязнений много, нужно оставить массу на 10 минут, чтобы они растворились.
Для очистки материала берут 3% раствор, который вливают на пятна. Оставляют на 20-30 минут, а затем смывают с поверхности.
Перекись водорода в народной медицине
4 Польза или вред?
Если человек хорошо переносит пероксид и правильно им пользуется, он не должен вызвать каких-либо неблагоприятных последствий.
Нельзя употреблять вещество внутрь, это опасно появлением отравления. При полоскании рта иногда теряется чувствительность языка и могут гипертрофироваться его сосочки.
Также не стоит использовать при наличии у человека индивидуальной непереносимости. Это может повлечь за собой развитие аллергической реакции.
5 Форма выпуска и возможные противопоказания препарата
Изготавливается в виде 3% раствора для наружного местного нанесения.
6 Метод Неумывакина: что это?
Это лечение с успехом применяется в нетрадиционной медицине. Профессор Неумывакин считал перекись панецеей от всех заболеваний. Принцип действия он объяснял укрепляющим эффектом лекарства: при взаимодействии с кровью и ферментом каталазой оно распадается до воды и кислорода, который разжижает кровь, нормализует обменные процессы и улучшает деятельность органов и систем.
Если ожидаемый эффект не достигался, профессор считал, что организм чрезмерно зашлакован. Поэтому он рекомендовал проводить полную очистку.
Метод не признан официальной медициной, так как его противники утверждают, что перекись не только неэффективна, но и может причинить опасность при использовании не по назначению.
В нашей следующей статье мы поговорим об особенностях применения каустической соды.
Строение молекулы и физические свойства
Пероксид представлен в виде бесцветной жидкости с «металлическим» вкусом и специфическим запахом. Вязкая консистенция обусловлена развитой системой водородных связей в молекулярной структуре.
Основные физические свойства перекиси водорода:
Молекула вещества является полярной, поскольку её строение несимметричное. Соединение может неограниченно растворяться в воде, эфире и спирте. Чистое вещество неустойчиво и способно самопроизвольно разлагаться со взрывом.
Химические особенности
Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
Вещество по степени кислотности немного сильнее H2O. Некоторые пероксиды металлов можно рассматривать как его соли. В кислой среде перекись служит окислителем, а в щелочной — восстановителем.
Способы получения вещества
Сначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в H2SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота.
В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении.
В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+H2O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта.
В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта.
Меры предосторожности
Во время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов.
Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Упаковку с аптечным средством необходимо хранить в тёмном месте. При транспортировке нужно избегать встряхивания вещества и других механических воздействий, которые могут привести к его разложению.
Сферы использования
Пероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином.
Применение в области медицины
Широкое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству.
Формы выпуска пероксида водорода:
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий.
При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором.
Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий.
Пероксид водорода
| Пероксид водорода | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Пероксид водорода |
| Химическая формула | H2O2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 34,01 а. е. м. |
| Молярная масса | 34,01 г/моль |
| Плотность | 1.4 г/см³ |
| Термические свойства | |
| Температура плавления | −0,432 °C |
| Температура кипения | 150,2 °C |
| Энтальпия образования (ст. усл.) | -136.11 кДж/моль |
| Химические свойства | |
| pKa | 11.65 |
| Растворимость в воде | неограниченная |
| Классификация | |
| Рег. номер CAS | 7722-84-1 |
| SMILES | OO |
| Регистрационный номер EC | 231-765-0 |
Перокси́д водоро́да (перекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2•2H2O.
Молекула пероксида водорода имеет следующее строение:
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7·10 −29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Содержание
Химические свойства
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обуславливает способность пероксидов выступать как в роли окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:

При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до кислорода:
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Так же этому может поспособствовать присутствие ионов переходных металлов. В разбавленных растворах пероксид водорода тоже не устойчив и самопроизвольно диспропорционирует на H2O и O2.Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
Однако очень чистый пероксид водорода устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4·10 −12 ), и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):

Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
В реакции с нитритом калия соединение служит окислителем:
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5 и пероксидисерная H2S2O8 кислоты.
Окислительно-восстановительные свойства
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства
Перекись водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако, несколько ферментных систем (ксантиноксидаза, НАД(Ф)H-оксидаза, циклоксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в перекись водорода.
Получение
Пероксид водорода получают в промышленности при реакции с участием органических веществ, в частности, каталитическим окислением изопропилового спирта:
Ценным побочным продуктом этой реакции является ацетон.
В промышленных масштабах пероксид водорода получают электролизом серной кислоты, в ходе которого образуется надсерная кислота, и последующим разложением последней до пероксида и серной кислоты.
В лабораторных условиях для получения пероксида водорода используют реакцию:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяется для небольших поверхностных ран, исследования показали что этот метод обеспечивая антисептический эффект и очищение и удлиняет время заживления. [1] [2] Обладая хорошими очищающими свойствами, перекись водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также удлинять время заживления из-за повреждения прилегающих к ране клеток. [3] Более того, перекись водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи. [4] Однако, в качестве средства для очистки глубоких ран сложного профиля, гнойных затеков, флегмон, и других гнойных ран санация которых затруднена, перикись водорода остается препаратом выбора. Так как она обладает не только антисептическим эффектом, но и продуцирует большое количество пены, при взаимодействии с ферментом пероксидазой. Что в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые буду легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки перекисью водорода, антисептический раствор не сможет удалить данные патологические образования, что приведет значительному увеличению времени заживления раны, и ухудшит состояние больного.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции, соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, получившихся при взаимодействии перманганата калия «марганцовки» с предметами (ввиду его окислительных свойств).
Пероксид водорода в аквариумистике
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме (гидры, планарии, паразиты, водоросли, бактерии и др.)
Формы выпуска
Выпускается в виде водных растворов, стандартная концентрация 1-6 %, 30, 38, 50, 60, 85, 90 и 98 %. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем.
Опасность применения
Несмотря на то, что пероксид водорода не токсичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен. Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл. [7]