Что такое персонифицированная медицина
Персонализированная медицина – новый взгляд на пациента с позиции его генома
26 июня 2000 года можно считать датой, перевернувшей представление ученых всего мира о строении человека, именно в этот день президент США Билл Клинтон и британский премьер-министр Тони Блэр объявили о завершении создания «черновика» генома. Этот грандиозный замысел по расшифровке генома человека (The Human Genome Project, HGP) являлся международным научно-исследовательским проектом, главной целью которого было определить последовательность нуклеотидов, которые составляют ДНК и идентифицировать 20—25 тысяч генов в человеческом геноме.
Трёхмиллиардный проект был формально запущен в 1990 году Министерством энергетики США и Национальным институтом Здравоохранения, и ожидалось, что он продлится 15 лет, однако, исследование было окончено досрочно, в апреле 2003 года, а в мае 2006 года, умы ученой общественности вновь всколыхнулись, когда в журнале Nature была опубликована последовательность последней хромосомы — хромосомы 1.
К тому времени фарминдустрия набирала все больше и больше оборотов, и если в 1993 году для одобрения нового лекарственного препарата требовалось 27 месяцев, в 2003 году, всего лишь 14. Но у каждой медали есть и оборотная сторона, которой в данном случае являлись нежелательные лекарственные реакции, число которых росло пропорционально регистрации новых препаратов.
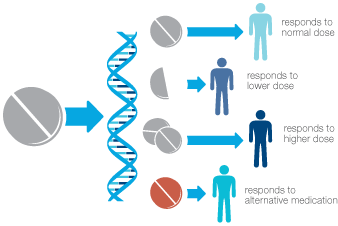
Все вышесказанное привело к созданию революционной науки фармакогенетики, изучающей индивидуальные различия в ответ на лекарственные препараты, которые обусловлены аллельными вариациями в генах, определяющими метаболизм лекарства, его эффективность и токсичность.
Большое применение фармакогенетика нашла в кардиологии, что неудивительно учитывая тот факт, что пациентам, к примеру, перенесшим инфаркт миокарда (ИМ) врачи назначают одновременно 6-7 препаратов, которые могут вступать в лекарственные взаимодействия, ослабляя, или потенцируя, эффекты друг друга.
Основными ферментами, участвующими в метаболизме лекарств, являются: CYP2D6, CYP2C9 (включая VKORC1), CYP2C19, CYP3A4 и CYP3A5. Именно их генетические варианты определяют индивидуальную реакцию на назначение того или иного препарата. По данным последних исследований, около 85% популяции имеют один или более дефект в генах, кодирующих вышеперечисленные ферменты. [1]
Всех индивидуумов можно разделить на 4 категории соответственно их способности метаболизировать лекарственные препараты: [5]
Если посмотреть на метаболизм часто назначаемых кардиологических препаратов, то за него отвечают следующие изоферменты: [2,3,4]
| Препарат | Изофермент | Препарат | Изофермент |
| клопидогрел | CYP2C19 | метопролол | CYP2D6 |
| варфарин | CYP2C9 и VKORC1 | изосорбид | NAT1;NAT2 |
| тикагрелор | CYP2C19 | карведилол | CYP2D6 |
Как видно из таблицы, большая часть препаратов метаболизируется при помощи цитохрома P450 (CYP), при этом по данным проведенных генетических популяционных исследований, значительная часть индивидуумов имеет вариабельность данной ферментной системы. [4]
| Ген | Медленные метаболизаторы | Промежуточные метаболизаторы | Нормальные метаболизаторы | Быстрые или ультрабыстрые метаболизаторы |
| CYP2D6 | 10% | 35% | 48% | 7% |
| CYP2C9 | 2-4% | >35% | нет | |
| CYP2C19* | 2-20% | 24-36% | 14-44% | 30% |
*зависит от этнической принадлежности
| Ген | Вариант активности | Кавказцы | Азиаты | Африканцы |
| CYP3A4 | уменьшение | 5,3% | 0% | 0% |
| CYP3A5 | уменьшение | 93% | 75% | 27-50 |
Возрастающий интерес ученых и самих пациентов к такому персонализированному подходу в выборе терапии, подстегивает индустриальные компании к созданию простых и приемлемых по цене тестов, однако, на настоящий момент, они еще не вошли в широкую практику и доступны не во всех странах мира.
Журнал «ПАРТНЕР»
Персонализированная медицина: Основные принципы и методы
Немного истории

К настоящему времени в медицине сложился принцип лечениянепосредственно самой «болезни» как комплекса симптомов и синдромов у некоего среднестатистического человека без учета индивидуальных особенностей его физиологии, наследственных факторов, психосоциального статуса. Подобная схематизация лечебного процесса в ряде случаев приводит к безуспешной борьбе с «заболеванием», при которой индивидуальные особенности пациента не учитываются в полной мере, а иногда просто противодействуют эффективности терапии, изменяя прогноз и течение болезни.
Суть персонализированной медицины
Но вот появился «свет в конце тоннеля»: в современную медицину, благодаря новейшим достижениям молекулярной биологии, уверенно входит понятие «персонализированная медицина». Это дает надежду, что индивидуальный подход к медицинской помощи, поистине выстраданный человечеством, наконец, станет доминирующим.
Толчком для развития персонализированной медицины стали успехи, достигнутые за последние десятилетия в молекулярной биологии.
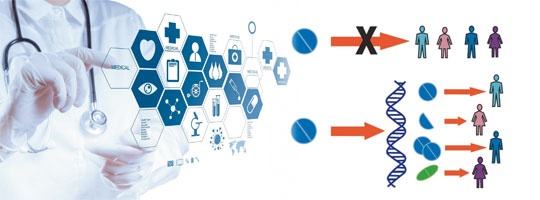
Отправной точкой явился знаменитый международный проект «Геном человека», стартовавший в 1990 г. Результаты этого проекта выразились, в том числе, и в бурном развитии технологий массового секвенирования (распознавания) ДНК, позволили медицинской генетике вплотную приблизиться к клинической практике. Так, геном пациента помогает определить оптимальный подход к оказанию индивидуальной медицинской помощи, будь она профилактической, диагностической или терапевтической.
Ознакомившись с информацией, содержавшейся в наследственном материале, можно в любой момент жизни человека определить, какие генетические неполадки имеются в организме человека и какова вероятность того, что они однажды дадут о себе знать. Более того, такой анализ позволяет прогнозировать, как наш организм будет реагировать на определенные лекарства.
Персонализированная,или предсказательная, индивидуализированная медицина – это совокупность методов профилактики (предупреждения) болезни, диагностики и лечения в случае ее возникновения, основанных на индивидуальных особенностях пациента. К подобным индивидуальным особенностям относят целый комплекс различных генетических маркеров в сочетании с присущими данному организму разнообразными фенотипическими признаками.
Что такое фенотипические признаки? Это совокупность всех внешних характеристик человека, включая различные физиологические, биохимические и молекулярные характеристики, которые могут изменяться в результате действия генов.
Таким образом, персонализированная медицина – это прежде всего интегральная медицина, которая включает в себя разработку персонализированных средств лечения, тестирование на предрасположенность к болезням, профилактику, а также объединение диагностики с лечением и мониторингом лечения.
К основным принципам персонализированной медицины относятся:
— Возможность «предсказать» болезнь (предикативность).
— Принятие конкретных мер, предотвращающих заболевание (профилактика).
— Индивидуальное лечение каждого (персонализация).
— Возможность непосредственного участия самого пациента в процессе профилактики и лечения (партисипативность).
Составление многофакторной базы данных на каждого пациента предполагает учет всех его биологических и психосоциальных особенностей. При этом общая картина складывается из множества пазлов: результатов анализа работы различных систем организма (в том числе и на молекулярном уровне), наличия наследственных патологий и даже описания особенностей отношений в семье.
Новое направление неразрывно связано с молекулярной медициной и биологией, которые во многом обеспечивают развитие соответствующих инновационных технологий: клеточные и биомолекулярные методы и средства диагностики, профилактики, лечения и реабилитации.
Отличия нового подхода от ныне существующего
К таким отличиям в первую очередь относятся:
— Профилактическая направленность (возможность «предсказать» заболевание, составить его прогноз и, соответственно, принять меры, чтобы его предотвратить);
— Использование высокотехнологичных методов, с помощью которых можно не только определять диагноз на ранних стадиях, но и назначать лекарственные препараты индивидуально, то есть в зависимости от тех или иных характеристик человека.
Существенным фактором является то, что основным инструментом персонализированной медицины остается врач, который изучает историю болезни человека, анализирует жалобы, используя свой опыт и профессионализм. Методы персонализированной медицины – это сочетание высокого профессионализма врача, принципов доказательной медицины, «обычных» инструментальных исследований при необходимости, а также современной лабораторной диагностики.
Инновационным для персонализированной медицины является попытка понять болезнь или предрасположенность к ней на клеточном уровне, оценить «молекулярные пути» заболевания, найти соответствующие биомаркеры – вещества, которые являются «знаками» той или иной болезни. Для этого используется генетика, геномика (раздел молекулярной генетики, посвященный изучению генома и генов), протеомика (наука об изучении белков, их функций и взаимодействия в живых организмах), а также метаболомика (наука об изучении уникальных химических «отпечатков пальцев», специфичных для процессов, протекающих в живых клетках).
Все ли заболевания можно предотвратить с помощью персонализированной медицины? Главным образом это –мультифакторные заболевания, при которых у человека есть предрасположенность к определенному заболеванию, но проявится болезнь или нет, зависит от факторов внешней среды – питания, спортивных нагрузок и т.п., то есть образа жизни. На сегодняшний день возможно определить предрасположенность к большому количеству патологий – начиная от панкреатита и заканчивая некоторыми видами онкологии. Это и сахарный диабет 2-го типа, и гипертоническая болезнь; существуют маркеры, свидетельствующие о возможности возникновения инфаркта миакарда.
Персонализированная медицина, несмотря на значительный объем используемой информации, на самом деле экономит время и пациента, и врача. Полное обследование пациента в клинике персонализированной медицины занимает, как правило, всего 2-3 дня, включая медико-генетическое консультирование и необходимые лабораторные и инструментальные методы. А определение биомаркеров и генетическое тестирование может занять всего 10 минут – для этого требуется сдать анализ крови или слюны.
Ранняя диагностика важна во всех случаях персонализированной медицины!
Не существует «легких» или «тяжелых» болезней, для каждого человека болезнь – это стресс и снижение качества жизни. В случае с неясным или редким диагнозом прояснить ситуацию помогает медико-генетическое консультирование. Можно диагностировать наследственные заболевания, включая онкологические заболевания, предсказывать спортивные достижения, определять переносимость и эффективность определенных лекарств.
Персонализированный подход необходим людям, которые пожизненно или длительно принимают лекарственные средства, для подбора дозировки с помощью методов новой науки – фармакогенетики. Например, если дело касается препаратов, разжижающих кровь – антикоагулянтов. Многие из нас знают, что риск тромбоза после любого оперативного вмешательства существует всегда, с этой целью назначают препараты, препятствующие тромбообразованию. Как правило, определение лекарства и его дозировка – это выбор врача, основанный на действующих медицинских стандартах. Однако каждому пациенту присуща индивидуальная скорость метаболизма, т.е. скорость, с которой препарат начнет свое действие и будет выводиться из организма. Методы фармакогенетики позволяют оценивать скорость метаболизма у каждого пациента, выбрать определенное лекарство, его дозу персонально.
Таким образом, персонализированная медицина – это уникальное сочетание накопленного исторического опыта мировой медицины и достижений современной науки, симбиоз опыта и высокого профессионализма врачей и совершенных высокоэффективных технологий. Есть ли у нее проблемы и «теневые» стороны? Об этом – в следующем номере.
Д-р Ольга Грищенко (Хеппенхайм)