Что такое первичная и вторичная флуоресценция
Как работает люминесцентная микроскопия
Люминесцентная микроскопия — исследование, связанное со свечением объектов. Большинство из них не видны, т.к. используется ультрафиолетовое излучение. В некоторые образцы добавляют красители, взаимодействующие с соединениями.
Краткая историческая справка
Флуоресценцию открыл Джордж Стокс в 1852 г. Английский физик наблюдал ее у хининовых веществ. Позже ученые выяснили, что облучение ультрафиолетом приводит к свечению многих соединений. Флуоресценция характерна для витаминов, кристаллов, горных пород, масел и хлорофилла. Однако полученные сведения применили позднее.
Применение флуоресценции позволило изучать микрообъекты с разрешением от 1 до 10 нм. Наноскопия может раскладывать частицы на отдельные молекулы.
Что такое люминесцентная микроскопия
При физическом процессе соединения поглощают фотоны. Одновременно у веществ появляется излучение с иной длиной волны. У получившихся фотонов она больше, но энергии меньше. Когда соединения облучают ультрафиолетом, отдельные из них светятся. Цвет излучения направлен к красной спектральной части.
Люминесцентные устройства функционируют в отраженном свете. Основной задачей при применении флуоресценции является отделение потока света объекта от сильного излучения подсветки. Чтобы увеличить наглядность изображения, используется темный или черный фон.
Методы исследования
В люминесцентной микроскопии применяются различные методы исследований. Микробиологи используют флюорохромирование и реакцию иммунной флуоресценции. Вторую часто называют также методом флуоресцирующих тел.
Существует другой вид изучения молекул — конфокальная микроскопия. Она дает возможность исследовать частицы на той или иной глубине.
Флюорохромирование
Метод является распространенным в исследовании органов и тканей человека. Вторичную люминесценцию получают, обрабатывая образцы флюорохромами. Каждый предназначен для каких-либо целей.
Акридиновый оранжевый применяется для диагностики раковых заболеваний и инфаркта на ранних сроках. Ишемические участки имеют зелено-желтое свечение. Флюорохром применяют, чтобы выявлять кислые мукополисахариды. Если он взаимодействует с ДНК, появляется зеленая флуоресценция. Для реакции красителя на РНК характерна красная.
Кофеин 5 и родамин применяются для определения гликогена в печени. Фосфин 3Р — для выявления липидов. Аналогичными свойствами обладает смесь растворов бензпирена и кофеина. Второй должен быть насыщенным. При наличии липидов появляется бело-голубая люминесценция.
Тиофлавин окрашивает особые белковые соединения при амилоидозе. Для него характерно зеленое свечение. При такой болезни внутренних органов в них образуются амилоиды.
Морин используют для определения содержания кальция в тканях. После обработки спиртовым раствором образцы имеют зеленую люминесценцию.
Черный солохром применяют для выявления алюминия. Он сопровождается желто-оранжевым свечением.
Родамин 6Ж необходим для определения сурфактанта в тканях легких. На его наличие указывает оранжевая люминесценция.
Реакция иммунной флюоресценции
Благодаря методу флуоресцирующих тел выявляют антитела, гормоны, продукты метаболизма и др. Реакция иммунной флюоресценции определяет рак и инфекции на ранних стадиях. Возможности таких исследований расширило развитие иммунохимии. Сейчас небелковые соединения в тканях выявляют искусственными гаптенами.
Особенности исследования отдельных молекул и микроорганизмов
В теории можно сделать изображение какой-либо молекулы, используя оптические устройства, красящие вещества, ультрафиолет и светофильтр. Объект исследования должен флюоресцировать на темном фоне, а остальные частицы нет. Их цветовое значение близко к нулю.
Детектор микроскопа распознает не только излучение нужной молекулы, но и реагирует на иные фотоны. Они попадают на люминесцентное устройство от других источников света.
Сейчас для детального анализа образца применяют оптико-механические приборы и электронно-вычислительную технику. С помощью современного программного обеспечения ее подключают к монитору. На него выводится трехмерное изображение. После получения информации о координатах новых частиц компьютер микроскопа запоминает их расположение. Они исчезают с экрана.
Получить изображение объекта легко с помощью оптики, дополнительной техники и ПО. Качество снимка будет ниже, чем при применении люминесцентного устройства. Иногда для наблюдений такой способ допускается, т.к. не всегда требуется сверхвысокое разрешение.
Для осуществления наблюдения понадобятся:
Сфера применения люминесцентной микроскопии
Флюоресцентный микроскоп незаменим в биологии, медицине, а также смежных областях. Он позволяет проводить точные исследования клеток и тканей организмов. Главным преимуществом люминесцентной микроскопии считается возможность увидеть образец изнутри. Остальные приборы изучают лишь поверхность объекта.
Флюоресцентные устройства часто используют криминалисты. Они сравнивают образцы тканей и веществ для установления их принадлежности. Свечение применяется в санитарно-эпидемиологических исследованиях. Оно помогает выделять бактерии и клеточные структуры из-за способности взаимодействовать лишь с нужными красителями.
Явление флуоресценции открыли в 1852 г., но громоздкие микроскопы имели плохое разрешение. Новейшие технологии позволяют использовать люминесцентные ферментные метки, делающие устройства компактными. Их разрешение обладает высоким качеством.
Метод люминесцентной микроскопии является незаменимым для:
Применение эффекта свечения нужной длины волны у молекул помогает распознать вирусы и бактерии с высочайшей точностью.
Другие микроскопы выявляют только наличие инфекции. Благодаря разрешению 1 нм получают четкие и яркие изображения.
Принцип работы люминесцентного микроскопа
Принцип работы устройства заключается в испускании излучения объектом исследования вслед за светом возбуждения — электромагнитной волной с ультрафиолетовым диапазоном. Иногда используются зеленые или синие лучи. Они являются видимыми.
В микроскоп устанавливают зеркало, направляющее на исследуемый образец поток света. Его источником является ксеноновая или ртутная лампа. Отдельные лучи поглощаются материалом, остальные отражаются и направляются в пространство. Под ним подразумевается и глаз человека. Отраженное свечение источника забирает слабое излучение — собственное свечение микрообъекта. Для его отделения от ультрафиолета перед линзами устройства размещают светофильтр. Он отсекает лучи с более короткой электромагнитной волной.
Люминесценция отличается двойственным происхождением.
Большинство веществ светятся самостоятельно из-за воздействия ультрафиолетовых лучей. В других случаях к образцам добавляют флюорохромы.
Преимущества люминесцентной микроскопии
Люминесцентная микроскопия имеет множество достоинств. Основным является возможность изучения живых клеток и микроорганизмов. Исключается опасность их соединения или окрашивания, что провоцирует гибель. Поэтому ученые могут:
Пример наглядности результата
Ярким примером служит изучение глиальной ткани человеческого мозга с помощью оптического и фазово-контрастного устройства. При сравнивании изображения выводы может сделать любой человек, не имеющий специальных знаний.
При применении оптического микроскопа клетки мозга выглядят прозрачными. Можно увидеть только части, имеющие выраженное преломление, к примеру мембрану или ядро. Полученная картинка не подходит для подробного изучения образца.
При использовании метода фазового контраста детали хорошо различимы. На четком изображении видны мельчайшие клеточные структуры и места их соединения друг с другом.
Как интерпретировать
Образцы, окрашенные флюорохромами, рассматривают, увеличивая в 200-630 раз. Однако чаще используется значение 400. При изучении препаратов после обработки карболовым фуксином изображение увеличивают в 1000 раз. Поэтому поле зрения объектива на люминесцентном микроскопе намного больше, чем простом.
Например, при диагностике туберкулеза методом флуоресцентной микроскопии есть свои тонкости. Приводится рекомендуемое количество полей для просмотра. Мазок оценивают как отрицательный, применяя различную степень увеличения.
Понятие флуоресценции.
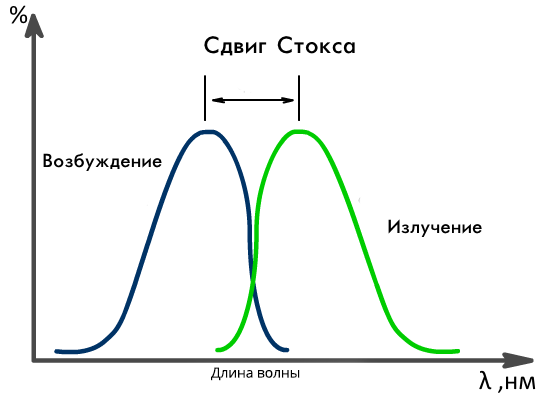
Флуоресценция (люминесценция)– физическое явление, заключающееся в поглощении кванта света веществом, способным флуоресцировать (флуорофором), с последующим быстрым испусканем другого кванта, со свойствами, отличными от исходного. По сути явление флуоресенции представляет из себя переход электронов по энергетическим уровням вещества. Энергия, получаемая атомом вещества при облучении делится на две части. Меньшая расходуется на релаксацию, а большая уходит на излучение фотона определенной энергии. Спектр флуоресценции сдвинут относительно спектра поглощения в сторону длинных волн.
Флуоресцентные методы исследования основаны на наблюдении микроскопических объектов с использованием их способности к свечению.
По сравнению с методами обычной микроскопии исследование в свете люминесценции обладает рядом преимуществ:
В медицинской микробиологии применяют два метода люминесцентной микроскопии: флуорохромирования и флуоресцирующих антител.
В основе флуоресцентной микроскопии лежит способность некоторых веществ поглощать свет определенной части спектра, энергия которого затем частично выделяется в виде света. Испускаемый свет отличается от поглощенного света длиной волны и интенсивностью. В соответствии с правилом Стокса длина волны испускаемого света больше, чем длина волны поглощаемого света, и эта разность длин волн лежит в основе наблюдения флуоресценции при флуоресцентной микроскопии. Интенсивность испускаемого света меньше, чем интенсивность возбуждающего света, так как количество выделяемой энергии во много раз меньше того количества энергии, которое требуется для возбуждения.
Схематическое изображение сдвига Стокса.
Его причиной являются безызлучательные релаксационные процессы. В результате часть энергии поглощенного фотона теряется, а испускаемый фотон имеет меньшую энергию, и, соответственно, большую длину волны. Рассмотрим, каким образом испускание и поглощение света реализовано во флуоресцентном микроскопе.
Люминесцентный (люминесцентный микроскоп)
Люминесцентный микроскоп строится на базе прямого или инвертированного микроскопа добавлением флуоресцентных модулей: осветителя отраженного света, туррели флуоресцентных фильтр-кубов, специального источника света(галогенового или металлгалидного), и, опционально, план полу апохроматическими объективами (планфлуоритами, Plan Fluorite), с расширенной спектральной пропускной характеристикой.
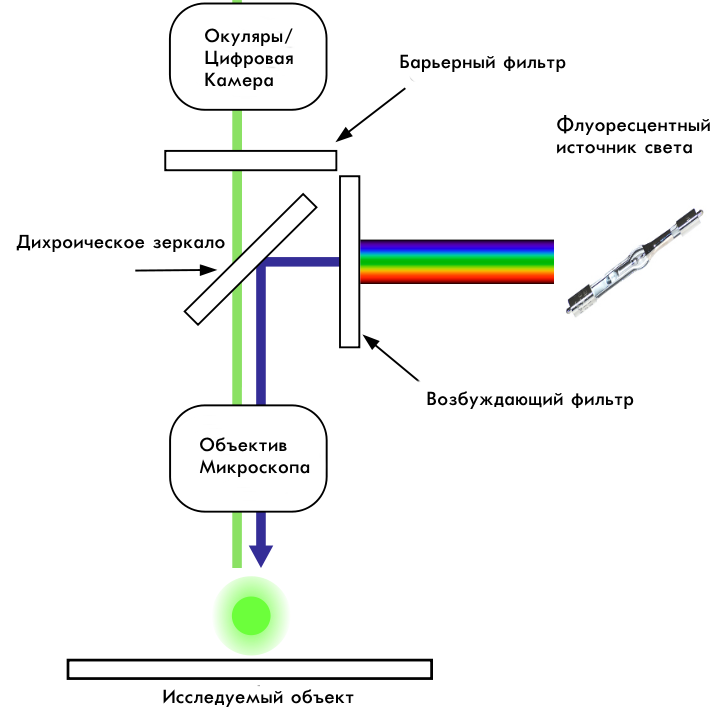
Флуоресцентный микроскоп обладает следующим ходом лучей. На рисунке приведена схема прямого микроскопа, в инвертированном микроскопе схема полностью аналогична, только зеркально отражена сверху вниз.
Ход лучей прямого люминесцентного микроскопа
Из спектра, испускаемого флуоресцентным источником света, вырезается полоса возбуждения необходимой ширины. (На примере это синее возбуждение, около 450 нм). Возбуждающий луч отражается от дихроичного зеркала и попадает на образец через объектив. Дихроичное зеркало отражает лучи до определенной длины волны (в данном случае до 460 нм), и пропускает лучи с большей длинной волны. В образце флуорофоры поглощают возбуждающий синий свет, и испускают более длинноволновое излучение. Флуоресцентное свечение беспрепятственно проходит через дихроичное зеркало, а барьерный фильтр отсекает нам необходимый для изучения спектр. Его необходимость заключается в том, что иногда флуоресцентное свечение находится в очень широком диапазоне длин волн, что мешает исследователю установить природу и свойства интересующего образца.
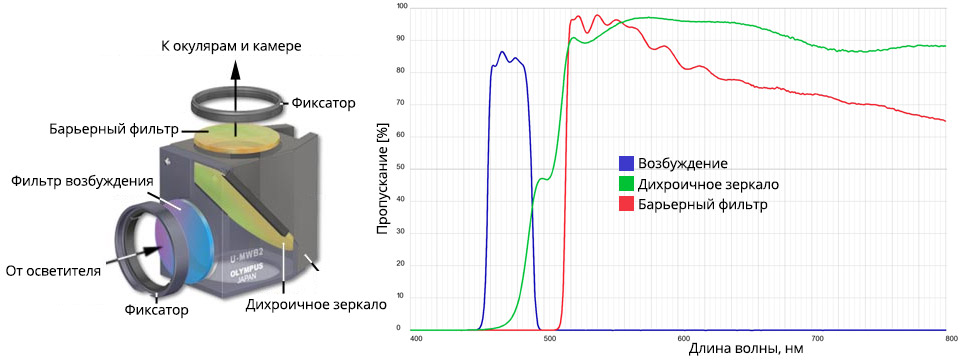
Флуоресцентный фильтр (флуоресцентный куб), устройство и спектральная характеристика.
На рисунке изображен флуоресцентный фильтр блок (часто встречается название флуоресцентный куб) U-MWB2, Olympus, и его спектральная характеристика. Возбуждение 460-490 нм, дихроик 500 нм и эмиссия (или барьерный фильтр) 520+ нм. Это означает, что фильтр широкополосный, и позволяет наблюдать одновременно различный окрас разных флуоресцентных меток.
Спектральные характеристики фильтров Olympus можно найти по ссылке.
Если у Вас возникнут вопросы по подбору фильтров для флуоресценции, Вы можете обратиться к нашим специалистам и они с удовольствием помогут Вам в выборе.
Для наблюдения флуоресценции абсолютно необходимо предотвратить смешение в микроскопическом изображении возбуждающего света и испускаемой флуоресценции. Качество изображения во флуоресцентной микроскопии в значительной степени определяется контрастом и яркостью изображения. Контраст изображения определяется отношением флуоресценции специфически окрашенных структур к фоновому свету. Однако оптимальный контраст может достигаться в слабых флуоресцентных изображениях благодаря, например, использованию узкополосных светофильтров, которые часто имеют небольшое пропускание. В то же время для облегчения визуальных наблюдений, для фотографирования с использованием относительно коротких выдержек и для измерений требуется сравнительно яркое изображение. Таким образом, в большинстве случаев необходимо достичь компромисса между интенсивностью специфической флуоресценции и уровнем неспецифической флуоресценции фона.
Теоретические основы работы люминесцентных сенсоров. Хронофлуорометры
21.1. Общие сведения о люминесценции
Напомним, что люминесценцией называют вызванное каким-то возбуждающим фактором избыточное (над тепловым) излучение тел, которое запаздывает относительно возбуждения на время, значительно больше периода световых колебаний.
В зависимости от причины возбуждения атомов или молекул различают:
По времени задержки люминесценции относительно возбуждения различают такие ее виды, как флуоресценция и фосфоресценция. При флуоресценции время задержки очень мало (не больше условной границы в 1 мс). Она достаточно быстро затухает после прекращения возбуждения. При фосфоресценции, наоборот, задержка и затухание люминесценции после прекращения возбуждения очень значительны – больше условной границы в 1 с. Иногда фосфоресценция продолжается в течение многих десятков часов. Люминесценция с промежуточными значениями задержки во времени (между 1 мс и 1 с) специального названия не имеет. Изменения задержки люминесценции относительно возбуждения могут нести ценную информацию об объекте наблюдения.
Спектральный состав люминесценции зависит от свойств излучающего тела и при фотолюминесценции, например, отличается от спектрального состава возбуждающего света. Энергия квантов люминесценции обычно меньше энергии, полученной атомом, молекулой или кристаллом в результате возбуждения. Поэтому, скажем, спектр фотолюминесценции всегда сдвинут относительно спектра возбуждающего излучения в сторону красной области спектра. Изменения в спектральном составе люминесценции также могут быть первичным информационным сигналом в интеллектуальном сенсоре.
Интенсивность флуоресценции, как правило, пропорциональна интенсивности возбуждения (например, интенсивности возбуждающего света, интенсивности рентгеновского облучения, силе тока электронного пучка и т.п.). Интенсивность эта может зависеть от ряда внешних факторов. Например, с повышением температуры интенсивность флуоресценции, как правило, уменьшается. Это явление называют температурным тушением люминесценции. Некоторые факторы, наоборот, могут благоприятствовать люминесценции, интенсивность которой возрастает. Поэтому, измеряя интенсивность люминесценции, можно получить информацию о наличии и поведении каждого из таких «факторов».
Люминесценцию уже давно применяют для выявления дефектов в изделиях, для исследования художественных полотен, свойств кристаллов, выявления примесей, для считывания невидимых без специального возбуждения штрих-кодов или маркировок и т.п.
Наблюдение, измерение и анализ люминесцентного излучения биологических объектов может давать много ценной информации о состоянии и функционировании этих объектов. Рассмотрим один из важных для практики примеров.
21.2. Теоретические основы метода индукции флуоресценции хлорофилла
Одним из фундаментальных процессов жизнедеятельности растений является фотосинтез – образование под действием света углеводов, глюкозы и других органических веществ из молекул воды и углекислого газа с выделением кислорода. Именно фотосинтез является главным источником наращивания биомассы на планете, очищения атмосферы Земли от углекислого газа и обогащения её кислородом. В этом отношении совсем не является преувеличением утверждение о том, что фотосинтез лежит в основе всей жизни на Земле.
По тому, насколько эффективно происходит в растениях фотосинтез, можно судить об их здоровье и о состоянии окружающей среды, определять оптимальные условия произрастания, прогнозировать дальнейшее развитие растений и их плодородие. Нарушения в фотосинтезе начинаются, как правило, еще задолго до того, как изменится внешний вид растения. Обнаружив нарушения фотосинтеза, можно еще на ранней стадии выявить заболевания растений, ухудшение состояния окружающей среды и своевременно помочь растениям, проведя соответствующие агротехнические мероприятия (увлажнение, подкормку, обработку против болезней и т.п.).
21.2.1. Краткие сведения о механизме фотосинтеза
Первичными для этого процесса являются акты поглощения света в хлоропластах молекулами хлорофилла и других биологических пигментов («светосборщиков»), которые обеспечивают эффективное собирание на нужды фотосинтеза энергии из почти всего спектра дневного света. Электронные возбуждения, которые возникают в результате поглощения света, передаются на так называемые «реакционные центры» хлоропластов. Доставленная сюда энергия возбуждения может быть использована:
а) на стимулирование фотохимических реакций;
б) на флуоресценцию в красной области спектра;
в) на безизлучательную диссипацию с преобразованием энергии возбуждения в тепловую энергию.
Безизлучательная диссипация определяется в основном температурой листьев и мало зависит от эффективности расходования энергии на фотосинтез. Таким образом, биохимические реакции фотосинтеза и флуоресценция являются конкурирующими каналами утилизации собранной энергии возбуждения. Чем больше поглощенной в хлоропластах световой энергии идет на фотосинтез, тем меньше интенсивность флуоресценции хлорофилла. И, наоборот, если фотосинтез тормозится, угнетается какими-то факторами, тогда возрастает интенсивность флуоресценции хлорофилла. Таким образом, флуоресценция хлорофилла – это «изобретенный» и предоставленный нам природой механизм сигнализации о ходе фотосинтеза в живом хлоропласте.
Известно, что фотосинтез – это сложный многостадийный биохимический процесс. Сначала ряд так называемых «световых» реакций в хлоропластах и находящихся в них молекулах хлорофилла обеспечивает перенос в два этапа (на т.н. «фотосистемах І и ІІ») валентных электронов от молекул воды (ионов гидроксила) к молекулам НАДФ (никотинамидадениндинуклеотидфосфата) – одному из важных промежуточных ферментов фотосинтеза, с повышением их энергии. В переносе электронов принимают участие и ряд других промежуточных ферментов. Дальше происходит ряд так называемых «темновых» реакций фотосинтеза, известных под названием «цикла Кальвина», в ходе которых происходит синтез углеводов с поглощением молекул углекислого газа (СО2) и выделением молекул кислорода (О2), и фосфорилирование аденозиндифосфорной кислоты (АДФ).
21.2.2. Единицы измерения интенсивности освещения при фотосинтезе
Указанные соотношения для видимого света, возбуждающего фотосинтез,
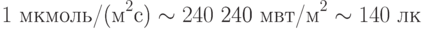 | ( 21.1) |
Уровень квантовой интенсивности возбуждающего света в 20 
21.2.3. Индукция флуоресценции хлорофилла
Если зеленый листок продолжительное время (15 
Для каждого из участков в табл. 21.1 указаны интервалы времени (после начала освещения), на которых они наблюдаются. Там же указаны и стадии фотосинтетического процесса, которым они соответствуют и которыми регулируются.
| № п/п | Участок кривой ИФХ | Вид (признак) участка | Интервал времени | Стадии фотосинтетического процесса, информацию о которых дает этот участок |
|---|---|---|---|---|
| 1 | Точка  | Начальный участок | 0. 5 мс | Эффективность собирания света и реакционных центров фотосистемы II |
| 2 | 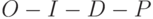 | Выход на главный максимум | 0,1. 10 с (0,01. 1 с) | Электронтранспортное звено (от 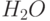 к Фд и НАДФ) – «световая стадия» фотосинтеза к Фд и НАДФ) – «световая стадия» фотосинтеза |
| 3 |  | Спад и выход на второй максимум | 3. 50 с (0,5. 10 с) | Активация (через Фд) белков-ферментов цикла Кальвина, установление градиента 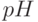 в мембранах, восстановление конкури-рующих акцепторов ( в мембранах, восстановление конкури-рующих акцепторов (  , ,  и т.п.) и т.п.) |
| 4 | 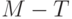 | Спад и выход на стационарный режим | 10. 300 с (10. 2000 с) | Налаживание реакций цикла Кальвина и потоков веществ по сосудам листка |
| 4,а |  | Выход на промежуточный минимум | 10. 100 с | Налаживание реакций цикла Кальвина |
| 4,б | 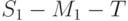 | Выход на стационарный режим | 50. 300 с (100. 2000 с) | Отладка транспорта веществ через мембраны и по сосудам листка |
Интервалы времени могут существенно различаться для разных видов растений и даже для разных листьев одного растения, которые имеют разный возраст или адаптировались к разным условиям освещения (например, растут возле корней или на кроне, на старых ветвях или на молодых побегах, хорошо освещены или все время затенены). Поэтому в графе таблицы «Интервал времени» приведены по два разных варианта значений, – чтобы был ясен диапазон варьирования.
Интенсивность флуоресценции хлорофилла в главном максимуме (точка 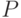

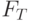
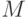
21.2.4. Влияние внешних факторов на кривую ИФХ
Чтобы продемонстрировать чувствительность кривой ИФХ как индикатора изменения физиологического состояния растений и условий окружающей среды, приведем уже хорошо изученное экспериментально влияние некоторых внешних факторов на эту кривую.
1. Повышение температуры внешней среды относительно оптимального для данного вида растений значения вызывает уменьшение величины 
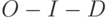
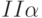
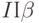
По этим признакам можно, например, быстро (еще не выращивая следующее поколение растений) отбирать сорта и экземпляры растений, более стойкие к жаре.
По указанным признакам кривой ИФХ можно быстро отбирать более морозостойкие экземпляры и сорта растений.
По указанным признакам кривой ИФХ теперь можно быстро отбирать растения, более стойкие к засолению почвы.
4. Водный дефицит вызывает уменьшение разности интенсивностей 
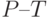
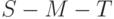
Совокупность указанных признаков можно использовать для целенаправленного отбора засухоустойчивых сортов и экземпляров растений.
Ботаники установили, что практически всегда можно подобрать виды или сорта растений, в которых кривые ИФХ особенно чувствительны к интересующему нас фактору ухудшения окружающей среды. Периодическое наблюдение ИФХ в них может быть эффективным инструментом для непрерывного мониторинга состояния окружающей среды, особенно в т.н. «зонах риска». С помощью соответствующих водорослей, в частности, можно надежно выявлять ухудшение или подтверждать улучшение состояния акваторий (озёр, болот, каналов, рек, морей).