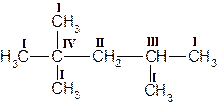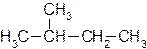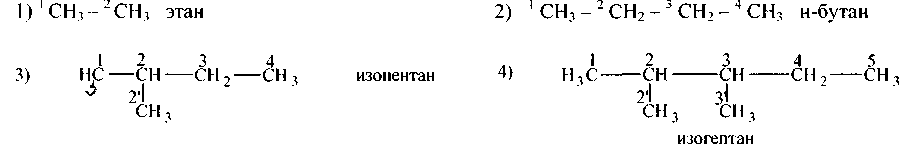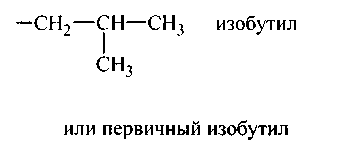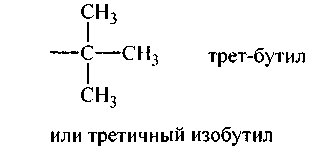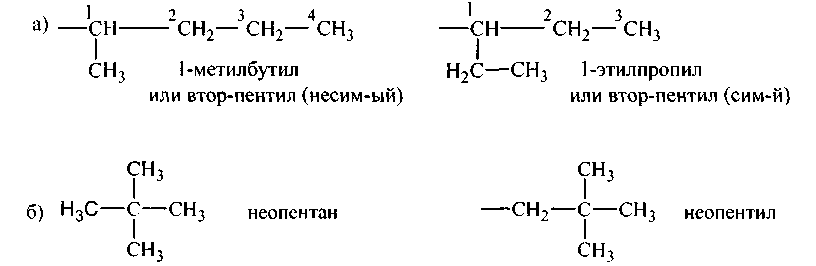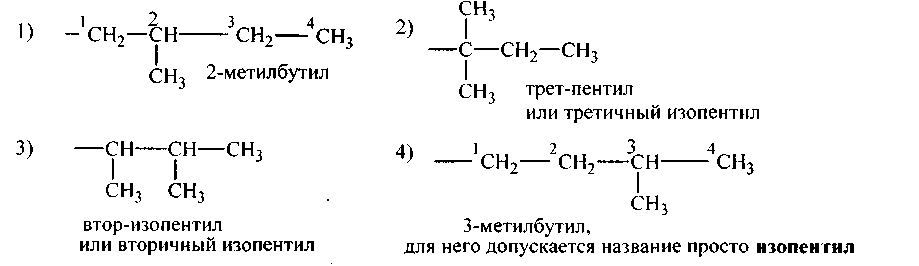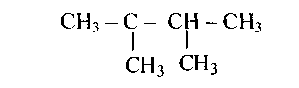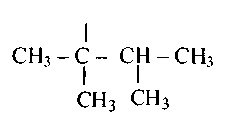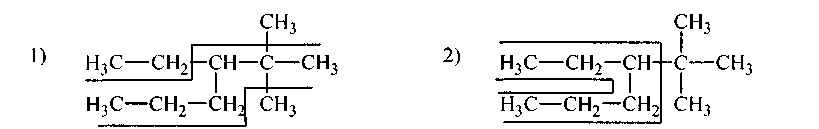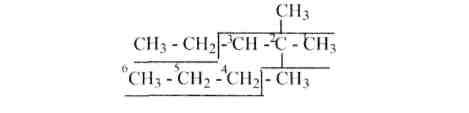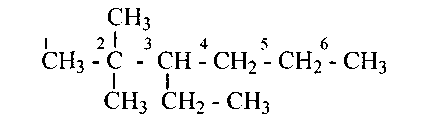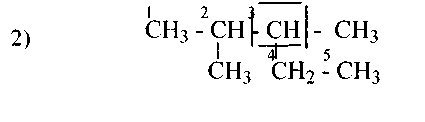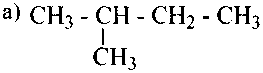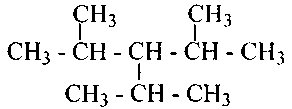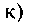Что такое первичные атомы
Первичный атом физической материи
Главными кирпичиками физической Вселенной служат атомы водорода, самого распространённого в природе элемента. Водород – абсолютно устойчив, и этим обеспечивается стабильность всех остальных элементов таблицы Менделеева, за исключением радиоактивных. Однако устойчивость атомов водорода определяется тем обстоятельством, что масса электрона намного меньше массы всех остальных частиц, в том числе и протона. Расчёты показывают, что если бы масса электрона была в два – три раза больше чем реально существующая, то все атомы водорода прекратили бы своё существование: электроны попадали на ядра и превратили их в нейтроны и нейтрино. В этом случае все космические объекты состояли бы из одних только нейтронов, никаких химических элементов не существовало бы. Картина нашего мира изменилась самым радикальным образом.
Как известно, земная жизнь – это углеродная жизнь. А химический элемент углерод образуется в недрах звёзд. Однако для синтеза углерода необходимо одновременное столкновение трёх ядер гелия. Как показывают расчёты, подобное событие в ядерной топке звёзды чрезвычайно маловероятно. Однако есть и другой путь: при столкновении двух ядер гелия образует ядро бериллия. А оно, в свою очередь, столкнувшись с ещё одним ядром гелия, может образовать ядро углерода. Но для того, чтобы это произошло, ядро бериллия и гелия должны быть «настроены в резонанс». Так вот, оказывается, что величина тепловой энергии в недрах типичной звезды как раз такова, что обеспечивает этот резонанс. Удивительное совпадение. Интересно высказывание по этому поводу Ф.Хойла: «Если вы хотели образовать углерод и кислород примерно в равных количествах в ходе звёздного нуклеосинтеза, то должны были бы задать два уровня (резонансов), причём именно там, где эти уровни и найдены. Здравая интерпретация фактов даёт возможность предположить, что в физике, а так же в химии и биологии экспериментировал «сверхинтелект».
Является ли атом водорода самым первичным атомом физического мира? Обратимся к восточным легендам, чтобы понять это.
Рассмотрим, например, подразделения физического мира.
Первое состоит из простых атомов седьмого состояния Материи.
Второе образуется из простых комбинаций однородных атомов –
Это электромагнитное состояние Физической материи.
Третье создаётся из более сложных комбинаций атомов –
Это световое состояние материи, или стихия эфира.
Четвёртое подразделение – ещё более сложной комбинацией:
Это тепловое состояние материи, или стихия огня.
Пятое состоит из комбинаций гораздо более сложных –
Это газообразное состояние материи, или стихия воздуха.
Шестое – это жидкое состояние материи, или стихия воды.
А седьмое состоит из твердых веществ – это стихия земли.
Глазами мы воспринимаем пять состояний материи физического мира. Это стихия земли (твёрдое вещество), стихия воды (жидкое вещество), стихия воздуха (газообразное вещество), стихия огня (тепловое состояние), стихия эфира (световое состояние). Электромагнитное состояние физической материи мы научились воспринимать через приборы. Осталось изучить физический вакуум и найти первый атом седьмого состояния материи Вселенной. Водород это газ, то есть получаем стихию воздуха. Пятое состояние физической материи. До самого первичного атома физического мира ещё четыре состояния материи.
Посмотрим, как строятся первичные атомы по восточным легендам.
Существует семь состояний Космической Духо-Материи.
Семь степеней тонкости её.
Нам ведомо седьмое состояние – материя физического мира.
Энергия Логоса
Вихревыми движениями невообразимой быстроты
Внутри Прекосмической Субстанции создаёт «вихри жизни».
Облечённые в тончайшую оболочку из Прекосмической Субстанции,
Эти вихри-атомы заполнены энергией Логоса.
Так атомная энергия Логоса строит первичные атомы –
Атомы первого, самого тонкого состояния Космической Материи.
Затем энергия Логоса строит атомы второго состояния,
Вокруг некоторых первичных атомов
Образуются спиральные вихри
Из грубейших комбинаций первого состояния Космической Материи.
Атомы всех следующих состояний Духо-Материи
Создаются аналогично атомам второго состояния.
В некоторых точках Прекосмической Субстанции возникают «вихри жизни», благодаря энергии Логоса. Эта энергия вихревыми движениями невообразимой быстроты заставляет вращаться Прекосмическую Субстанцию. Вращение происходит определённой части Прекосмической Субстанции вокруг вихря энергии. Получаем оболочку первичного атома самого тонкого состояния материи. Представьте, что вы мешаете кашу. Помещаете ложку в центр кастрюли и вращаете. Каша начинает вращаться вслед за вращением ложки. Каша это как бы оболочка атома, а ложка ядро. Но ложка ни сама вращается, а благодаря тому, что мы её вращаем. Так получается и в случае атома. Пока Живой Дух Логоса находится внутри оболочки атома, являясь его ядром, атом существует. Существует и всё Мироздание. Самый первый атом есть союз Духа и Материи, то есть Духо-Материя.
Толковый словарь. Комбинация – это сочетание, взаимное расположение чего-нибудь. Грубейший – это недостаточно обработанный, не разработанный в подробностях, более плотный.
Если спиральное движение происходит вокруг чего-то, то это похоже на наматывание клубка для вязания. Атом предыдущего состояния служит ядром для последующего, а грубейшие комбинации предыдущих атомов служат оболочкой для этого ядра. Так возникают атомы последующих состояний Материи. Каждый последующий атом становиться плотнее, так как состоит из предшествующих атомов, то есть из большего числа частиц.
Получаем, что первичный атом физического мира имеет семь оболочек. Он должен участвовать во всех состояния (подпланах) материи физической мира. Больше всего для этого подходят пока фотон или кварки. Фотон – это элементарная частица, квант светового излучения. Кварки – это элементарные частицы, из которых состоит большинство других элементарных частиц.
Источник информации книги С. Стульгинскиса «Великие тайны космоса»,
В.Н. Комарова «Тайны пространства и времени»
Приложение 1. Первичные, вторичные, третичные и четвертичные атомы углерода. Нормальная и разветвленная углеродная цепь.
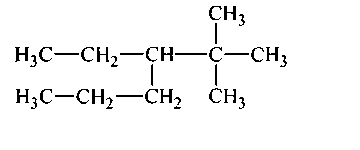
В молекулах гомологов метана принято различать первичные, вторичные, третичные и четвертичные атомы углерода в зависимости от числа связей, направленных данным атомом на связь с другими атомами углерода. Первичным называется атом углерода, связанный непосредственно с одним атомом углерода (три оставшиеся валентности направлены на связь с атомами водорода); вторичным – с двумя атомами углерода. Третичный атом углерода связан непосредственно с тремя, а четвертичный – с четырьмя атомами углерода (рис. 1).
Рисунок 1. Структурная формула молекулы 2,2,4-триметилпентана. Первичные, вторичные, третичные и четвертичные атомы углерода обозначены соответственно цифрами I, II, III, IV.
Углеродную цепь относят к нормальной (неразветвленной), если она содержит только первичные и вторичные атомы углерода, например:
Соответствующий углеводород называют алканом нормального строения или просто нормальным алканом.
Если же в углеродной цепи содержатся третичные или четвертичные атомы углерода, то ее называют разветвленной. Алкан с такой цепью называют разветвленным, например:
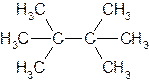
Характеристика атома углерода, структура, гибридизация, классификация
атом углерода Это, пожалуй, самый важный и символический из всех элементов, потому что благодаря этому возможно существование жизни. Он включает в себя не только несколько электронов или ядро с протонами и нейтронами, но и звездную пыль, которая в конечном итоге включается и образует живые существа.
Кроме того, атомы углерода находятся в земной коре, хотя их количество не сопоставимо с такими металлическими элементами, как железо, карбонаты, диоксид углерода, нефть, алмазы, углеводы и т. Д., Которые являются частью его физические и химические проявления.
Но как атом углерода? Первым неточным эскизом является тот, который наблюдается на изображении выше, характеристики которого описаны в следующем разделе..
Атомы углерода путешествуют через атмосферу, моря, недра, растения и любые виды животных. Его большое химическое разнообразие обусловлено высокой стабильностью его связей и тем, как они упорядочены в пространстве. Таким образом, он имеет с одной стороны гладкий и смазывающий графит; а с другой стороны, алмаз, твердость которого превосходит твердость многих материалов.
Если бы атом углерода не обладал качествами, которые его характеризуют, органическая химия не существовала бы полностью. Некоторые провидцы видят в нем новые материалы будущего через конструирование и функционализацию его аллотропных структур (углеродные нанотрубки, графен, фуллерены и т. Д.).
Характеристики атома углерода
Атом углерода обозначается буквой C. Его атомный номер Z равен 6, следовательно, он имеет шесть протонов (красные кружки с символом «+» в ядре). Кроме того, он имеет шесть нейтронов (желтые кружки с буквой «N») и, наконец, шесть электронов (голубые звезды).
Сумма масс их атомных частиц дает среднее значение 12.0107 ед. Однако атом на изображении соответствует 12-изотопу углерода ( 12 В), который состоит из д. Другие изотопы, такие как 13 С и 14 С, менее обильные, изменяются только по числу нейтронов.
Итак, если вы рисуете эти изотопы на 13 C будет иметь дополнительный желтый круг, а 14 С, еще два. Это логически означает, что они являются более тяжелыми атомами углерода.
В дополнение к этому, какие еще характеристики могут быть упомянуты в этом отношении? Он четырехвалентен, то есть может образовывать четыре ковалентные связи. Он расположен в группе 14 (НДС) периодической таблицы, более конкретно в блоке p.
Это также очень универсальный атом, способный связывать практически все элементы периодической таблицы; особенно с самим собой, образуя макромолекулы и линейные, разветвленные и пластинчатые полимеры.
структура
Обратите внимание, однако, что две звезды имеют более темный оттенок синего цвета, чем остальные четыре. Почему? Потому что первые два соответствуют внутреннему слою 1с 2 или [He], который не участвует непосредственно в образовании химических связей; в то время как электроны во внешнем слое, 2s и 2p, делают.
S и p орбитали не имеют одинаковую форму, поэтому проиллюстрированный атом не соответствует действительности; в дополнение к большой диспропорции расстояния между электронами и ядром, которое должно быть в сотни раз больше.
Поэтому структура атома углерода состоит из трех орбиталей, где электроны «тают» в рассеянные электронные облака. И между ядром и этими электронами есть расстояние, которое позволяет нам увидеть огромную «пустоту» внутри атома.
гибридизация
Ранее упоминалось, что атом углерода является четырехвалентным. В соответствии с его электронной конфигурацией его 2s-электроны спарены, а 2p-электроны спарены:
Остается свободная орбиталь, которая пуста и заполнена дополнительным электроном в атоме азота (2р 3 ).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для своего образования; Тем не менее, можно заметить, что в базальное состояние атома углерода, он едва имеет два неспаренных электрона (по одному в каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, и, следовательно, он образует только две связи (-C-).
Итак, как это возможно, что атом углерода образует четыре связи? Для этого вы должны продвинуть электрон с орбитали 2s на орбиту с более высокой энергией 2p. Это сделано, четыре получающиеся орбитали вырождаться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены).
Этот процесс известен как гибридизация, и благодаря этому теперь атом углерода имеет четыре орбитальных sp 3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с тем, что он является четырехвалентным.
зр 3
Таким образом, вы можете определить углеродный сп 3 потому что он образует только четыре простые связи, как в молекуле метана (СН4). И вокруг этого можно наблюдать тетраэдрическую среду.
Перекрытие sp орбиталей 3 она настолько эффективна и стабильна, что простая связь C-C имеет энтальпию 345,6 кДж / моль. Это объясняет, почему существуют бесконечные углеродистые структуры и неизмеримое количество органических соединений. В дополнение к этому, атомы углерода могут образовывать другие типы связей.
зр 2 и зр
Атом углерода также способен принимать другие гибридизации, которые позволят ему образовывать двойную или даже тройную связь.
Обратите внимание, что всегда (обычно), если вы добавите ссылки вокруг углерода, вы обнаружите, что число равно четырем. Эта информация важна при рисовании структур Льюиса или молекулярных структур. Атом углерода, образующий пять связей (= C≡C), теоретически и экспериментально недопустим.
классификация
Как классифицируются атомы углерода? Больше, чем классификация по внутренним характеристикам, в действительности это зависит от молекулярной среды. То есть, что внутри молекулы ее атомы углерода могут быть классифицированы в соответствии со следующим.
первичный
вторичный
третичный
четвертичный
И, наконец, четвертичные атомы углерода, как следует из названия, связаны с четырьмя другими атомами углерода. Молекула неопентана, С(СН3)4 имеет четвертичный атом углерода.
приложений
Атомная единица массы
Средняя атомная масса 12 C используется в качестве стандартной меры для расчета массы других элементов. Таким образом, водород весит двенадцатую часть этого изотопа углерода, который используется для определения того, что известно как атомная единица массы u.
Таким образом, другие атомные массы можно сравнить с 12 С а 1 H. Например, магний ( 24 Mg) весит примерно вдвое больше, чем атом углерода, и в 24 раза больше, чем атом водорода.
Углеродный цикл и жизнь
Растения поглощают СО2 в процессе фотосинтеза выделяют кислород в атмосферу и действуют как легкие растений. Когда они умирают, они становятся древесным углем, который после сжигания выделяет СО2. Одна часть возвращается к растениям, а другая попадает в морское дно, питая многие микроорганизмы.
Когда микроорганизмы умирают, оставшиеся твердые в его осадок биологического разложения, и через миллионы лет, он превращается в то, что известно как нефть.
Когда человечество использует это масло в качестве альтернативного источника энергии для сжигания угля, оно способствует выделению большего количества СО2 (и другие нежелательные газы).
С другой стороны, жизнь использует атомы углерода из самых глубоких ее основ. Это происходит из-за стабильности его связей, что позволяет ему формировать цепочки и молекулярные структуры, которые составляют макромолекулы, столь же важные, как ДНК.
ЯМР спектроскопия 13 С
13 С, даже если он в гораздо меньшей пропорции, чем 12 С его обилие достаточно, чтобы выяснить молекулярные структуры с помощью ядерной магнитно-резонансной спектроскопии углерода-13.
Благодаря этой методике анализа можно определить, какие атомы окружают 13 С и к каким функциональным группам они относятся. Таким образом, углеродный скелет любого органического соединения может быть определен.
Понятие о первичном, вторичном, третичном и четвертичном углеродных атомах
 |
Понятие о равноценных между собой углеродных атомах
Равноценными между собой называются такие углеродные атомы в одной молекуле, которые связаны с четырьмя соответственно одинаковыми атомами или группами атомов. Примеры:
В этане оба углеродных атома равноценны между собой. В н-бутане первый и четвертый углеродные атомы равноценны между собой, второй и третий углеродные атомы также равноценны между собой.
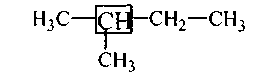
В изопентане равноценны между собой только 1-й и 2′ углеродные атомы. А четвертый углеродный атом с ними неравноценен (хотя он также имеет три атома водорода), ибо четвертая его валентность насыщена несколько иной группой атомов.
В приведенном здесь изопентане, равноценны между собой только первый и второй углеродные атомы, остальные неравноценны по тем же причинам.
Можно привести множество других примеров.
Одновалентные радикалы предельных углеводородов (алканов)
Алкилы изостроения
Равноценны между собой 1-й, 3-й и 2′ углероды, третичный углерод (2-й) с ними неравноценен.
Следовательно, возможны два алкила:
а) 1 СНз — СН2 — 3 СН2 — 4 СН2 — 5 СНз н-пентан. У пентана равноценные между собой попарно: 1-й и 5-й, 2-й и 4-й, а 3-й углерод с ними неравноценен. Возможны 3 алкила, один нормальный, два изомерного строения:
Возможен 1 алкил, ибо первичные углеродные атомы равноценны:
Равноценны между собой только 1-й и 2′. Следовательно, возможны четыре алкила:
Аналогично могут быть названы одновалентные радикалы других предельных углеводородов.
Рациональная (метановая) номенклатура
Предельных углеводородов
Эта номенклатура применяется для веществ сравнительно простого строения.
1. Если дана формула вещества и необходимо его назвать по рациональной номенклатуре, то составление названия складывается из следующих этапов.
Первый этап. Один атом углерода в молекуле алкана условно принимается за атом углерода метана, то есть за основу; причем выбирают тот углеродный атом, от которого отходят наиболее простые радикалы. Например, в изопентане, приведенном здесь, только третичный атом углерода удовлетворяет этому условию, только от него отходят наиболее простые радикалы:
2. Если дано название по рациональной номенклатуре (например, диметилизопропилметан) и необходимо привести формулу, то сначала пишут атом углерода метана с четырьмя свободными связями:
Затем присоединяют в любом порядке радикалы, приведенные в названии:
Далее, если необходимо, к углеродному атому метана (основы) присоединяют недостающие атомы водорода:
Систематическая (международная) номенклатура
Предельных углеводородов
Эта номенклатура применима к любым соединениям.
1. Рассмотрим отдельные этапы составления названия в конкретном случае, когда дана следующая формула:
Первый этап. В формуле алкана находят наиболее длинную цепь углеродных атомов, которую принимают за основу:
Причем если имеются две возможности выбора основы, как в нашем примере, то выбирают ту основу (1), от которой отходят наиболее простые радикалы.
Второй этап. Нумеруют атомы углерода основы с того конца, к которому ближе радикалы, отходящие от основы:
Третий этап. Перечисляют названия радикалов, связанных с основой, начиная с простых, объединяя одинаковые радикалы словами: ди, три, тетра, пента и т. д. Причем каждый радикал должен иметь одну цифру, показывающую, с каким атомом углерода основы он связан:
Четвертый этап. Приводят название основы. Оно зависит от количества углеродных атомов в основе (пропан, бутан, пентан, гексан и т. д.). Рассматриваемое соединение имеет следующее название:
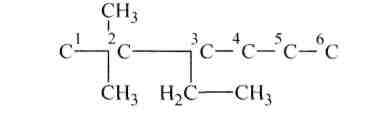
2. Если дано название по систематической номенклатуре и необходимо написать формулу, то приводят прежде всего углеродный скелет основы. В рассматриваемом выше примере основа имеет шесть атомов углерода:
Далее нумеруют углеродные атомы основы слева направо:
‘С- 2 С- 3 С- 4 С- 5 С- 6 С
затем присоединяют радикалы, приведенные в названии, соответственно цифрам, указывающим их положение.
Наконец углеродные атомы основы насыщают атомами водорода до 4-валентного состояния:
Например, тот же изопентан, который по рациональной (метановой) номенклатуре имел название диметилэтилметан, по систематической номенклатуре имеет название 2 —метилбутан
Рациональная номенклатура: метилэтилизопропилметан. Систематическая номенклатура: 2,3-диметилпентан.
Рациональная номенклатура: триметилизопропилметан. Систематическаяноменклатура: 2,2,3-триметилбутан.
Индивидуальные задания по I теме
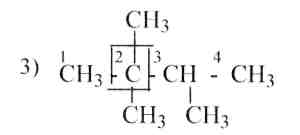
1.Назовите по рациональной и систематической номенклатурам следующие углеводороды:
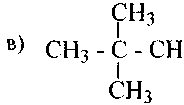 |
 |
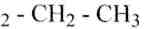 |

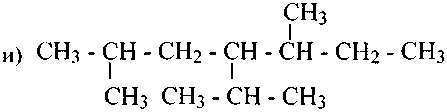
2. Приведите структурные формулы следующих углеводородов и назовите их по систематической номенклатуре:
3. Напишите формулы следующих углеводородов и назовите их по рациональной номенклатуре:
а) 3-метилпентан; б) 2,4-диметилпентан; в) З-метил-3-этилпентан; г) 2,2-диметил-З-этилгексан; д) 2,2,4-триметил-З-этилгексан; е) 2,2,4,4-тетраметилгексан; ж) 2,4-диметил-З-этилпентан; 3) 2,3-диметил-З-этилпентан; и) 2,5-диметил-3,4-диэтилгексан; к) 2,4,5-триметилгексан.
Общие задания по первой теме
1.Приведите формулы всех изомеров гексана и назовите их по рациональной и систематической номенклатурам. Укажите в двух из них равноценные углеродные атомы.
2.Напишите формулы следующих углеводородов и назовите их по систематической номенклатуре: а) пропилизопропил-трет-бутилметан;
Последнее изменение этой страницы: 2017-05-06; Просмотров: 3478; Нарушение авторского права страницы