Что такое планетарная модель атома краткое
Планетарная модель атома
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро. Следующим шагом в развитии планетарной модели стала модель Бора, постулирующая другие, отличные от классических, законы движения электронов. Полностью противоречия электродинамики смогла решить квантовая механика.
Полезное
Смотреть что такое «Планетарная модель атома» в других словарях:
планетарная модель атома — planetinis atomo modelis statusas T sritis fizika atitikmenys: angl. planetary atom model vok. Planetenmodell des Atoms, n rus. планетарная модель атома, f pranc. modèle planétaire de l’atome, m … Fizikos terminų žodynas
Боровская модель атома — Боровская модель водородоподобного атома (Z заряд ядра), где отрицательно заряженный электрон заключен в атомной оболочке, окружающей малое, положительно заряженное атомное ядро … Википедия
Модель — I Модель (Model) Вальтер (24.1.1891, Гентин, Восточная Пруссия, 21.4.1945, близ Дуйсбурга), немецко фашистский генерал фельдмаршал (1944). В армии с 1909, участвовал в 1 й мировой войне 1914 18. С ноября 1940 командовал 3 й танковой… … Большая советская энциклопедия
СТРОЕНИЕ АТОМА — (см.) построен из элементарных частиц трёх видов (см.), (см.) и (см.), образующих устойчивую систему. Протон и нейтрон входят в состав атомного (см.), электроны образуют электронную оболочку. В ядре действуют силы (см.), благодаря которым… … Большая политехническая энциклопедия
Атом — У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Резерфорд Эрнест — (1871 1937), английский физик, один из создателей учения о радиоактивности и строении атома, основатель научной школы, иностранный член корреспондент РАН (1922) и почетный член АН СССР (1925). Родился в Новой Зеландии, после окончания… … Энциклопедический словарь
Άτομο — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускул — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Планетарная модель атома
теория по физике 🧲 квантовая физика
Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.
Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10 –10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
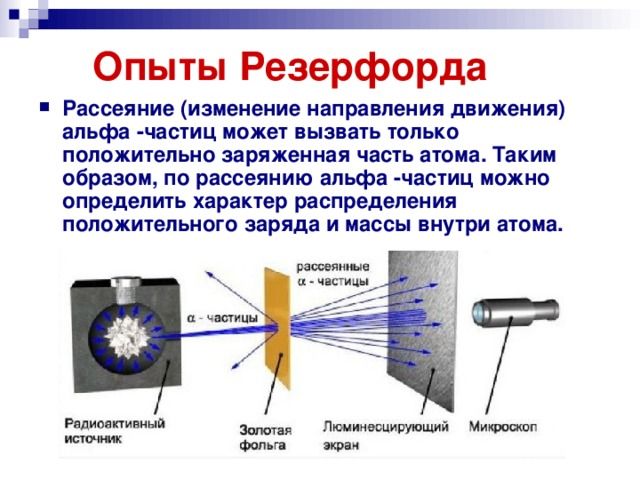
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:
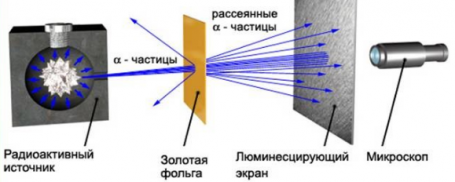
Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял микроскоп, с помощью которого можно было наблюдать столкновение полностью ионизированных атомов гелия с экраном. Ведь при каждом столкновении на экране можно было наблюдать вспышку — сцинтилляцию. Вся установка находилась внутри сосуда, из которого был выкачан воздух — это гарантировало отсутствие других факторов, которые могли бы повлиять на исход опыта.
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.
Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.
Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
q a — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
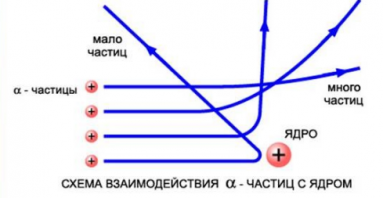
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного ядра. По его представлению, это было тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10 –12 –10 –13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10 –8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
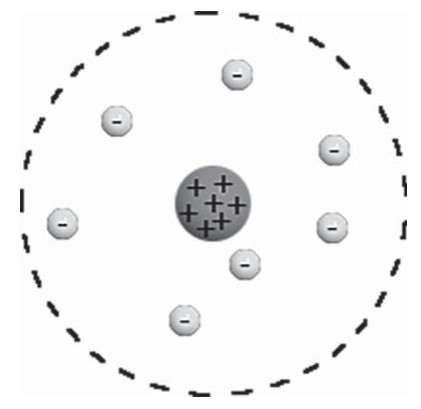
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное ядро. В нем сосредоточена почти вся масса атома. Но в целом атом является нейтральной частицей. Это связано с тем, что положительный заряд ядра уравновешивается отрицательным зарядом электронов, которые вращаются вокруг этого ядра подобно тому, как вращаются планеты вокруг Солнца. Но если планеты вращаются под действием гравитационных сил, то электроны вращаются под действием сил кулоновских (со стороны ядра).
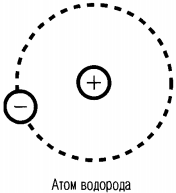
Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10 –8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
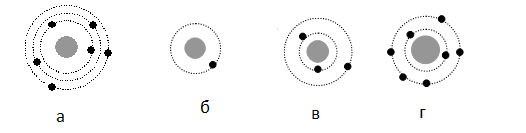
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63 Li соответствует схема:
Алгоритм решения
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
pазбирался: Алиса Никитина | обсудить разбор | оценить
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
а) нейтральным атомом углерода 9 6C б) ионом бериллия 7 4Be в) ионом лития 9 3Li г) нейтральным атомом бериллия 7 4B
Алгоритм решения
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Планетарная модель атома Резерфорда
«Каждый, кто надеется, что преобразования атомных ядер станут источником энергии, исповедует вздор.»
Эрнест Резерфорд
Модель Томсона была первым пробным шагом в познании микромира. Однако она не отвечала на многие вопросы. Требовался новый нестандартный взгляд для создания модели, способной разрешить возникшие противоречия.
Модель атома, предложенная Томсоном, давала только общее представление о строении атома и не согласовывалась со все новыми данными экспериментов и теоретических вычислений. Настало время создания другой модели, способной согласовать теорию и эксперимент.
Этого не может быть. Или факты — упрямая вещь
К 1904 году японский физик Хантаро Нагаока разработал раннюю «планетарную модель» атома — так называемый «атом типа Сатурна». Модель была разработана по аналогии с расчетами устойчивости колец Сатурна. И хотя впоследствии модель и оказалась ошибочной, два следствия из нее все-таки оказались пророческими:
Годом раньше немецкий физик Филипп фон Ленард попытался создать модель, которая не предполагала раздельное существование в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц — динамид, каждая из которых является электрическим дуплетом. Расчеты, выполненные Ленардом, показали, что эти частицы должны иметь очень маленькие размеры, то есть большая часть объема атома представляет собой пустоту.
В 1909 году Ганс Гейгер и Эрнест Марсден под руководством Эрнеста Резерфорда решили попытаться найти экспериментальное подтверждение модели Томсона и провели ставшие классическими опыты по рассеиванию альфа-частиц на тонкой золотой фольге. Альфа-частицы были выбраны благодаря своей большей массе (в 7350 раз больше массы электрона), поэтому они не должны претерпевать сколь-нибудь заметного отклонения при взаимодействии с электронами. Это позволяет исследовать только положительную составляющую атома. Источником альфа-частиц послужил радий. Частицы, проходящие через золотую фольгу, рассеивались, и это рассеяние регистрировалось по сцинтилляционным вспышкам на экране из сульфида цинка.
В начале эксперимента исследовались только малые углы отклонения альфа-частицы. И тут выяснилось, что подавляющее большинство частиц проходили сквозь фольгу, как раскаленная дробинка через кусок масла, словно мишень была прозрачна для бомбардирующих ее частиц. Наблюдалось лишь весьма незначительное отклонение порядка одного градуса.
Затем Резерфорд поручил молодому сотруднику Марсдену выяснить, могут ли частицы рассеиваться на большие углы. В частности, до 180°. И вот зимним днем 1909 года Марсден остановил на университетской лестнице Резерфорда и сказал: «Вы были правы, профессор: они возвращаются». Это было невероятно и противоречило существующей модели атома. Таким образом, вместо доказательства правоты Томсона эксперименты Резерфорда доказали ее несостоятельность.
Тот факт, что альфа-частицы возвращались, говорил о том, что они столкнулись с преградой — очень массивной положительно заряженной частицей, но эти столкновения происходили очень редко, в среднем — одно на восемь тысяч. А это уже свидетельство о том, что. Впрочем, именно над этим и задумался Резерфорд.
Альфа-частица (а-частица)— положительно заряженная частица, образованная двумя протонами и двумя нейтронами, по сути это ядро атома гелия. Поток альфа-частиц называют альфа-лучами, или альфа-излучением.
И все-таки он вертится!
И задумался он на целых два года. К 1911 году результатом его раздумий явилась новая модель строения атома. Однако обо всем по порядку.
Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота в большинстве случаев без отклонений.
Из этого следуют два вывода. Первый: легкие электроны практически не влияют на движение тяжелой альфа-частицы. Вывод второй: так как альфа-частицы в большинстве случаев отклоняются на малые углы, атом в большей части своего объема пустой.
Небольшая часть альфа-частиц все же отклоняется на значительные углы. А значит, вывод третий такой: центральная часть атома очень маленьких размеров, но в ней сосредоточена почти вся масса атома, и эта центральная часть имеет положительный заряд. Она и получила название ядра атома.
Согласно Резерфорду, атом состоит из массивного положительного ядра и вращающихся по определенным орбитам вокруг него электронов, что само по себе напомнило Солнечную систему, поэтому модель и получила название планетарной.
Если представить атом в виде сферы диаметром один километр — его ядро будет размером с мелкую монету.
Однако и эта модель атома оказалась в противоречии с классической физикой. Согласно теории Максвелла, любой ускоренно движущийся заряд должен непрерывно излучать электромагнитные волны. Поскольку электроны, вращаясь вокруг ядра, движутся с центростремительным ускорением, они должны непрерывно излучать электромагнитные волны. На самом же деле в нормальном состоянии атомы не излучают!
Таким образом, эти факты были несовместимы с планетарной моделью атома Резерфорда, если рассматривать ее с позиции классической электродинамики.
Разрешения этих противоречий были еще впереди. Пока же количество вопросов значительно превышало число удобоваримых объяснений. Тем не менее, это был значительный шаг на пути понимания устройства мира. Добавим лишь, что рассеяние микрочастиц на других частицах или атомных ядрах — это квантовый процесс, а для его описания необходимо уравнение Шредингера, которого в 1911 году еще попросту не было.
Планетарная модель атома.
Планетарная модель атома, или модель Резерфорда — это историческая модель строения атома, предложенная Эрнестом Резерфордом как результат эксперимента с рассеиванием альфа-частиц.
Для вычисления распределения «+» заряда в атоме, английский ученый Э. Резерфорд провел исследование рассеяния α-частиц фольгой из разных веществ. Большинство α-частиц беспрепятственно, практически не отклоняясь, проходило сквозь фольгу, и лишь 1 из 2000 частиц отклонялась на углы, большие 90°. Результатом этих экспериментов в 1911 г. стало предложение Резерфордом следующей модели строения атома.
Атом состоит из положительно заряженного ядра, вокруг него обращаются электроны, каждый по своей орбите, как планеты Солнечной системы, обращающиеся вокруг Солнца. Именно поэтому модель назвали планетарной.
Положительный заряд ядра qядра связан с числом электронов Z в атоме при помощи соотношения:

Заряд ядра и число электронов в атоме, соответственно, совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
В целом атом является электронейтральным. Электрон, отрываясь или присоединяясь к атому (как результат столкновения, например, либо при разных химических процессах) может образовывать положительно либо отрицательно заряженные ионы.
Простая и наглядная модель атома Резерфорда отлично объясняла результаты этих опытов. Но основываясь на этой модели строения атома нельзя объяснить факт существования атома и его устойчивость.
Это несоответствие опыта выводам теории связано с попыткой применения законов классической физики к внутриатомным явлениям (которые, как выяснилось, подчиняются законам квантовой механики).
Выход из образовавшейся в теории атома ситуации нашел датский физик Нильсом Бором.
Планетарная модель атома

Всего получено оценок: 259.
Всего получено оценок: 259.
На пути познания сложной структуры атомов вещества наукой пройден непростой путь. Одним из шагов на этом пути явилась планетарная модель атома. Рассмотрим эту модель подробнее.
Электроны и состав атома
Мысль о том, что все вещества в Природе состоят из мельчайших неделимых частиц – атомов, высказывалась еще в античные времена. По мере развития научных представлений, стало ясно, что это не совсем так. Минимальная частица вещества, сохраняющая свойства вещества – это молекула. Молекула же чаще всего состоит из нескольких атомов одного или разных элементов (но иногда молекула состоит из одного атома).
Однако, в самом конце XIXв были открыты электроны – их испускал нагретый электрод в колбе с вакуумом. Стало ясно, что даже атомы простого вещества имеют структуру. Согласно первой атомной теории Дж.Томсона атом представляет собой положительно заряженный шар, внутри которого заключены один или несколько электронов.

Опыты Э. Резерфорда
Для зондирования состава атома Э. Резерфорд использовал поток альфа-частиц, испускаемых радиоактивным препаратом на тонкую металлическую фольгу, а после прохождения фольги частицы попадали на экран, вызывая его свечение. По размеру зоны отклонения можно было судить о том, как воздействовал атом вещества фольги на альфа-частицу.
Альфа-частица (фактически, представляющая собой ядро атома гелия) имеет гораздо больший вес, чем электрон, таким образом, электроны не могут сколь-нибудь заметно повлиять на ее движение. Отклонение альфа-частицы может происходить только из-за взаимодействия с положительно заряженным атомом. При этом, чем равномернее распределен заряд по атому, тем меньше он будет отклонять альфа-частицу, влияя только на ее скорость (в результате кулоновского взаимодействия).
Опыт дал неожиданный результат. Большинство альфа-частиц, как и следовало ожидать, отклонялись очень слабо. Однако, небольшой их процент отклонялся на большие углы, иногда частицы полностью меняли направление движения. Модель Томсона никак не могла объяснить этого явления.
Планетарная модель атома
Поэтому была предложена планетарная модель строения атома, согласно которой внутри атома имеется маленькое положительно заряженное ядро, вокруг которого обращаются отрицательно заряженные электроны.
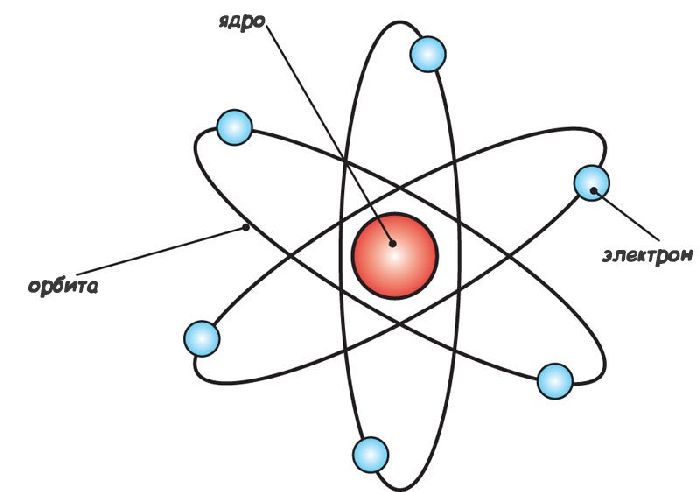
В целом атом получается нейтральным. Электроны не падают на ядро потому, что они вращаются вокруг него по круговым орбитам. Таким образом, атом подобен Солнечной системе, ядро подобно Солнцу, а электроны – планетам.
На самом деле атом заметно более «пуст», чем Солнечная система. Если атом увеличить так, чтобы ядро увеличилось до размера Солнца, орбиты электронов будут в сто раз дальше от Солнца, чем Земля.
Проблемы планетарной модели
Планетарная модель атома Резерфорда объяснила опыт по рассеянию альфа-частиц, однако, она противоречила электродинамике Максвелла, согласно которой заряд, движущийся с ускорением, должен излучать электромагнитные волны. Электрон, двигаясь по круговой орбите, имеет постоянное центростремительное ускорение, а значит, должен излучать, теряя энергию, и в конце концов, должен упасть на ядро. Расчеты показывали, что это должно происходить очень быстро. Однако, в реальности атомы устойчивы. Данное затруднение было преодолено только с развитием квантовой физики.
Что мы узнали?
Открытие электрона показало, что атом имеет сложную структуру. В результате опытов Э.Резерфорда была предложена планетарная модель строения атома, где весь положительный заряд и почти вся масса сосредоточена в ядре малых размеров, а электроны вращаются вокруг ядра на некотором расстоянии.