Что такое плановое чкв
3.1.2 Первичное чрескожное коронарное вмешательство
— Для снижения риска смерти первичное ЧКВ является предпочтительной реперфузионной стратегией в первые 12 часов от начала развития ИМпST, если ожидаемое время от момента постановки диагноза до проведения проводника в просвет инфаркт-связанной КА не превышает 120 минут [32].
Не следует рассматривать в качестве ограничений/противопоказаний к первичному ЧКВ возраст, указания на нарушенную азотвыделительную функцию почек, сопутствующие заболевания и состояния. Как относительные противопоказания к ЧКВ могут расцениваться непереносимость рентгенконтрастных веществ и чрезвычайно высокая масса тела пациента (превышающая ограничения, заявленные производителем ангиографической установки). В этих случаях возможна вынужденная тромболитическая терапия без последующего ЧКВ.
ЕОК IIaA (УУР A; УДД 2)
— Рекомендуется предпочесть первичное ЧКВ тромболизису для снижения риска смерти у пациентов с ИМпST, осложненным кардиогенным шоком или тяжелой сердечной недостаточностью, независимо от продолжительности задержки, связанной с организацией ЧКВ [39, 40].
— У пациентов с ИМпST с противопоказаниями к ТЛТ для снижения риска смерти рекомендуется стремиться выполнить ЧКВ, даже с существенными отклонениями в соблюдении временных требований [41, 42].
ЕОК IIaB (УУР A; УДД 3)
— При выполнении первичного ЧКВ при ИМпST для снижения риска смерти рекомендуется обязательное вмешательство на инфаркт-связанном сосуде [32, 44].
Комментарий: как правило, речь идет об устранении острой тромботической окклюзии крупной ветви КА. Доказательства в данном случае получены в метаанализах исследований, сравнивавших ЧКВ на инфаркт-связанной артерии с тромболитической терапией.
ЕОК IIа A (УУР B; УДД 1)
— У пациентов с ИМпST, осложненным кардиогенным шоком, из-за возможного увеличения риска смерти и почечной недостаточности рекомендуется воздержаться от одномоментных многососудистых ЧКВ, ограничившись вмешательством на инфаркт-связанной артерии [47, 48].
ЕОК IIIB (УУР B; УДД 2)
— Для снижения риска рецидива ИМ и необходимости в повторной реваскуляризации при первичном ЧКВ у пациентов с ИМпST рекомендуется предпочесть коронарное стентирование баллонной ангиопластике [49, 50].
Комментарий: метаанализы не выявили преимущества стентирования перед ангиопластикой на уровне снижения риска смерти. Большая часть доказательной базы, указывающей на преимущество ЧКВ перед ТЛТ на уровне смертности, получена при использовании баллонной ангиопластики (без стентирования). Поэтому воздерживаться от ЧКВ в виде баллонной ангиопластики, ссылаясь на отсутствие подходящих стентов, не оправдано.
Комментарий: информация о преимуществе СВЛ*** перед СБЛП*** на уровне смертности противоречива. Воздерживаться от стентирования с помощью СБЛП*** при отсутствии СВЛ*** не оправдано.
— Из-за отсутствия значимого влияния на риск ишемических событий и возможного увеличения риска инсульта при ЧКВ у пациентов с ИМпST рекомендуется воздержаться от рутинной тромбаспирации [54].
ЕОК IIIA (УУР A; УДД 1)
Комментарий: решение о выполнении тромбаспирации в начале или по ходу ЧКВ может быть принято на основании индивидуальных ангиографических и клинических данных пациента.
Комментарий: кроме уменьшения риска крупных кровотечений ишемических событий, выбор лучевого доступа вместо бедренного обеспечивает более раннюю активизацию пациента. Важно, что преимущество лучевого доступа перед бедренным очевидно лишь в учреждениях, где с помощью лучевого доступа выполняется более 80% всех диагностических и лечебных коронарных процедур.
Что такое плановое чкв
Показания к операции стентирования коронарных артерий
Планируя реваскуляризацию, в каждом случае следует оценить потенциальный риск и пользу ЧКВ в сравнении с альтернативными методами лечения (АКШ или медикаментозной терапии с модификацией факторов риска). А с пациентом и его семьей необходимо обсудить пользу и риск хирургической реваскуляризации (АКШ и ЧКВ) и медикаментозной терапии (необходимость двойной антитромбоцитарной терапии).
Присущие стентированию коронарных артерий техническая простота и низкая заболеваемость всегда выглядят привлекательно в сравнении с хирургическим лечением, но надо учитывать и негативные стороны ЧКВ: реальную вероятность развития рестеноза и возможность неполной реваскуляризации (восстановление кровотока не во всех стенозированных коронарных артериях).
Основными показаниями к реваскуляризации миокарда являются:
Инфаркт миокарда с подъемом сегмента ST.
Инвазивная коронарография c последующим переходом к чрескожному коронарному вмешательству показана всем пациентам (AHA/ACC, 2011г. Класс доказательства I).
Нестабильная стенокардия и инфаркт миокарда без подъема сегмента ST.
Наличие рефрактерной стенокардии, гемодинамической или электрической нестабильности является показанием к инвазивной коронарографии c последующим переходом к чрескожному коронарному вмешательству (AHA/ACC, 2011г. Класс доказательства I).
Стабильная ИБС.
Достижения в области техники, оборудования, стентов и лекарственной терапии сделало ЧКВ рутинной и безопасной процедурой, выполняемой у больных стабильной ИБС, при подходящей анатомии коронарных артерий. Риск смертности, связанной с процедурой ЧКВ при хронической ИБС – 0,5% (ESC, 2013г.). Основные показания – стенокардия, резистентная к медикаментозной терапии, и прогностически неблагоприятное поражение коронарного русла – проксимальные гемодинамически значимые стенозы коронарных артерий с сужениями на 75% и более.
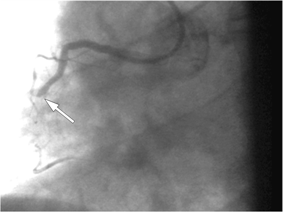
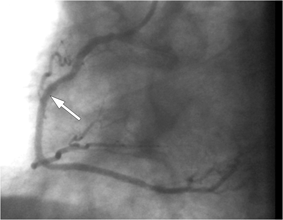
Клинический пример стентирования коронарных артерий. Коронарограмма пациентa N., 56лет.
Коронарограмма правой коронарной артерии (ПКА): окклюзия (полное сужение) средней трети ПКА. Стрелкой указано место окклюзии.
Коронарограмма ПКА после выполненной операции реканализации и стентирования средней трети ПКА. Стрелкой указана локализация стента.
Противопоказания к стентированию коронарных артерий.
Абсолютных противопоказаний к стентированию коронарных артерий нет. Основное противопоказание – невозможность назначения антитромбоцитарной терапии.
Относительные противопоказания: острая почечная недостаточность, хроническая почечная недостаточность, продолжающееся желудочно-кишечное кровотечение, лихорадка неясного генеза возможно инфекционного, нелеченный активный инфекционный процесс, острый инсульт, тяжелая форма анемии, злокачественная неконтролируемая артериальная гипертензия, выраженные электролитные нарушения, отсутствие контакта с пациентом в связи с психологическим состоянием или тяжелым заболеванием, тяжелая сопутствующая патология, при которой коронарография может осложнить течение заболевания, отказ пациента от необходимого дальнейшего лечения (коронарная ангиопластика, аорто-коронарное шунтирование, протезирование клапана), дигиталисная интоксикация, документированная анафилактическая реакция на контрастное вещество, тяжелые заболевания периферических сосудов, затрудняющие доступ в сосудистое русло, декомпенсированная застойная сердечная недостаточность или отек легких, тяжелая коагулопатия, эндокардит аортального клапана.
Следует учитывать, что большинство относительных противопоказаний может носить временный или обратимый характер. Поэтому, если проведение стентирования коронарных артерий можно отсрочить, тем самым можно значительно уменьшить риск развития осложнений.
Риски чрескожных коронарных вмешательств.
Несмотря на низкую частоту осложнений, ЧКВ является инвазивной манипуляцией, и ее проведение сопряжено с определенным риском.
Основные осложнения, встречающиеся при проведении ЧКВ, — это цереброваскулярные осложнения (0,22%), сосудистые осложнения (от 2%), летальный исход (1,27%), реакция на контрастное вещество (0,37%).
Частота смертности среди пациентов, подвергнутых плановому ЧКВ – 1,27%. Факторами, увеличивающие риск смерти от ЧКВ, являются возраст, сопутствующие заболевания (сахарный диабет, хроническая почечная недостаточность, хроническая сердечная недостаточность), многососудистое поражение коронарного русла. Экстренное ЧКВ при инфаркте миокарда с подъемом сегмента ST и кардиогенном шоке увеличиват риск до 4,81%.
Основным фактором, лимитирующим эффективность коронарного стентирования, является процесс рестенозирования. Рестеноз – повторное сужение просвета сосуда, приводящее к снижению кровотока. In-stent рестеноз – повторное сужение просвета коронарного сосуда внунтри стента.
Факторами риска рестеноза являются:
– генетическая предрасположенность к повышенной пролиферации неоинтимы;
– сахарный диабет;
– параметры пораженного сегмента: диаметр сосуда, длина повреждение, тип стеноза;
– особенности течения процедуры: протяженность повреждения сосуда, остаточная диссекция, количество имплантируемых стентов, диаметр стента и соотношение его площади с поверхностью сосуда.
Поиски путей эффективной профилактики рестенозирования начались с самого начала применения стентирования. Наибольшие результаты достигнуты при оптимизации характеристик стента и улучшения методики его имплантации. Все попытки системной фармакологической терапии не достигали серьезных успехов. За последнее время использование стентов с лекарственным покрытием показало явное их преимущество в борьбе с рестенозом. Подробнее о стентах с антипролиферативным покрытием и путях профилактики рестеноза.
Экстренные операции при инфаркте миокарда
Кратко о методе лечения
Преимущества лечения в ИСЦ
Показания и противопоказания к методу лечения
Показанием к проведению стентирования является:
Абсолютных противопоказаний к стентированию коронарных артерий нет. Основное противопоказание – невозможность назначения антитромбоцитарной терапии.
Относительные противопоказания: острая почечная недостаточность, хроническая почечная недостаточность, продолжающееся желудочно-кишечное кровотечение, лихорадка неясного генеза возможно инфекционного, нелеченный активный инфекционный процесс, острый инсульт, тяжелая форма анемии, злокачественная неконтролируемая артериальная гипертензия, выраженные электролитные нарушения, отсутствие контакта с пациентом в связи с психологическим состоянием или тяжелым заболеванием, тяжелая сопутствующая патология, при которой коронарография может осложнить течение заболевания, отказ пациента от необходимого дальнейшего лечения (коронарная ангиопластика, аорто-коронарное шунтирование, протезирование клапана), дигиталисная интоксикация, документированная анафилактическая реакция на контрастное вещество, тяжелые заболевания периферических сосудов, затрудняющие доступ в сосудистое русло, декомпенсированная застойная сердечная недостаточность или отек легких, тяжелая коагулопатия, эндокардит аортального клапана.
Подготовка к лечению
Обезболивание при лечении
Как проходит метод лечения
Стентирование коронарной артерии при инфаркте миокарда включает в себя следующие этапы:
Аорто-коронарное шунтирование проводится на открытом сердце. Суть заключается в том, чтобы создать обходной путь (шунт) от аорты к коронарной артерии, обходя место закупорки или сужения. Обычно материалом для шунта служит собственная вена человека, иногда приходится использовать искусственный материал. Об этапах самого аорто-коронарного шунтирования Вам подробнее расскажет Ваш лечащий врач.
Чрескожные коронарные вмешательства при стабильном течении ИБС
Донецкая О.П., Шульдешова Н.В.
В Российской Федерации основной причиной смертности населения остается ишемическая болезнь сердца. В последние годы все более широко используются чрескожные коронарные вмешательства (ЧКВ), направленные на полное или частичное восстановление коронарного кровотока. Хорошо известно, что первичная ангиопластика в остром периоде инфаркта миокарда с подъемом сегмента ST снижает смертность и риск повторного ИМ. Кроме того, у больных с нестабильной стенокардией и ИМ без подъема сегмента ST проведение стентирования также сопровождается улучшением краткосрочного и отдаленного прогноза. После обнадеживающих результатов ЧКВ в исследованиях у больных с острым коронарным синдромом (ОКС) быстро распространилось мнение, что ЧКВ улучшает прогноз при всех формах ИБС, в том числе и стабильной. Во многих исследованиях показано, что инвазивные методы у пациентов с хронической ИБС по сравнению с медикаментозным лечением дополнительно облегчают симптомы стенокардии и улучшают переносимость кратковременных физических нагрузок. Однако, на сегодняшний день оптимальная современная стратегия применения инвазивного лечения ИБС вне обострения и влияние на прогноз четко не определены.
Безусловно, существует ряд теоретических предпосылок для положительного влияния ЧКВ на прогноз пациентов со стабильной ИБС. Доказана четкая связь степени выраженности гемодинамически значимого стеноза и риска развития отдаленных неблагоприятных событий. Выявление ишемии миокарда у больных с подтвержденной или предполагаемой ИБС увеличивает риск общей и сердечно–сосудистой смертности, частоты развития ИМ даже при отсутствии стенокардии. Проведение реваскуляризации у бессимптомных больных со значительной массой ишемизированного миокарда приводит к улучшению их отдаленного прогноза. Кроме того, очевидно, что ишемия миокарда является пусковым механизмом для развития желудочковых тахикардий/фибрилляции желудочков, что приводит к развитию внезапной смерти. Поэтому неудивительно, что степень поражения коронарного русла коррелирует с выживаемостью в отдаленном периоде.
Учитывая указанные теоретические предпосылки, были проведены несколько клинических исследований, в которых сравнивались консервативная медикаментозная терапия и ее сочетание с ЧКВ. Наиболее современными и крупными из завершенных на данный момент исследований являются COURAGE, BARI 2D, JSAP.
В многоцентровое исследовании COURAGE с 1999 по 2004 год включили 2287 больных стабильной ИБС с объективными признаками ишемии миокарда (депрессия сегмента ST в покое или ишемия, индуцированная нагрузкой) и стенозом >70% просвета проксимального отдела одной и более коронарной артерии. 1149 пациентов рандомизировали в группу первичной ЧКВ и оптимальной медикаментозной терапии с коррекцией образа жизни. 1138 больных получали только медикаментозную терапию. За средний период наблюдения 4,6 года (у некоторых пациентов длительность наблюдения достигала семи лет) кривые, отражающие частоту наступления первичной конечной точки в обеих группах (смерть от любых причин или инфаркт миокарда), практически не расходились. Кумулятивная частота событий первичной конечной точки составила 19,0% (211 событий) в группе ЧКВ и 18,5% (202 события) в группе только медикаментозной терапии. Кроме того, больные включенные в исследование относились к категории высокого риска: 34% пациентов с диабетом, 71% – с дислипидемией, 29% курильщиков, 39% в прошлом уже перенесли ИМ, средняя длительность стенокардии – 26 мес., в среднем шесть приступов стенокардии в неделю, средний диаметр стеноза коронарной артерии – 82±5%, смертность/частота инфаркта – 4,3% за год.
В исследование BARI 2D было включено 2368 пациентов со стабильной ИБС, страдающих сахарным диабетом второго типа. Пациенты были рандомизированы к только медикаментозной терапии, или помимо таковой им проводилась реваскуляризация миокарда в виде ЧКВ или коронарного шунтирования на усмотрение лечащего врача. Через 5 лет выживаемость между группами достоверно не различалась: 88,3% в группе реваскуляризации и 87,8% в группе медикаментозного лечения (p=0,97). Доля пациентов без неблагоприятных сердечно–сосудистых событий (смерть, инфаркт, инсульт) также достоверно не различалась (77,2% в группе реваскуляризации против 75,9% в группе медикаментозной терапии, p=0,70). При отдельном анализе групп ЧКВ и медикаментозной терапии также достоверной разницы выявлено не было. Таким образом, в группе больных сахарным диабетом второго типа проведение ЧКВ также не приводит к улучшению отдаленного прогноза по сравнению с только медикаментозной терапией.
В относительно небольшом рандомизированном исследовании JSAP (Japanese Stable Angina Pectoris), проведенном в Японии, 384 пациента со стабильной ИБС низкого риска, направляемые лечащими врачами на инвазивное лечение, были рандомизированы к проведению конскрвативной терапии, или наряду с ней им выполнялось ЧКВ. Через 3,3 года наблюдения частота смерти достоверно не различалась между группами (2,9% в группе инвазивного лечения против 3,9% в группе консервативного лечения), однако частота комбинированной конечной точки (смерть + ОКС) достоверно реже встречалась в группе инвазивного лечения (7,9 и 14,9%, p=0,018). Недостатком данного исследования является небольшое число включенных пациентов, а также использование внутрисосудистого ультразвукового исследования при всех ЧКВ. Этим объясняется увеличение частоты первоначального успеха ЧКВ в исследовании JSAP (99,5%) по сравнению с COURAGE (93%), что, возможно, и является причиной различий в полученных результатах.
В 2012 г. был выполнен еще ряд метаанализов, по результатам которых частота сердечно-сосудистых событий при применении ЧКВ не снижается по сравнению с консервативной тактикой, однако действительно на 20% снижает долю пациентов без стенокардии, в том числе и в отдаленном периоде. Также была выявлена интересная временная закономерность: по мере включения более современных исследований, где чаще применялись стенты и более агрессивная медикаментозная терапия, влияние ЧКВ на улучшение прогноза уменьшалось.
Основные положения об инвазивных методах лечения стабильной ИБС изложены в клиническом руководстве по чрескожным коронарным вмешательствам ACCF/AHA/SCAI (2015):
• ЧКВ уменьшает симптомы и частоту приступов стенокардии;
• ЧКВ не повышает выживаемость больных стабильной стенокардией;
• ЧКВ может повышать краткосрочный риск ИМ;
• ЧКВ не снижает долгосрочный риск ИМ.
Однако за последние 30 лет наблюдается рост выполнения ЧКВ при хронических формах ИБС (с 2001 по 2011 г. отмечено 16–кратное увеличение числа выполняемых ЧКВ на 1 млн населения). Кардиологи обосновывают это так:
• ЧКВ позволяет добиваться лучших результатов лечения ишемии согласно гипотезе «открытой артерии»;
• предпочтение действия бездействию
• ЧКВ проводится, чтобы в дальнейшем не сожалеть об упущенной возможности предупредить развитие ИМ;
В то же время наблюдается рост приверженности пациентов к лечению препаратами, положительное влияние большинства из которых при стабильной ИБС не вызывает сомнений.
Таким образом, в настоящее время нет убедительных данных, что проведение ЧКВ у больных со стабильной ИБС, получающих медикаментозную терапию, приводит к снижению общей, сердечно–сосудистой смертности, нефатального ИМ или потребности в экстренной реваскуляризации. В то же время совершенно очевидно, что проведение ЧКВ приводит к значительному снижению выраженности стенокардии по сравнению с медикаментозной терапией.
Следует отметить, что дискуссия о прогностическом влиянии ЧКВ продолжается. Критики исследования COURAGE обращают внимание на незначительную частоту использования стентов с лекарственным покрытием нового поколения, которые, как было показано в ряде исследований, не только снижают частоту рестеноза стента, но и снижают частоту инфаркта миокарда по сравнению с непокрытыми стентами и стентами первого поколения, а также недостатки дизайна (в частности рандомизация после коронарографии и нечеткие критерии ишемии). Все это позволяет заключить, что данное исследование не дает окончательный ответ на вопрос о влиянии ЧКВ на прогноз больных со стабильной ИБС. Кроме того, как уже отмечалось ранее, за последнее время произошел качественный скачок как в медикаментозном лечении, так и технике и фармакологии инвазивного лечения.
На сегодняшний день идет крупнейшее международное исследование International Study of Comparative Health Effectiveness with Medical and Invasive Approaches (ISCHEMIA), в котором проверяется гипотеза о долгосрочных преимуществах стратегии первичной реваскуляризации у больных стабильной стенокардией с подтвержденной среднетяжелой или тяжелой ишемией миокарда. Планируется включить в исследование как минимум 8000 пациентов, что позволит определить даже небольшую разницу в исходах. При этом в работе используется весь арсенал современной медикаментозной и инвазивной терапии (в частности стенты с лекарственным покрытием). Исследование завершится к 2019 году и, возможно, даст окончательные ответы по вопросу применения ЧКВ у больных со стабильной ИБС.
Что такое плановое чкв
Долгосрочные исходы эндоскопической резекции у пациентов с ранней стадией аденокарциномы пищевода
Факторы, определяющие выживаемость у пациентов с протоковой аденокарциномой поджелудочной железы
Как повысить частоту обнаружения аденом правых отделов толстой кишки?
Сравнение различных методов дренирования желчного пузыря при остром холецистите
Частота неполной резекции колоректальных полипов. Результаты систематического обзора и мета-анализа
Миокардит
Миокардиты неревматической этиологии классифицируют на несколько групп:
По варианту клинического течения выделяют: молниеносный или быстротечный (до 1 мес), острый (до 3-х мес), подострый (3-6 мес.), хронический (активный или персистирующий); по степени тяжести – легкий, средней тяжести и тяжелый; по распространенности – очаговые и диффузные миокардиты.
Клинические варианты течения: псевдокоронарный (болевой), декомпенсационный, псевдоклапанный, аритмический, тромбоэмболический, смешанный, малосимптомный (30%).
Частота встречаемости различных клинических проявлений варьирует: кардиалгии – 80%, одышка – 50%, перебои в работе сердца – 40%, увеличение размеров сердца (может быть незначительным), приглушенность I тона – 8—90%, расщепление, раздвоение I тона – 10%, акцент II тона над легочной артерией – 30%, систолический шум на верхушке – 50%, тахикардия – 50%, брадикардия – 10%, застойная сердечная недостаточность – 30%, возможна гипотония.
Диагностика миокардитов основана на клинико-анамнестических данных. Диагностическое правило постановки диагноза миокардита: сочетание предшествующей инфекции с двумя большими или одним большим и двумя малыми критериями. Наличие предшествующей инфекции должно быть доказано клиническими и лабораторными данными. К большим признакам поражения миокарда относятся: признаки застойной недостаточности кровообращения, кардиогенный шок, патологические изменения на ЭКГ, повышение в крови концентрации кардиоселективных ферментов, увеличение размеров сердца по данным ЭХО-КГ или рентгенографии. Малые признаки поражения миокарда включают тахикрадию (иногда брадикардию), ослабление первого тона, протодиастолический шум галопа, умеренный систолический шум на верхушке сердца.
Кроме того, существуют методы объективного подтверждения миокардита:
При лечении данной патологии по возможности проводится терапия основного заболевания, устранение этиологических факторов. Спецефического лечения собственно миокардита в настоящее время не существует. Лечение симтоматическое: терапия сердечной недостаточности, нарушений ритма и проводимости. При легком течении миокардита медикаментозная терапия не нужна. При миокардитах средней тяжести и тяжелого течения необходим постельный режим (по крайней мере первые 2-3 недели) и симптоматическая медикаментозная терапия. Эффективноть НПВС при миокардитах не доказана. Их назначение возможно при сопутсвующем перикардите. Убедительных доказательств эффективности производных аминохинолона также пока нет. В настоящее время изучаются возможности применения иммуномодуляторов, спецефических противовирусных препаратов, моноклональных антител против антигенов Т-лимфоцитов, антитимоцитарного глобулина. И только при крайне тяжелом течении оправдана попытка применения преднизолона с азатиоприном.