Что такое плотность паренхимы мозга
Что такое плотность паренхимы мозга
Паренхиматозные поражения встречаются примерно в 10% всех травм головы и при трети всех серьезных травм. Большинство из этих поражений имеет (и сохраняет) небольшой масс-эффект и может лечиться консервативно. Тем не менее, некоторые из них развивают эффект массы, создавая риск ухудшения, вклинения и, соответственно, смерти мозга.
В отличие от эпидуральной и острой субдуральной гематомы, которые обычно присутствуют в течение первых 8 часов после травмы, паренхиматозные поражения, как правило, развиваются иногда даже в течение нескольких дней, затрудняя принятие решения об операции. Таким образом, при обследовании необходимо сосредоточиться на выявлении пациентов, которые имеют риск развития такого повреждения, на показаниях к операции и на сроках проведения.
а) Определение. Черепно-мозговые повреждения можно разделить на диффузные и очаговые. В большинстве случаев встречается их комбинация. Различие между ушибом, травматической внутримозговой гематомой и инфарктом является несколько искусственным. С практической точки зрения такое поражение лучше классифицировать в соответствии с их проявлением на КТ как гиперденсное, гиподенсное или смешанное.
Большинство из этих поражений визуализируются на первичной КТ. Поскольку примерно 30% из них увеличиваются в течение нескольких часов или дней после первоначальной травмы, нельзя недооценивать необходимость повторных КТ и непрерывный мониторинг таких больных. Особым случаем является отсроченное внутричерепное кровоизлияние, развивающееся примерно в 2% случаев в области сначала «нормальной» ткани мозга.
Особое внимание должно быть уделено малым ушибам, которые сопровождаются внеосевыми гематомами, так как значительное количество этих поражений будет «расти» после эвакуации гематом. Поэтому желательно выполнять КТ в течение 4-8 часов после оперативного вмешательства.
б) Показания к операции при повреждении паренхимы мозга. Исход при паренхиматозных повреждениях определяет ряд прогностических факторов: локализация, размер, масс-эффект, сроки операции, ШКГ до операции и многое другое. Такие прогностические факторы помогают выявить пациентов с риском развития транстенториального вклинения и служат руководством для принятия решения об оперативном вмешательстве. Кроме того, при принятии решения полезны постоянный мониторинг ВЧД и повторные КТ.
Показаниями к хирургическому лечению являются:
— Постепенное ухудшение неврологических симптомов.
— Повышенное ВЧД, устойчивое к консервативному лечению.
— Признаки масс-эффекта при повторном выполнении КТ.
в) Хирургическая техника. Несмотря на попытки эвакуировать такие поражения стереотаксической аспирацией, лучшим лечением по-прежнему остается трепанация черепа и удаление.
Декомпрессионная краниоэктомия. В соответствии с рекомендациями EBIC и ABIC по тяжелой травме головы, декомпрессионная краниоэктомия является терапевтической опцией при отеке головного мозга на фоне диффузного поражения, не реагирующего на обычные терапевтические мероприятия. Данная методика пережила возрождение в течение последнего десятилетия. В то время как исследования I класса на эту тему по-прежнему отсутствуют, в неконтролируемых проспективных исследованиях получены достоверные подтверждения, что такая операция улучшает результат в целом, а также оказывает благотворное влияние на различные физиологические параметры, которые, как известно, являются независимыми прогностическими факторами плохого исхода.
Дополнительный объем, достигнутый этой процедурой, сдвигает кривую ВЧД давление-объем вправо.
1. Показания. «Терапевтическая» декомпрессивная краниоэктомия должна быть выполнена, как вторая линия терапии у пациентов с повышенным ВЧД, не поддающимся обычной лекарственной терапии. Есть соображения, что пороги ВЧД у этих пациентов могут варьировать в зависимости от их клинического состояния. Улучшает ли «профилактическая» декомпрессия исход сомнительно, но есть некоторые свидетельства того, что такая декомпрессия тоже может привести к хорошим клиническим результатам.
Такая процедура может быть единственным доступным методом предотвращения развития вклинения в условиях отсутствия палаты интенсивной терапии и средств мониторинга. Лучшие клинические результаты достигаются у молодых пациентов, но в литературе отсутствуют данные об определенном возрастном пределе. Первичные и вторичные признаки повреждения ствола мозга (фиксированные и расширенные зрачки; ШКЕ 3 балла)—явные противопоказания для этой процедуры.
2. Хирургическая техника. Для хирургической декомпрессии применяются различные методы (бифронтальная, височная/подвисочная, гемикраниоэктомия, с удалением или без удаления тканей головного мозга, с дуропластикой или без нее). Мы выполняем стандартизированную гемикраниоэктомию с подвисочной декомпрессией в сочетании с дуропластикой без удаления тканей головного мозга. Если отек является односторонним, процедура ограничивается пораженной стороной. При генерализованном отеке декомпрессия выполняется с двух сторон.
3. Результаты. С учетом вышеописанных показаний и противопоказаний, примерно 70% пациентов, перенесших эту процедуру выживет, а две трети выживших будет иметь благоприятный исход (ШКГ 4 или 5).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Микрососудистое УЗИ паренхимы головного мозга новорожденных: возможности, применение и нормальная визуализация с помощью SMI – Superb microvascular imaging
Авторы: Katharina Goeral, Azadeh Hojreh, Gregor Kasprian, Katrin Klebermass-Schrehof, Michael Weber, Christian Mitter, Angelika Berger, Daniela Prayer, Peter C. Brugger, Klara Vergesslich-Rothschild, and Janina M.
Оценить выполнимость SMI головного мозга новорожденного и описать нормальные особенности визуализации.
Мы провели транскраниальное ультразвуковое исследование с SMI у 19 здоровых новорожденных. SMI проводилась в соответствии со структурированным протоколом обследования с использованием двух линейных датчиков 18 МГц и 14 МГц. Поверхностные и глубокие снимки были получены в корональной и сагиттальной плоскостях, используя левую и правую верхнюю лобную извилину в качестве анатомических ориентиров.
Введение
Внутрипаренхиматозная сосудистая сеть мозга состоит из иерархической сети мелких артерий, вен и капилляров. Главные артериальные стволы снабжают головной мозг, разветвляясь на перфорантные артерии проксимально и пиальные кортикальные артерии – периферически. Пиальные артерии расходятся на внутрикортикальные, подкорковые и медуллярные артерии, которые снабжают кору, в то время как белое вещество головного мозга снабжается исключительно медуллярными артериями.
Помимо инвазивных процедур, визуализация сосудов головного мозга новорожденных возможна in vivo с использованием КТ и МРТ. КТ ограничивается использованием радиации и необходимостью для внутривенного введения контрастного вещества и МРТ из-за сложной логистики и применения седативных препаратов при визуализации новорожденных. При диаметрах 100–200 мкм внутрипаренхимальные сосуды головного мозга обычно остаются ниже пространственного разрешения методов клинической визуализации, включая КТ и МРТ (напряженность поля до 3 Тесла).
У новорожденных с открытыми родничками транскраниальное УЗИ (ТУЗИ) используется в качестве метода визуализации первой линии благодаря широкой доступности с возможностью использования у кровати, низкой стоимостью, безопасным для пациента профилем безопасности и высоким разрешением изображения.
Недавно УЗИ сосудистой системы получило новый поворот благодаря созданию инновационного метода, который называется SMI. SMI развился как новый инструмент для неинвазивной визуализации микроциркуляторного русла без использования внутривенного контрастного материала. Этот метод использует расширенное подавление помех и обрабатывает доплеровские сигналы с низким расходом, которые в противном случае фильтруются и удаляются как «шумы». Преимуществами являются высокое разрешение и частота кадров, а также визуализация низкоскоростного потока. Доступны два режима: монохромный SMI (mSMI) и цветной SMI (cSMI). cSMI отображает компоненты с низким расходом в цвете, наложенном на серое изображение с высоким временным и пространственным разрешением одновременно. mSMI показывает микроциркуляторное русло с еще более высокой чувствительностью, вычитая анатомический фон.
Ишикава и соавторы использовали SMI для визуализации опухолевых сосудов и краев опухоли во время операции на открытом мозге у взрослых. Что касается применения в педиатрии, SMI оказался полезным в оценке пузырно-уретрального рефлюкса, а также в неопущенных яичках.
В настоящее время мало известно о морфологии микрососудистой структуры человеческого мозга in vivo после рождения. Наше исследование направлено на визуализацию микрососудов головного мозга новорожденных с помощью ультразвукового исследования SMI. Во-первых, выполнимость и воспроизводимость SMI оценивается в когорте новорожденных. Во-вторых, описаны нормальные особенности SMI в здоровом мозге новорожденных.
Методы
Мы провели проспективное одноцентровое исследование изображений новорожденных, родившихся в срок: для основного исследования в отделение годичной педиатрии и подростковой медицины Медицинского университета Вены, Австрия, было включено 19 новорожденных в течение 1 года. Критерии включения были определены следующим образом: доношенные новорожденные с хорошей постнатальной адаптацией без неврологических нарушений или подозрений на церебральные патологии. История болезни во время беременности должна была быть ничем не примечательной, пренатальное УЗИ центральной нервной системы должно было быть нормальным. Поэтому новорожденные с хромосомными аномалиями, постнатальным неврологическим дефицитом или любым поражением головного мозга, диагностированным пренатальным или постнатальным УЗИ, были исключены из участия в исследовании. Информированное согласие было получено у всех пациентов. Исследование было одобрено Комитетом по этике Медицинского университета Вены.
Все участники прошли стандартное транскраниальное ультразвуковое исследование с использованием сканера Toshiba Aplio 400 в течение первых недель жизни в бодрствующем состоянии. Микроконвексный датчик (11 МГц) был помещен на открытый передний родничок для получения коронального и сагиттального стандартных изображений. Кроме того, было получено допплеровское изображение и резистивные показатели из внутренней сонной артерии и передней мозговой артерии.
ПРАВИЛЬНО ЛИ ВЫ УХАЖИВАЕТЕ ЗА УЗ-АППАРАТОМ?
Скачайте руководство по уходу прямо сейчас
SMI – получение и интерпретация изображений
SMI было выполнено и задокументировано с использованием предварительно определенного протокола обследования двумя сертифицированными специалистами педиатрическими рентгенологами, с более чем 5-летним опытом в ультразвуковом исследовании новорожденных и анатомическими знаниями ангиоархитектуры паренхимы головного мозга. Протокол обследования включал поверхностное и глубокое сканирование. Поверхностные сканы были получены с использованием линейного 18 МГц датчика и захватили корональные и сагиттальные плоскости левой и правой верхней лобной извилины( F1) (рис. 1 и 2). F1 был выбран из-за близости к передней части родничка и, таким образом, оптимальной сонографической доступности. Максимальная глубина увеличения при поверхностном сканировании составляла 2,5 см. Глубина поверхностного сканирования составила 1,7 см. Настройки SMI составляли 7,2 МГц (доплеровская частота), 21 кГц (импульсно-волновая частота) и усиление цвета 45–50. Глубокие сканы были получены только в корональной плоскости с использованием линейного датчика 14 МГц (рис. 3). SMI глубина глубокого сканирования составляла 5–6 см. Настройки SMI составляли 7 МГц (доплеровская частота), 9 кГц (импульсно-волновая частота) и усиление цвета 45–50. Для типичного ультразвукового исследования параметры безопасности были следующими: механический индекс 0,8–1,5, тепловой индекс кости 0,6–0,8 и тепловой индекс мягких тканей 0,6–0,8.

Рисунок 1: Поверхностное сканирование: корональный вид правой верхней лобной извилины в режиме B (a), монохромный SMI (b) и схематическое изображение (c). b и c демонстрируют кортикальные (короткая стрелка) и медуллярные (стрелка) сосуды
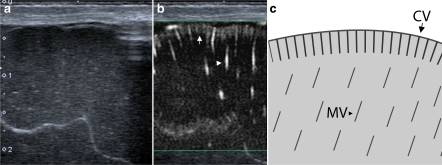
Рисунок 2: Поверхностное сканирование: сагиттальный вид правой верхней лобной извилины в режиме B (a), монохромный SMI (b) и схематическое изображение (c). b и c демонстрируют кортикальные (короткая стрелка) и медуллярные (стрелка) сосуды

Рисунок 3: Глубокое сканирование: корональное изображение в B-режиме (a), монохромный SMI (b) и схематическое изображение (c). b и c демонстрируют экстрастриатарные (корковые [короткая стрелка], медуллярные [стрелка]) и стриатарные (тонкая стрелка) сосуды.
Все предварительно определенные виды были отображены с помощью монохромного и цветного SMI с использованием настроек, предоставленных производителем. Видеопоследовательности в оттенках серого были получены и задокументированы дважды подряд, в то время как цветовые последовательности были запечатлены и задокументированы один раз для каждой анатомической области. Минимальная продолжительность каждой видеопоследовательности составляла 5 с. Видеопоследовательности SMI были сохранены и просмотрены с использованием AGFA PACS. На основании наблюдений радиологических признаков, сделанных во время получения изображений, была разработана и использована структурированная полуколичественная схема считывания: по этой схеме сосуды классифицировались как видимые или невидимые. В частности, мы различали две основные сосудистые территории: экстрастриарные сосуды (снабжающие кору и белое вещество) и стриарные сосуды (снабжающие хвостатое и лентиформное ядро). Эти сосуды были оценены как видимые, если они выглядели как яркие эхогенные криволинейные структуры на видеопоследовательностях mSMI или как красные криволинейные структуры на последовательностях cSMI.
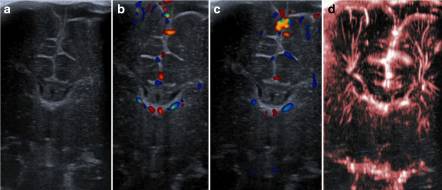
Рисунок 4: Сравнение УЗИ и SMI: глубокий корональный обзор в режиме B (a), цветное ультразвуковое допплеровское исследование (b, c) и сSMI (d)
Корковые микрососуды выглядят как короткие гиперэхогенные, параллельные полосы, перпендикулярные поверхности мозга на корональных и сагиттальных изображениях. Медуллярные микрососуды проявляются как криволинейные гиперэхогенности в белом веществе, демонстрирующие характерную «фонтаноподобную» морфологию на корональных изображениях. На сагиттальных сканах они показывали прямое направление. Глубокий коронарный SMI показал полосатые микрососуды, выглядящие как криволинейные гиперэхогенные полосы в форме цветка лотоса, проходящие через таламус и базальные ганглии (рис. 5).
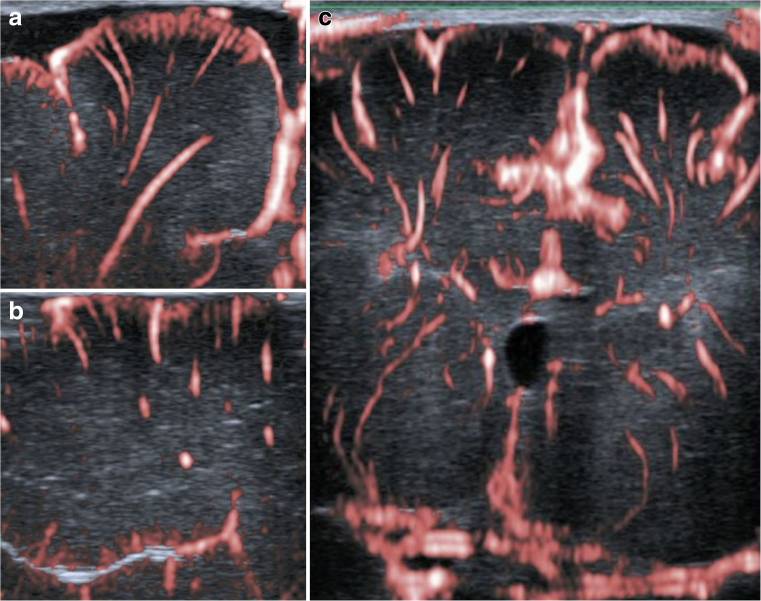
Рисунок 5: сSMI: корональные (а), сагиттальные (б) и глубокие корональные (с) изображения, демонстрирующие экстрастриатарные и стриатарные сосуды, наложенные на B-режим
С клинической точки зрения следует подчеркнуть, что существует большой потенциал для использования SMI для исследования головного мозга новорожденных: гипоксическая ишемическая энцефалопатия, церебральные пороки развития, инфекции и преждевременные роды являются состояниями, связанными с микрососудистыми нарушениями. После ишемии SMI может позволить выявить и контролировать постгипоксическую гиперперфузию (рис. 6). У недоношенных новорожденных с внутрижелудочковым кровоизлиянием SMI может позволить раннее выявление венозного скопления и перивентрикулярного инфаркта после внутрижелудочкового кровоизлияния.
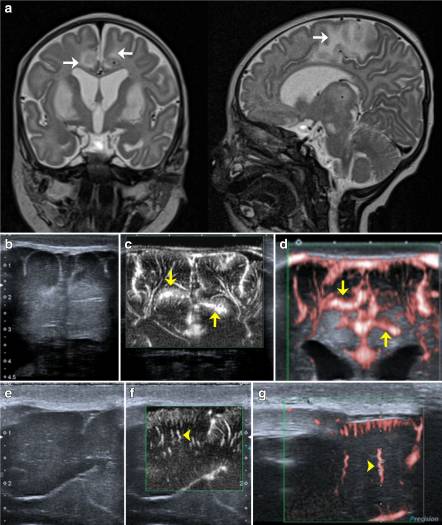
Рисунок 6: Патологический пример: пациент 3-месячного возраста с митохондриальной болезнью (болезнь Ли). В то время как МРТ показала метаболические инфаркты и сигнальные изменения базальных ганглиев и коры (a; белая стрелка), в коронарной mSMI наблюдалась постгипоксическая кортикальная гиперперфузия (c и d; желтая стрелка). Кроме того, SMI показал удлиненные и извилистые медуллярные микрососуды (f и g; желтая стрелка), которые были подтверждены гистологией (не показано)
Расшифровка МРТ головного мозга
Результаты МРТ головного мозга – это серия снимков в нескольких плоскостях, представляющих собой послойные виртуальные срезы толщиной в пару миллиметров, сделанные через исследуемую область. Полная и точная интерпретация снимков магнитно-резонансной томографии – работа врача-рентгенолога, имеющего специализацию в соответствующей области. Задача данного материала – знакомство с основными принципами расшифровки результатов МРТ головного мозга, но не обучение данному процессу.
Как выглядит снимок МРТ головного мозга
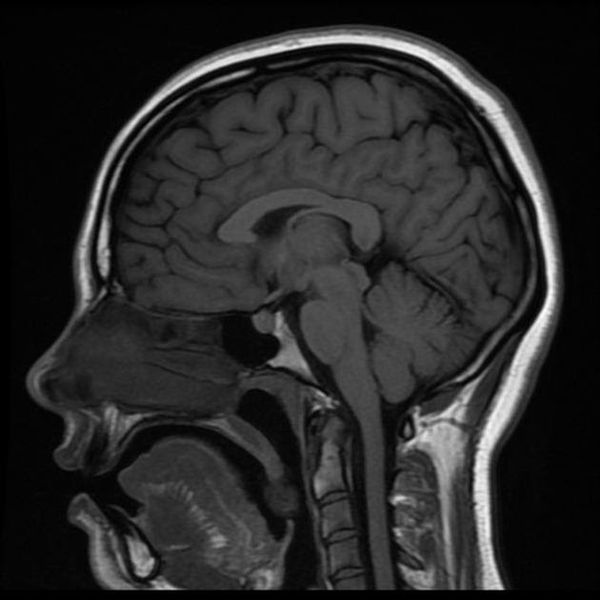
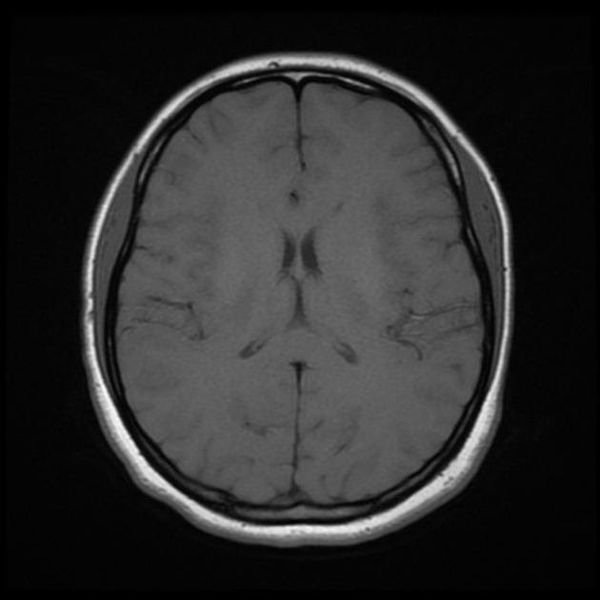
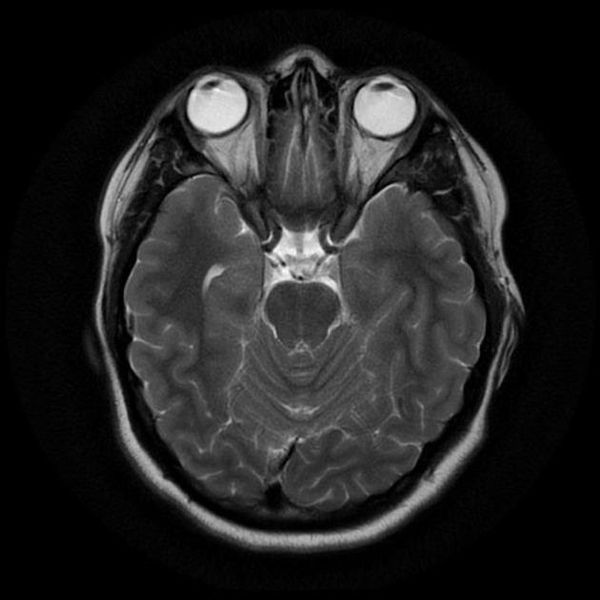
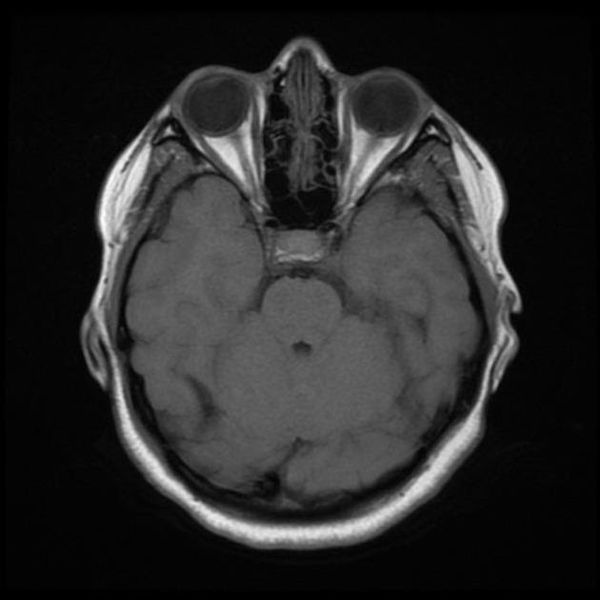
Классический пример МРТ снимков головного мозга показан на рисунках ниже. Магнитно-резонансная томография выполняется в поперечной (или аксиальной – рисунок снизу) и продольной (или сагиттальной — рисунок сверху) плоскостях.
Исследование выполняется в нескольких режимах. Основные из них Т1 и Т2. Изображения, полученные в данных режимах, часто также называют Т1-взвешенными или Т2-взвешенными снимками. Изображения, показанные выше, сделаны в Т1-режиме.
Главное отличие этих режимов – в том, как на снимках отображается жидкость и воздух. В Т1 режиме ткани, содержащие большое количество воды, имеют более темную окраску, в то время как в Т2 режиме они яркие, светлые. Это легко понять, посмотрев на снимки выше – глазные яблоки визуализируются в виде светлых парных округлых образований с одной стороны яркие и светлые, с другой – темные. Следовательно, снимок справа сделан в Т1 режиме, снимок слева – в Т2. Также существует разница в том, как в этих режимах отображается серое вещество головного мозга. В Т2 режиме оно светлее, чем белое вещество.
На самом деле режимов намного больше – FLAIR, DWI, STIR и так далее. Какой-то режим используется для подавления сигнала от богатых жиром тканей, какой-то – для изучения плотности распределения протонов в тканях, третий – для оценки броуновского движения молекул воды. Вот почему полный курс МРТ-диагностики для врачей длится не один месяц.
Норма и отклонения на МРТ головного мозга
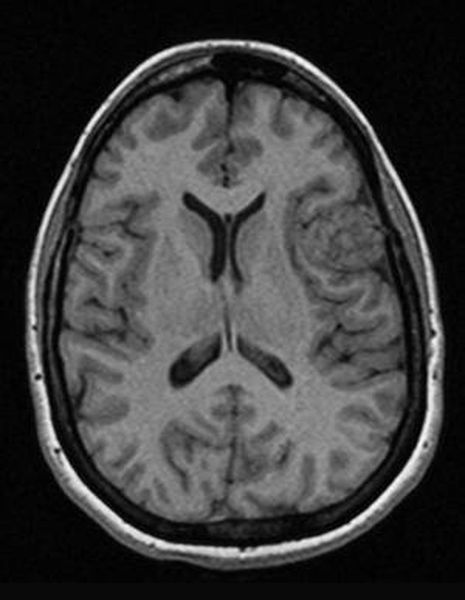
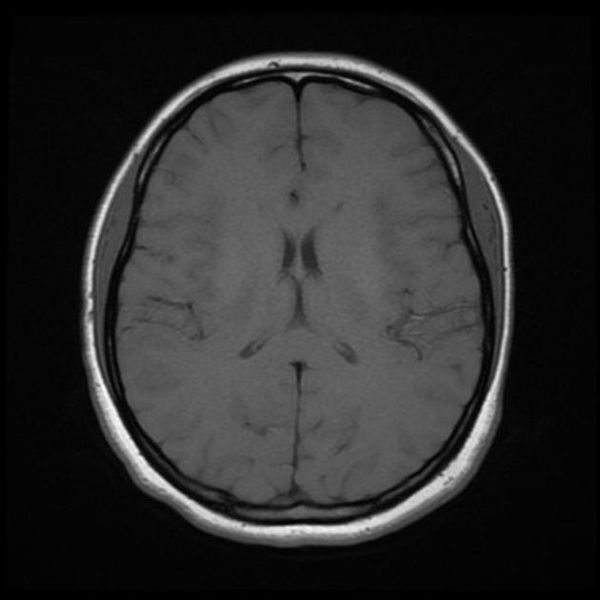
Как же узнать, есть ли на снимках признаки болезни? Самое главное – запомнить, как выглядит головной мозг здорового человека. Врач, изучая снимки пациентов, постоянно сравнивает их с нормальными снимками, хранящимися у него в голове. Чтобы понять, как это происходит – посмотрите на снимки внизу:
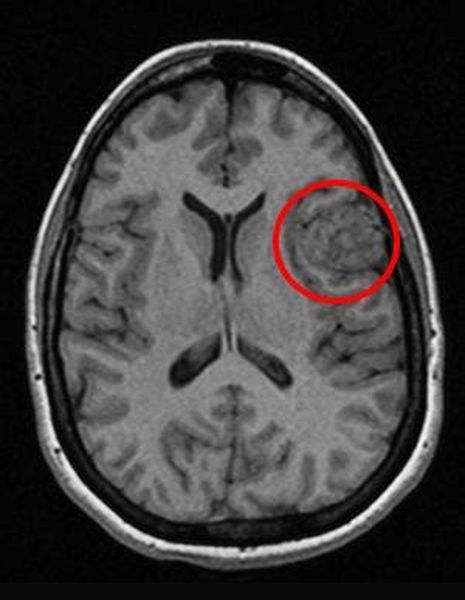
Перед вами – два снимка, сделанных в одном режиме. Снимок снизу – норма. Какое заболевание, в таком случае, есть на верхнем снимке? Чтобы понять это, нужно сравнить эти изображения. Явно видно отличие – на верхнем снимке в правой части головного мозга есть новообразование. Разница еще заметнее, если сравнить левую и правую части того же снимка.
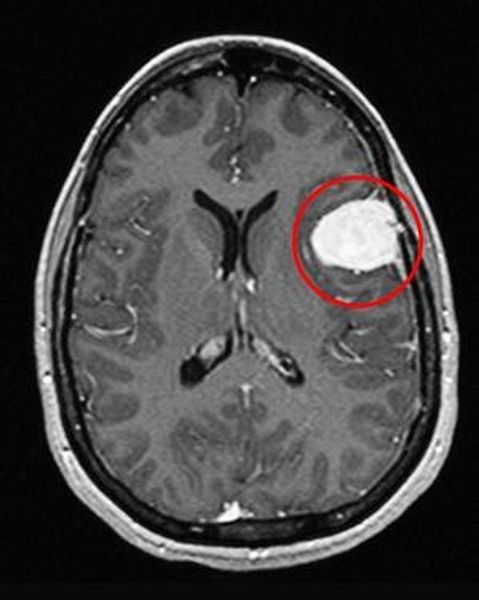
Отметим его красной окружностью. Визуально оно представляет собой узел, неоднородный по окраске и отличающийся от серого и белого вещества головного мозга. В таких случаях, чтобы точно определить границы опухоли и определить её тип исследование повторяют с контрастом. Введение контрастного препарата в кровь через локтевую вену приводит к накоплению контрастного вещества в тканях опухоли – нормальные здоровые ткани его практически не накапливают. И мы получаем следующую картину, показанную на рисунке справа. Яркая окраска опухоли соответствует накопленному контрасту – теперь можно не только сказать, где опухоль, но и примерно определить, что это доброкачественная опухоль, так как она имеет четкие границы (злокачественные опухоли прорастают окружающие ткани, из-за чего границы будут размытыми и не такими четкими).
Таким образом расшифровка результатов МРТ головного мозга проводится путем сравнения полученных снимков с нормой. При отсутствии отличий можно говорить о том, что пациент, чьи снимки исследует врач, скорее всего здоров. Сравнивается все – форма, размеры анатомических структур, локализация, симметричность, количество спинномозговой жидкости в полостях головного мозга, и множество других параметров. Каждое заболевание, будь то инсульт или рассеянный склероз, имеет свои характерные признаки.
Как читать результаты МРТ головного мозга
Теперь попробуем прочитать заключение МРТ головного мозга с расшифровкой снимков на следующем примере:
В заключение выносят только патологические изменения – в данном случае это очаги ишемии, атрофия лобно-височных областей, киста гайморовой пазухи. В целом картина соответствует возрасту пациента – 65 лет. МРТ-признаки сосудистой энцефалопатии – окончательный диагноз будет определен лечащим врачом. Обратите внимание – в норме на снимках отсутствуют изменения, очаговые или диффузные (распространенные равномерно), кисты, опухоли, новообразования, участки патологической гипер или гипоинтенсивности сигнала. Анатомические образования имеют четкие ровные контуры, не смещены, симметричны. Сосуды симметричны, без признаков сужения просвета, с нормальным ходом и калибром, интралюминарный сигнал (фактически кровь в сосуде) гомогенный, что говорит об отсутствии тромбов в просвете артерии или вены.
Подобным путем проводится расшифровка и описание снимков в любой клинике. Однако точность сделанного заключения зависит от квалификации врача МРТ-диагностики.
Ультразвуковое исследование мозга новорожденных детей (нормальная анатомия)
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Показания для проведения эхографии мозга
Акустическим окном для исследования мозга может служить любое естественное отверстие в черепе, но в большинстве случаев используют большой родничок, поскольку он наиболее крупный и закрывается последним. Маленький размер родничка значительно ограничивает поле зрения, особенно при оценке периферических отделов мозга.
Для проведения эхоэнцефалографического исследования датчик располагают над передним родничком, ориентируя его так, чтобы получить ряд корональных (фронтальных) срезов, после чего переворачивают на 90° для выполнения сагиттального и парасагиттального сканирования. К дополнительным подходам относят сканирование через височную кость над ушной раковиной (аксиальный срез), а также сканирование через открытые швы, задний родничок и область атланто-затылочного сочленения.
По своей эхогенности структуры мозга и черепа могут быть разделены на три категории:
Нормальные варианты мозговых структур
Борозды и извилины. Борозды выглядят как эхогенные линейные структуры, разделяющие извилины. Активная дифференцировка извилин начинается с 28-й недели гестации; их анатомическое появление предшествует эхографической визуализации на 2-6 нед. Таким образом, по количеству и степени выраженности борозд можно судить о гестационном возрасте ребенка.
Сосудистые сплетения могут быть источником внутрижелудочковых кровоизлияний у доношенных детей, тогда на эхограммах видна их четкая асимметрия и локальные уплотнения, на месте которых затем образуются кисты.
Сильвиев водопровод и IV желудочек. Сильвиев водопровод (aquaeductus cerebri) представляет собой тонкий канал, соединяющий III и IV желудочки (см. рис. 1), редко видимый при УЗ исследовании в стандартных позициях. Его можно визуализировать на аксиальном срезе в виде двух эхогенных точек на фоне гипоэхогенных ножек мозга.
IV желудочек (ventriculus quartus) представляет собой небольшую полость ромбовидной формы. На эхограммах в строго сагиттальном срезе он выглядит малым анэхогенным треугольником посередине эхогенного медиального контура червя мозжечка (см. рис. 1). Передняя его граница отчетливо не видна из-за гипоэхогенности дорсальной части моста. Переднезадний размер IV желудочка в неонатальном периоде не превышает 4 мм.
Мозолистое тело. Мозолистое тело (corpus callosum) на сагиттальном срезе выглядит как тонкая горизонтальная дугообразная гипоэхогенная структура (рис. 2), ограниченная сверху и снизу тонкими эхогенными полосками, являющимися результатом отражения от околомозолистой борозды (сверху) и нижней поверхности мозолистого тела. Сразу под ним располагаются два листка прозрачной перегородки, ограничивающие ее полость. На фронтальном срезе мозолистое тело выглядит тонкой узкой гипоэхогенной полоской, образующей крышу боковых желудочков.
Полость прозрачной перегородки и полость Верге. Эти полости расположены непосредственно под мозолистым телом между листками прозрачной перегородки (septum pellucidum) и ограничены глией, а не эпендимой; они содержат жидкость, но не соединяются ни с желудочковой системой, ни с субарахноидальным пространством. Полость прозрачной перегородки (cavum cepti pellucidi) находится кпереди от свода мозга между передними рогами боковых желудочков, полость Верге расположена под валиком мозолистого тела между телами боковых желудочков. Иногда в норме в листках прозрачной перегородки визуализируются точки и короткие линейные сигналы, происходящие от субэпендимальных срединных вен. На корональном срезе полость прозрачной перегородки выглядит как квадратное, треугольное или трапециевидное анэхогенное пространство с основанием под мозолистым телом. Ширина полости прозрачной перегородки не превышает 10-12 мм и у недоношенных детей шире, чем у доношенных. Полость Верге, как правило, уже полости прозрачной перегородки и у доношенных детей обнаруживается редко. Указанные полости начинают облитерироваться после 6 мес гестации в дорсовентральном направлении, но точных сроков их закрытия нет, и они обе могут обнаруживаться у зрелого ребенка в возрасте 2-3 мес.
Базальная (c. suprasellar) цистерна включает в себя межножковую, c. interpeduncularis (между ножками мозга) и хиазматическую, c. chiasmatis (между перекрестом зрительных нервов и лобными долями) цистерны. Цистерна перекреста выглядит пятиугольной эхоплотной зоной, углы которой соответствуют артериям Виллизиева круга.
Ножки мозга (pedunculus cerebri), мост (pons) и продолговатый мозг (medulla oblongata) расположены продольно кпереди от мозжечка и выглядят гипоэхогенными структурами.
Паренхима. В норме отмечается различие эхогенности между корой мозга и подлежащим белым веществом. Белое вещество чуть более эхогенно, возможно, из-за относительно большего количества сосудов. В норме толщина коры не превышает нескольких миллиметров.
Стандартные эхоэнцефалографические срезы
Рис. 4. Плоскости коронального сканирования (1-6).