Что такое пмжв в кардиологии расшифровка аббревиатуры
Медицинские интернет-конференции
Языки
Значимость степени стеноза ПМЖВ, обусловленного миокардиальным мостом, в клиническом исходе стентирования проксимального атеросклеротического поражения
Резюме
Ключевые слова
Статья
Введение. Мышечный мост (ММ), частично перекрывающий просвет коронарной артерии, является врожденным анатомическим вариантом и чаще встречается в ПМЖВ. ММ обусловливает развитие ИБС посредством двух независимых механизмов, зависящих от его анатомических особенностей (протяженность, толщина, локализация). Одним из механизмов является прямая механическая компрессия ПМЖВ в момент систолы, способствующая отсрочке диастолической релаксации артерии, снижает резерв кровотока и выраженность перфузии. Второй механизм – усиление прогрессии коронарного атеросклероза, обусловливающего стеноз ПМЖВ проксимальнее ММ, вследствие эндотелиального повреждения на фоне аномальной гемодинамики (ретроградный кровоток к устью ПМЖВ в систолу). Анатомические особенности ММ связаны с выбором тактики и исходом вмешательства у пациентов с ИБС. Так, в случаях стентирования по поводу атеросклеротической бляшки, расположенной проксимальнее ММ, возможно позиционирование части стента в области ММ, что увеличивает частоту отдаленных неблагоприятных исходов, обусловленных, в основном, нарушениями в области стентированного участка ММ. Т.о., анатомические особенности ММ необходимо учитывать при диагностике и выборе тактики лечения ИБС у пациентов, имеющих данную анатомическую особенность.
Цель исследования. Определить влияние степени систолической компресии ПМЖВ, обусловленной ММ, на частоту сердечно-сосудистых событий в ближайшем и отдаленном периоде после стентирования атеросклеротического поражения, расположенного проксимальнее ММ.
Материал и методы. В проспективное исследование было включено 17 пациентов с ИБС, которым в период с января 2012 по август 2013 года было выполнено стентирование ПМЖВ. Критериями включения явились: наличие ММ в средней трети ПМЖВ и стеноза, расположенного проксимальнее ММ. При позиционировании стентов использовалось ВСУЗИ с целью профилактики непреднамеренного стентирования части ММ. Ангиографическая эффективность стентирования оценивалась непосредственно после процедуры, а также по истечении 6 месяцев. Учитывали непосредственные результаты: развитие инфаркта миокарда (ИМ) в ближайшем периоде после стентирования, а также наличие и степень остаточного стеноза. В качестве отдаленных клинических результатов оценивались степень стеноза стента в зависимости от исходной степени систолической компрессией артерии, а также наличие осложнений (инфаркт миокарда, потребность в повторной реваскуляризации в данной локализации, летальные исходы). Наличие и степень остаточного стеноза определяли при контрольной ангиографии и ВСУЗИ непосредственно после стентирования и спустя 6 месяцев. В рамках настоящего исследования были использованы стенты только с лекарственным покрытием.
Неблагоприятных исходов в ближайшем периоде (острых нарушений коронарного кровообращения, диссекций артерии и проч.) в обеих группах зафиксировано не было.
На протяжении 6-месячного наблюдения у пациентов как I, так и II группы, не было отмечено острых коронарных событий или потребности в повторной реваскуляризации миокарда.
В отдаленном периоде частота рестенозов стентов не различалась в группах пациентов с разной степенью систолической компрессии артерии: так, в группе 1 рестеноз имел место у 2 пациентов, а в группе 2 – у 1 пациента (р(c 2 )= 0,55).
Выводы. Обязательным условием при стентировании ПМЖВ, имеющей дистально расположенный ММ, является использование ВСУЗИ для контроля позиционирования стента. Не было выявлено влияния степени систолической компрессии ПМЖВ (более или менее 50%), обусловленной миокардиальным мостом, на частоту неблагоприятных событий после выполнения коронарного стентирования в области проксимально расположенной атеросклеротической бляшки. Необходимо дальнейшее изучение соотношения анатомических параметров ММ и частоты рестенозов стентов, имплантированных по поводу проксимального атеросклеротического поражения ПМЖВ.
Коронарные артерии
Перевод на английский названий и аббревиатур артерий сердца
Серженко Надежда
Бюро медицинских переводов «Медтран»
Перевод результатов ангиографии коронарных артерий вызывает немало вопросов даже у опытного медицинского переводчика. Тема является достаточно трудной по ряду причин:
Стандартная для медицинского переводчика ситуация – необходимо перевести выписку из истории болезни пациента, в которой есть описание результатов коронарографии, или среди прочих медицинских документов имеется протокол ангиографии коронарных артерий. Если у переводчика нет опыта подобных переводов, то на два абзаца такого текста может уйти несколько часов.
Много проблем при переводе возникает из-за синонимов (различных вариантов названий одной и той же артерии). Для того, чтобы правильно перевести встретившийся в истории болезни вариант названия артерии (который далеко не всегда имеет однозначный аналог на английском языке), часто приходится искать и сопоставлять описание анатомического строения на русском языке с описанием на английском языке, чтобы убедиться, что выбранный англоязычный термин соответствует русскому названию артерии.
Во избежание искажения смысла при переводе названий анатомических образований и ангиографических терминов на английский язык настоятельно рекомендуем использовать максимально близкие к русскому оригиналу аналоги. Несмотря на то, что одна и та же артерия может иметь несколько названий как на русском, так и на английском языке, употребление синонимов следует свести к минимуму, т.к. это затрудняет проверку и является потенциальным источником ошибок. Перевод медицинского текста должен максимально близко передавать содержание исходного текста, и переводчик не имеет права интерпретировать имеющуюся информацию по собственному усмотрению. Тем не менее, для правильного перевода необходимо разбираться в основах ангиографии и знать анатомию коронарных артерий.
Приведенные ниже термины и пояснения призваны облегчить работу переводчика и помочь избежать ошибок при переводе ангиокоронарограмм.
Синусы аорты
The aortic sinuses
The aortic valve has three leaflets, each having a cusp or cup-like configuration. These are known as the left coronary cusp, the right coronary cusp and the posterior non-coronary cusp. Just above the aortic valves there are anatomic dilations of the ascending aorta, also known as the sinus of Valsalva. The left aortic sinus gives rise to the left coronary artery. The right aortic sinus which lies anteriorly, gives rise to the right coronary artery. The non-coronary sinus is positioned on the right side.
The aortic sinuses that are adjacent to the pulmonary valve (facing the pulmonary valve) are described as the ‘facing’ aortic sinuses.
Правый аортальный синус (1-й лицевой синус, правый синус Вальсальвы).
Right coronary sinus, right anterior sinus, right sinus of Valsalva, right-facing sinus (anat.: anterior aortic sinus).
От правого аортального синуса отходит правая коронарная артерия.
Левый аортальный синус (2-й лицевой синус, левый синус Вальсальвы).
Left coronary sinus, left anterior sinus, left sinus of Valsalva, left-facing sinus (anat.: left posterior aortic sinus).
Левый аортальный синус является местом отхождения левой коронарной артерии.
Некоронарный синус аорты (нелицевой синус аорты, задний синус Вальсальвы).
Non-coronary aortic sinus, posterior sinus of Valsalva, non-facing aortic sinus (anat.: right posterior aortic sinus, sinus aortae posterior dexter).
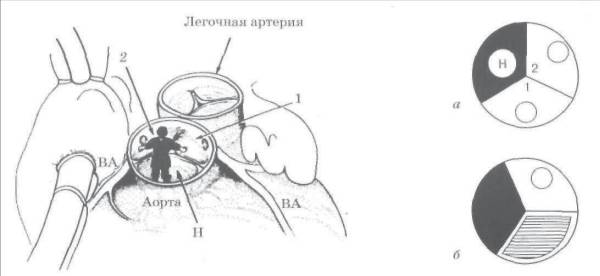
Схема, поясняющая определение терминов.
а : нелицевой синус аорты (Н) затемнен, 1 и 2 — 1-й и 2-й лицевые синусы (светлые), от которых отходят венечные артерии;
б : в случае отхождения венечных артерий от одного лицевого синуса аорты, второй (заштрихован) может оказаться некоронарным. Таким образом, термины «лицевой» и «коронарный», «нелицевой» и «некоронарный» не являются синонимами.
Источник: Бокерия Л. А., Беришвили И. И. Хирургическая анатомия венечных артерий. М.: Издательство НЦССХ им. А. Н. Бакулева РАМН, 2003.
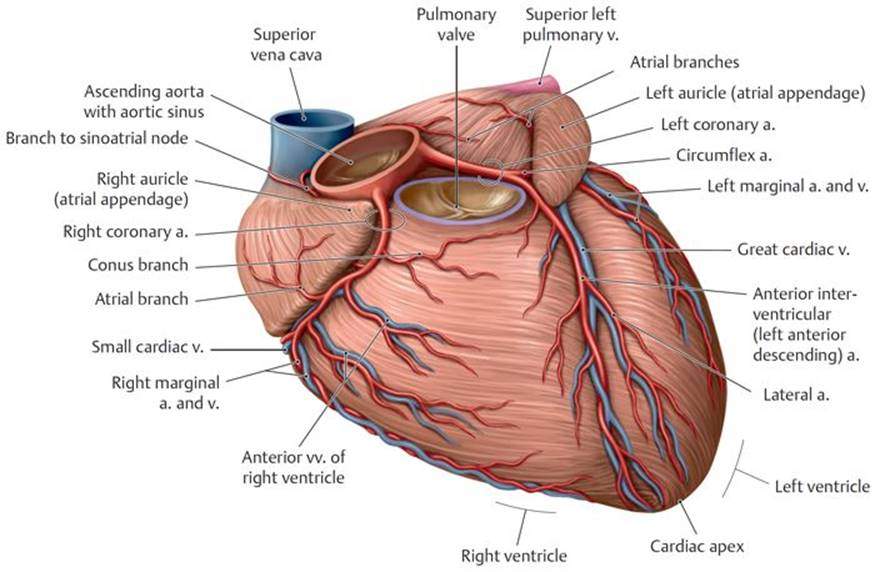
Коронарные артерии (венечные артерии)
Coronary arteries
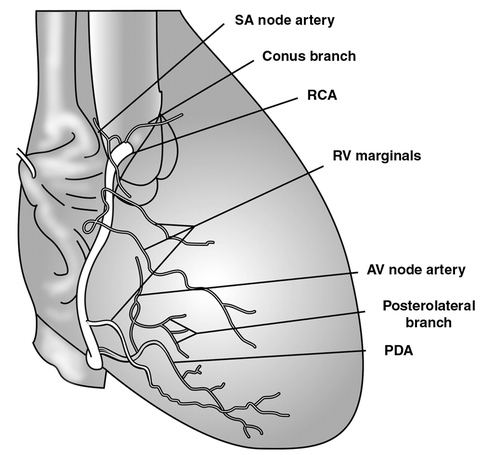
Правая коронарная артерия и ее ветви
Правая коронарная артерия отходит от правого аортального (1-го лицевого) синуса, чаще всего в виде ствола, идущего кзади по правой атриовентрикулярной борозде, огибающей трехстворчатый клапан, и направляющегося к кресту сердца.
The RCA typically arises from the right sinus of Valsalva (RSV) of the ascending aorta, passes anteriorly and to the right between the right auricle and the pulmonary artery and then descends vertically in the right atrioventricular sulcus. When the RCA reaches the acute margin of the heart, it turns to continue posteriorly in the sulcus onto the diaphragmatic surface and base of the heart.
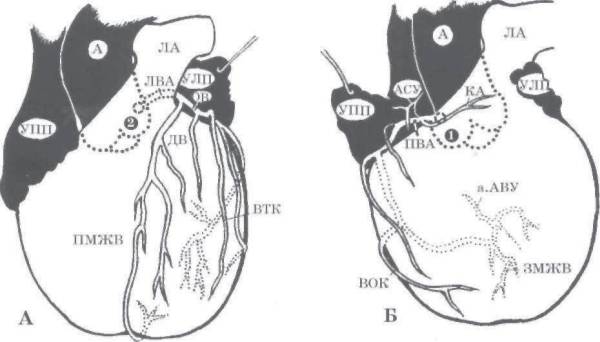
Одноплоскостная анатомическая схема строения венечно-артериального дерева и сердечного комплекса. А — система левой венечной артерии (ЛВА), Б: система правой венечной артерии (ПВА).
1 — первый лицевой синус аорты, 2 — второй лицевой синус аорты. А — аорта, ЛА — легочная артерия, УПП — ушко правого предсердия, УЛП — ушко левого предсердия, ПМЖВ — передняя межжелудочковая ветвь, ОВ — огибающая ветвь, ДВ — диагональная ветвь, ВТК — ветвь тупого края, АСУ — артерия синусного узла, КА — конусная артерия, BOK — ветвь острого края, а.АВУ — артерия атриовентрикулярного узла, ЗМЖВ — задняя межжелудочковая ветвь.
Источник: Бокерия Л. А., Беришвили И. И. Хирургическая анатомия венечных артерий. М.: Издательство НЦССХ им. А. Н. Бакулева РАМН, 2003.
КА – конусная артерия (ветвь артериального конуса).
Conus branch, infundibular branch, conus arteriosus branch.
The artery has a variable distribution, but usually supplies a region of the anterior interventricular septum and the conus of the main pulmonary artery (hence its name). Although an acute occlusion of the tiny artery has been shown to result in S-T elevation, another more important role it serves in pathophysiology is that of a route of collateral circulation. The conus artery has been shown to collateralise with the more distal acute marginal branch in RCA stenosis/obstruction, and collateralise with the left anterior descending artery (LAD) in LAD stenosis/obstruction, providing a potentially vital collateral pathway.
АСУ – артерия синусного узла (ветвь синусового узла, артерия синусно-предсердного узла (а.СПУ), ветвь синусно-предсердного узла).
Sinoatrial nodal artery (SANa), sinus node artery, sinoatrial nodal branch, SA nodal artery, right SA node branch.
Артерия синусного узла, как правило, отходит от доминантной артерии (см. типы кровоснабжения сердца). При правом типе кровоснабжения сердца (примерно в 60% случаев) АСУ является второй ветвью правой коронарной артерии и отходит от ПКА напротив места отхождения конусной артерии, но может отходить и от 1-го лицевого синуса самостоятельно. При левом типе кровоснабжения сердца артерия синусного узла отходит от огибающей ветви ЛКА.
The sinoatrial nodal artery (SANa) supplies blood to the sinoatrial node (SAN), Bachmann’s bundle, crista terminalis, and the left and right atrial free walls. The SANa most frequently originates from either the right coronary artery (RCA) or the left circumflex branch (LCX) of the left coronary artery (LCA).
Артерия Кюгеля (большая ушковая артерия).
Kugel’s artery, atrial anastomotic branch, Kugel’s anastomotic branch (Lat.: arteria auricularis magna, arteria anastomotica auricularis magna, ramus atrialis anastomoticus).
АДВа. – адвентициальная артерия.
Третья ветвь ПКА. Адвентициальная артерия может быть ветвью конусной артерии либо отходить самостоятельно от аорты. Она направляется вверх и вправо и лежит на передней стенке аорты (выше синотубулярного соединения), направляясь влево и исчезая в жировом футляре, окружающем магистральные сосуды.
Артерия острого края является одной из самых крупных ветвей ПКА. Она спускается от ПКА по острому правому краю сердца и образует мощные анастомозы с ПМЖВ. Участвует в питании передней и задней поверхностей острого края сердца.
Артерия (ветвь) предсердно-желудочкового узла отходит от ПКА в области креста сердца.
ЗМЖВ – задняя межжелудочковая ветвь, задняя межжелудочковая артерия, задняя нисходящая артерия.
Posterior descending artery (PDA), posterior interventricular artery (PIA).
Задняя межжелудочковая ветвь может быть непосредственным продолжением ПКА, но чаще является ее ветвью. Проходит в задней межжелудочковой борозде, где отдает задние септальные ветви, которые анастомозируют с септальными ветвями ПМЖВ и питают терминальные отделы проводящей системы сердца. При левом типе кровоснабжения сердца ЗМЖВ получает кровь из левой коронарной артерии, отходя от огибающей ветви или ПМЖВ.
Задние септальные ветви, нижние септальные (перегородочные) ветви.
Posterior septal perforators, posterior septal (perforating) branches.
Задние («нижние») септальные ветви отходят от ЗМЖВ в задней межжелудочковой борозде, которые анастомозируют с «передними» септальными (перегородочными) ветвями ПМЖВ и питают терминальные отделы проводящей системы сердца.
Заднебоковая ветвь левого желудочка (заднебоковая левожелудочковая ветвь).
Right posterolateral artery, posterolateral artery (PLA), posterior left ventricular (PLV) artery.
Приблизительно в 20% случаев ПКА формирует заднебоковую ветвь левого желудочка.
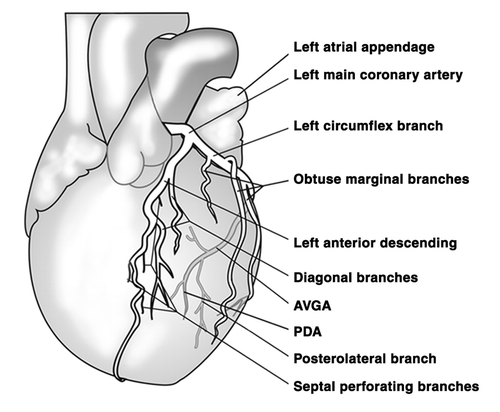
Левая коронарная артерия и ее ветви
The LMCA typically originates from the left sinus of Valsalva (LSV), passes between the right ventricle outflow tract and the left auricle and quickly bifurcates into the LAD and the LCX arteries. Its normal length varies from 2 mm to 4 cm.
ПМЖВ – передняя межжелудочковая ветвь (передняя нисходящая артерия, левая передняя нисходящая артерия, левая передняя межжелудочковая артерия).
Left anterior descending artery (LAD), anterior interventricular artery (AIA), anterior descending coronary artery.
Передняя межжелудочковая ветвь отходит от ствола ЛКА и следует вниз вдоль передней межжелудочковой перегородки. В 80% случаев она доходит до верхушки и, обогнув ее, переходит на заднюю поверхность сердца.
Септальные ветви ПМЖВ (перегородочные ветви ПМЖВ, «передние» перегородочные ветви).
Septal perforators, the septal branches (arteries), the septal perforator branches, perforator branches.
Септальные ветви ПМЖВ сильно варьируют в размерах, числе и распределении. Крупная первая септальная ветвь ПМЖВ (она же передняя септальная ветвь, передняя септальная артерия, 1-я СВ) питает переднюю часть межжелудочковой перегородки и участвует в кровоснабжении проводящей системы сердца. Остальные септальные ветви ПМЖВ («передние»), как правило, имеют меньший размер. Они сообщаются с аналогичными перегородочными ветвями ЗМЖВ («нижние» септальные ветви).
Диагональные ветви отходят от ПМЖВ и следуют вдоль переднелатеральной поверхности левого желудочка. Их несколько, обозначаются номерами сверху вниз: 1-я, 2-я, 3-я диагональные артерии (ветви). Кровоснабжают переднюю часть левого желудочка. Первая диагональная ветвь обычно является одной из тех ветвей, которые питают верхушку.
Срединная артерия (промежуточная ветвь)
Intermediate artery, intermediate branch, ramus intermedius (RI), median (intermedian)branch.
The ramus intermedius (RI) is an artery arising between the left anterior descending artery (LAD) and the CX. Some call it a high diagonal (D) or a high obtuse marginal (OM) artery.
In this normal variant, the LMCA can trifurcate into a LAD, a LCX and a ramus intermedius. The ramus intermedius typically supplies the lateral and inferior walls, acting as a diagonal or obtuse marginal branch, while the arteries that usually supply this territory are small or absent.
Срединная артерия
Источник: Coronary anatomy and anomalies. Robin Smithuis and Tineke Willems. Radiology department of the Rijnland Hospital Leiderdorp and the University Medical Centre Groningen, the Netherlands.
ОВ – огибающая ветвь левой коронарной артерии, огибающая артерия.
Left circumflex coronary artery (LCX), circumflex artery (CX, CA).
Ветвь тупого края является самой крупной ветвью ОВ и может отходить как от начала ОВ, так и на уровне тупого края. Это очень важная ветвь, участвующая в питании свободной стенки (ее передней и задней поверхности) ЛЖ вдоль его латерального края. Очень часто система ОВ вообще представлена крупной ВТК и невыраженной ОВ.
Ветвей тупого края может быть несколько, тогда они обозначаются номерами по мере отхождения слева направо: 1-я, 2-я, 3-я.
Левопредсердная ветвь может отходить от ОВ. Питает боковую и заднюю поверхность левого предсердия.
Заднебоковая ветвь (левожелудочковая ветвь).
Posterolateral branch (PLB).
Заднебоковая ветвь – чаще является терминальной ветвью ОВ, но отхождение этой ветви, равно как и ЗМЖВ и артерии атриовентрикулярного узла от ОВ ЛКА, определяется доминантностью правой или левой коронарной артерии.
Типы кровоснабжения сердца
Type of dominance (Coronary dominance)
The myocardial distribution of the coronary arteries is somewhat variable, but the right coronary artery (RCA) almost always supplies the right ventricle (RV), and the left coronary artery (LCA) supplies the anterior portion of the ventricular septum and anterior wall of the left ventricle (LV). The vessels that supply the remainder of the LV vary depending on the coronary dominance.
Read More: https://www.ajronline.org/doi/10.2214/AJR.06.1295
The posterior descending artery (PDA) runs in the posterior interventricular groove and supplies the inferior wall and inferior third of the interventricular septum. The artery that supplies the PDA and a posterolateral branch determines the coronary dominance, so there can be three situations:
Правый тип кровоснабжения сердца.
Right dominant heart, RCA dominance, right-dominance, right dominant circulation.
Most hearts (approximately 70% of cases) are right dominant where the posterior descending artery (PDA) and the posterolateral branch are supplied by the right coronary artery (RCA). In this instance, the RCA supplies the inferoseptal and inferior segments of the left ventricle.
Левый тип кровоснабжения сердца.
Left dominant heart, LCA dominance, left dominant circulation.
In 10% of cases the PDA is supplied by the LAD or LCx.
Смешанный тип кровоснабжения сердца.
Codominant heart, codominance.
In 20% of cases a single or duplicated PDA and posterolateral branches are supplied by branches of both the RCA and LAD/LCx.
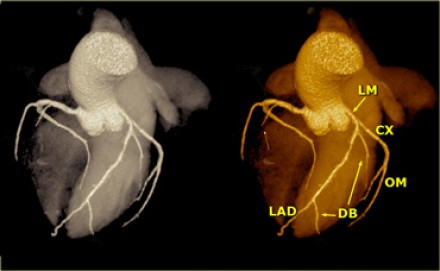
Доминантная правая коронарная артерия и ее ветви.
Правый тип кровоснабжения сердца. Схематическое строение правой коронарной артерии (переднезадняя проекция). AV = atrioventricular, PDA = posterior descending artery, RCA = right coronary artery, RV = right ventricular, SA = sinoatrial.
Доминантная левая коронарная артерия и ее ветви.
Схематическое строение левой коронарной артерии при левом типе кровоснабжения сердца (левая передняя косая проекция). AVGA = atrioventricular groove artery, PDA = posterior descending artery.
Источник: Sunil Kini, Kostaki G. Bis, and Leroy Weaver. Normal and Variant Coronary Arterial and Venous Anatomy on High-Resolution CT Angiography. American Journal of Roentgenology 2007 188:6, 1665-1674.
Коронароангиография
Физиологические основы
В университетскую программу первых курсов входит изучение строения сердца и его коронарных сосудов. Но чаще всего авторы учебников ограничиваются описанием только крупных сосудов. Клиницисты же используют совершенно иную, но также международную номенклатуру. Коронароангиография и имплантация стентов требуют более подробного описания сосудов сердца, что нашло применение и в международной практике.
Из курса анатомии каждый узнал, что от аорты отходят две артерии, кровоснабжающие само сердце: левая и правая коронарные артерии. Утолщения на корне аорты, из которых и выходят эти артерии, называются соответственно левым и правым коронарными синусами.
Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Итак, перечислим еще раз все сокращения:
Левая коронарная артерия — left coronary artery (LCA):
— Передняя межжелудочковая ветвь (ПМЖВ), или передняя нисходящая артерия — left anterior descending artery (LAD); иначе — ramus interventricularis anterior (RIVA/RIA);
— Диагональные артерии (ветви) — ДА; ramus diagonalis (RD/Diag);
— Огибающая ветвь (ОВ) левой коронарной артерии, огибающая артерия — left circumflex coronary artery (LCх));
— Ветвь тупого края, obtuse marginal artery, obtuse marginal branch, (OMB);
— Перегородочные межжелудочковые ветви, ramus septalis (RSA);
— Промежуточная артерия, ramus intermedius (RIM).
Правая коронарная артерия — right coronary artery (RCA):
— Ветвь острого края, acute marginal artery, (AMB);
— Артерия синоатриального узла — ramus nodi sinuatrialis (S-A node artery, SNASA/RNS);
— Задняя межжелудочковая ветвь (ЗМЖВ), или задняя нисходящая артерия — posterior descending artery (PDA); иначе — ramus interventricularis posterior (RIVP/RIP).
И еще раз для повторения (важное задание для диагностики локализации ишемии при инфаркте миокарда): LAD/RIVA, LCx кровоснабжает левую камеру спереди и сбоку, а RCA — сзади. Левое предсердие кровоснабжают LCx, RCA. Перегородку — RSA от LAD. Правую камеру сзади — RCA, спереди — RCA, LAD. Правое предсердие — RCA.
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.
Например, при инфаркте правых отделов сердца (задней стенки) часто особенно сильно поражается правый желудочек. Чаще всего это происходит из-за тромба в RCA. Правые отделы сердца не способны сокращаться должным образом, что приводит к снижению преднагрузки левой камеры сердца, поскольку таким образом снижается объем крови, транспортируемый к левому предсердию. Сниженный сердечный выброс сердце пытается компенсировать увеличением частоты сокращений. При инфаркте же левых отделов сердца основным осложнением является кардиогенный шок.
Специально для наших подписчиков мы сделали таблицу, в которой показаны изменения ЭКГ в зависимости от локализации возможного повреждения коронарных артерий.
Стоит также повторить и классификацию острых коронарных синдромов:
I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день);
II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов);
III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения:
А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность);
B — первичная нестабильная стенокардия;
C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
ПБКА и стентирование
Sones еще в 1959 году описал метод, позволяющий оценить состояние отдельных коронарных сосудов. Judkins модифицировал описанный метод в 1967 году. Именно этот способ исследования коронарных сосудов применяется и по сей день. Первая транслюминальная баллонная коронарная ангиопластика (ТБКА) была проведена 16 сентября 1977 в Цюрихе в Швейцарии. С этого момента количество пациентов с ОКС, подвергшихся ТБКА, возросло с 10 до 65 %. По последним данным, недавно опубликованным в журнале The Lancet, смертность вследствие сердечно-сосудистых заболеваний в 2010 году снизилась на четверть по сравнению с 1950 годом, когда 400 из 100 000 случаев заканчивались летальным исходом. Первым пациентом был 38-летний мужчина-курильщик, у котого наблюдался стеноз LAD. После операции мужчина прожил еще 37 лет.
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30–40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.
Первую имплантацию стента провел Sigwart в 1987 году. Тогда стенты монтировались непосредственно на баллон самим врачом. Сейчас же вся конструкция идет в комплекте, что позволило снизить риск потери стента в кровеносном русле при его недостаточной фиксации.
Появились и новые типы самих баллонов. Некоторые из них имеют на своей поверхности режущие зубцы, что расположены параллельно оси сосуда, а также баллоны из нитинола и нейлона хеликальные или же параллельные оси сосуда. Эти конструкции позволяют создать идеальную площадку для имплантации будущего стента. Сперва в процессе исследований ученые не заметили разницы между такими баллонами и стандартными, однако недавно выяснилось, что такие надсекающие баллоны, покрытые лекарственными средствами, показывают лучшие результаты.
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
Существуют также стенты с особым покрытием, создающим непроницаемый для крови барьер. К таким вещества относят политетрафторэтилен и полиэтилен. Сперва их использовали для экстренного закрытия небольших перфораций коронарных артерий, однако сейчас их применяют в профилактике коронарных аневризм и артериовенозных фистул.
Drug-eluting-stents (DES) покрыты специальными веществами, подавляющими пролиферацию клеток эндотелия, таким образом препятствуя рестенозированию сосуда, чаще всего развивающемуся в течение 4–8 месяцев после имплантации.
Стенты – ферромагнетики, плотно устанавливающиеся в сосудистом русле не являются противопоказанием для проведения МРТ.
Существуют специальные стенты для позиционирования их в устьях и разветвлениях сосудов. Как и любой инородный объект в кровеносном русле, стенты являются дополнительным фактором тромбообразования. Поэтому после самой процедуры пациенту всегда назначают ДААТ или ТАТ.
Брахитерапия
Этот метод основан на радиоактивном облучении коронарных артерий при рецидивах после имплантации стентов. Для этого используется бета-излучение, поскольку оно способно проникать лишь на несколько миллиметров внутрь толщи ткани. При этом методе катетер вводят в место стеноза, который прежде был дилатирован баллоном. С помощью этого катетера зону определенное количество времени (3–5 минут) облучают рассчитанной дозой. Васкулярная брахитерапия используется с 1996 года. В феврале 2005 года прекратила свое существование фирма, разрабатывающая аппараты для брахитерапии коронарных сосудов (Beta-Cath-System).
Ротаблационная пластика
Этот метод используется с 1989 года. В сосуд вводится алмазный бор, способный вращаться с частотой 190 000 об. в минуту. С его помощью удаляются ткани в месте рестенозирования. Величина таким образом измельченных частиц составляет 5–10 микрометров (длина эритроцита — 7,5 микрометров). Образуемый канал очень небольшой в диаметре, но достаточный для проведения ПТКА. Как правило, метод используют в случае образования на месте рестеноза кальцификатов. Диаметр головки бора варьируется от 1,25 до 2,5 мм. Поскольку кабель для ротаблационного бора плохо проходит место стеноза, успех операции составляет 80–95 %. К осложнениям относят спазмы сосудов, возникающие чаще (5 %), чем при ПТКА.
Интраваскулярный ультразвук
Еще одним инструментом кардиолога является метод интраваскулярного ультразвука (IVUS). В сосуд вводят ультразвуковой зонд.
Порядок манипуляций напоминает таковой при ПТКА: после позиционирования проводника зонд проводят к месту стеноза. Ультразвук позволяет просмотреть 1 мм тканей на расстоянии от излучателя. Всего на верхушке катетера используется 64 таких кристалла (пьезоэлемента). С помощью этого метода возможно определить состав бляшек и их фибринные, липидные и кальциевые составляющие. Чаще всего к ультразвуку прибегают при неоднозначности ангиографической картины, используя как дополнительный метод обследования.
Всех нас на физиологии мучили графиками давления в сосудах. Мало кто на младших курсах мог подумать, что эти данные действительно используются в диагностике. При каждой коронароангиографии исследуют давление в коронарных артериях и его изменения в зависимости от наличия стенозированных участков. Для этого к исследуемому участку подводят детектор диаметром 0,014 дюймов. Этот катетер продвигают до самого конца коронарной артерии. Потом его тянут обратно. Таким образом фиксируется давление на всем протяжении артерии. На мониторе врачи наблюдают изменение давления; в месте наибольшего его перепада чаще всего и оказывается самый стенозированный участок. Постепенное изменение давления является свидетельством диффузного заболевания сосудов. Важно откалибровать детектор до самого исследования. После аппликации аденозина наблюдается гиперемия, то есть увеличение циркуляции крови, что симулирует состояние нагрузки. После этого давление на протяжении сосуда измеряется еще раз, что позволяет определить, являются ли места стенозирования важными, вызывают ли именно они боли у пациента при физических нагрузках. Аденозиновый тест не является безопасным: возможно развитие нарушений сердечного ритма, однако из-за короткого периода полувыведения аденозина лишь кратковременно.
Спазмы коронарных сосудов и ацетилхолиновый тест
Спазмы коронарных артерий часто являются причиной болей за грудиной в ночное время суток у пациентов без видимых изменений коронарных сосудов. Таким пациентам также назначают коронароангиографию и проводят вышеуказанный провокационный тест, чтобы исключить психогенные или некардиальные причины таких симптомов. Сейчас у каждого человека, уже сдавшего физиологию, должна промелькнуть мысль: «Почему ацетилхолин?». Если вы не находите ответа, возможно, придется снова открыть учебник. Дело в том, что эндотелий сердца при аппликации ацетилхолина вырабатывает NO, что приводит к расширению сосудов. Ацетилхолин оказывает вазоконстрикторное действие на гладкомышечные клетки сосудов в результате прямой их стимуляции, если эндотелий поврежден. Таким образом можно отличить здоровый эндотелий от поврежденного. Здоровые сосуды реагируют на ацетилхолин расширением, поврежденные же сужаются. При сужении сосудов более чем на 75 % по сравнению с аппликацией нитроглицерина внутрикоронарно говорят о коронарном спазме.
Источники