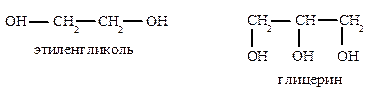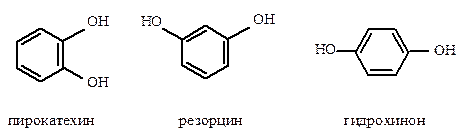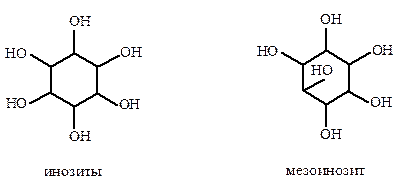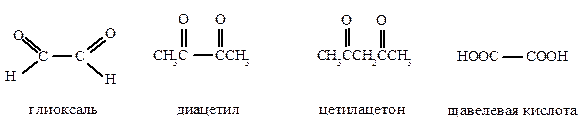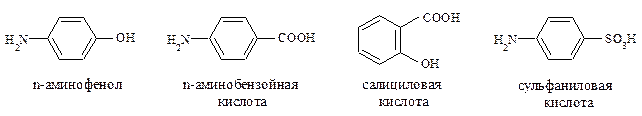Что такое полифункциональные соединения
Полифункциональные соединения – это соединения, в молекулах которых присутствуют две или более одинаковых функциональных групп
Классификация
В соединениях, участвующих в процессах жизнедеятельности, наиболее часто встречаются следующие функциональные группы.
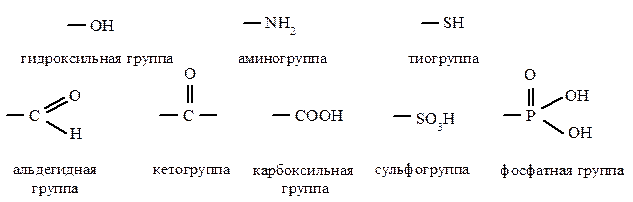
Двухатомные фенолы – пирокатехин, резорцин, гидрохинон – входят в состав многих природных соединений. Все они дают характерное окрашивание с хлоридом железа (III).
Примерами многоатомных спиртов высшей атомности служат пентитыи гекситы, спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса.
Представители пентитов и гекситов – ксилит и сорбит – заменители сахара для больных диабетом.
Примерами циклических спиртов служат инозиты – шестиатомные спирты циклогексанового ряда.
Мезоинозит относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных эфиров.
Соединения с несколькими аминогруппами встречаются гораздо реже. Их простейший представитель – этилендиамин H2NCH2CH2NH2.
Тетраметилендиамин, или путресцин H2NCH2CH2CH2CH2NH2 и пентаметилендиамин, или H2NCH2CH2CH2CH2CH2NH2 длительное время считали трупными ядами, т.е. соединениями, обуславливающими ядовитость гниющих белков. В настоящее время выяснено, что ядовитые свойства белкам при гниении придают другие вещества.
К поликарбонильным относится ряд классов соединений, поскольку карбонильная группа входит в состав альдегидов, кетонов, карбоновых кислот и других соединений. Наиболее распространены дикарбонильные соединения. Ниже приведены простейшие алифатические дикарбонильные соединения – глиоксаль (этандиаль), диацетил (бутандион), ацетилацетон (пентандион-2,4), щавелевая (этандиовая) кислота.
Гетерофункциональные соединения. Из соединений с двумя различными функциональными группами в природных объектах широко представлены аминоспирты, гидрокси-, амино- и оксокислоты.
| H2NCH2CH2OH | HOCH2COOH | 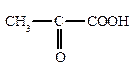 |
| коламин | гликолевая кислота | пировиноградная кислота |
В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств составляют n-аминофенол, n-аминобензойная кислота, силициловая кислота и сульфаниловая кислота.
Поли- и гетерофункциональные соединения могут проявлять свойства, присущие монофункциональным соединениям, т.е. способность вступать в реакции по каждой функциональной группе.
Однако одновременное наличие нескольких функциональных групп в молекуле ведет к появлению определенных различий в свойствах моно-, поли- и гетерофункциональных соединений. Во-первых, в поли- и гетерофункциональных соединениях может наблюдаться усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Во-вторых, в поли- и гетерофункциональных соединениях могут появляться специфические химические свойства, которые наиболее важны для обеспечения биологических функций, выполняемых этими веществами.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Полифункциональные соединения
ПОЛИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ
Полифункциональные соединения – это соединения, в молекулах которых присутствуют две или более одинаковых функциональных групп.
Классификация
В соединениях, участвующих в процессах жизнедеятельности, наиболее часто встречаются следующие функциональные группы.
Двухатомные фенолы – пирокатехин, резорцин, гидрохинон – входят в состав многих природных соединений. Все они дают характерное окрашивание с хлоридом железа ( III ).
Примерами многоатомных спиртов высшей атомности служат пентиты и гекситы , спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса.
Представители пентитов и гекситов – ксилит и сорбит – заменители сахара для больных диабетом.
Примерами циклических спиртов служат инозиты – шестиатомные спирты циклогексанового ряда.
Мезоинозит относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных эфиров.
Тетраметилендиамин, или путресцин H 2 NCH 2 CH 2 CH 2 CH 2 NH 2 и пентаметилендиамин, или H 2 NCH 2 CH 2 CH 2 CH 2 CH 2 NH 2 длительное время считали трупными ядами, т. е. соединениями, обуславливающими ядовитость гниющих белков. В настоящее время выяснено, что ядовитые свойства белкам при гниении придают другие вещества.
В результате этой реакции спирты образуют сложные эфиры. В качестве ацилирующих реагентов могут использоваться как неорганические, так и органические кислоты и их функциональные производные.
В виде 1%-го раствора в этаноле или в виде таблеток тринитрат глицерина применяют в медицине при стенокардии.
Нагревание этиленгликоля с разбавленной серной кислотой приводит к межмолекулярному отщеплению воды и образованию диоксана.
Глицерин при нагревании образует ненасыщенный альдегид – акролеин.
Окисление полиолов является многофакторным процессом и редко приводит к индивидуальным продуктам. Так, действие азотной кислоты или триоксида хрома на этиленгликоль заключается в двух последовательно протекающих реакциях окисления спиртовых функций через альдегидные в карбоксильные:
Двухатомные фенолы – пирокатехин, резорцин, гидрохинон – входят в состав многих природных соединений. Все они дают характерное окрашивание с хлоридом железа ( III ).
Дикарбоновые кислоты. К ним относят соединения с двумя карбоксильными группами. Это белые кристаллические вещества, обладающие более кислым характером, чем монокарбоновые кислоты.
Некоторые дикарбоновые кислоты и их названия
Кислотные свойства этих кислот, особенно первых представителей, значительно выше, чем монокарбоновых кислот.
Дикарбоновые кислоты способны образовывать два вида функциональных производных: неполные, т. е. по одной карбоксильной группе, и полные – по обеим карбоксильным группам.
Кальциевые соли щавелевой кислоты малорастворимы, и поэтому они являются причиной образования оксалатных камней в почках и мочевом пузыре.
Специфические свойства дикарбоновых кислот, обусловленные наличием в молекуле двух карбоксильных групп, проявляются прежде всего в их склонности к реакциям декарбоксилирования. Так, щавелевая и малоновая кислоты при нагревании легко декарбоксилируются с образованием монокарбоновой кислоты с укороченной углеродной цепью:
Представители ненасыщенных дикарбоновых кислот с одной двойной связью служат π-диастереомерные малеиновая и фумаровая кислоты.
Малеиновая кислота является менее стабильным цис -изомером по сравнению с транс -изомером – фумаровой кислотой.
Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную дегидратацию с образованием циклического ангидрида.
Фумаровая кислота достаточно широко распространена в природе и участвует в обменных процессах, протекающих в организме. В частности, она является промежуточным соединением в цикле трикарбоновых кислот.
Полифункциональные соединения.



Полифункциональными называют соединения, в молекулах которых имеется несколько одинаковых функциональных групп.
Многоатомные спирты и фенолы
Резорцин(м-дигидроксибензол) используется как антисептик и дезинфицирующее средство при кожных заболеваниях.
Гидрохинон(п-дигидроксибензол), обладающий восстановительной способностью, является структурным фрагментом ряда соединений. В организме восстановительная способность замещенного гидрохинонового фрагмента делает его участником важного процесса транспорта электронов от окисляемого субстрата к кислороду.
Дикарбоновые кислоты
Названия некоторых дикарбоновых кислот и их производных
| Название кислоты | Формула | Название аниона или основы сложного эфира |
| Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) | НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН | Оксалат Малонат Сукцинат Глутарат |
Щавелевая кислота— простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Малеиновая и фумаровая кислоты— представители ненасыщенных дикарбоновых кислот с одной двойной связью (см. 7.1.3). Фумаровая кислота участвует в обменных процессах, протекающих в организме.
Лекция 10. Химические свойства моно- и полифункциональных соединений
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Ярославская государственная медицинская академия Минздравсоцразвития РФ
Кафедра биологической и общей химии
Лекция 10. Химические свойства
моно- и полифункциональных соединений
1.Реакционная способность органических соединений
Большинство органических соединений могут проявлять свойства как кислот, так и оснований (быть и донорами и акцепторами протона). Какую роль данное соединение будет выполнять, зависит от второго реагента, так как кислота проявляет свои свойства только в присутствии сильного основания и наоборот. Согласно законам термодинамики каждая частица самопроизвольно стремится перейти в более устойчивое состояние и уменьшить тем самым энтальпию системы. Так, сильная кислота является неустойчивой и легко отдает протон основанию. Сильное основание легко присоединяет протон отрывая его от кислоты. Данные процессы идут самопроизвольно, так как сопровождаются уменьшением свободной энергии (G0). Поэтому в реакциях важно определить сравнительную силу кислот или оснований, так как это определяет самопроизвольное протекание кислотно-основного взаимодействия.
Сила кислоты определяется стабильностью сопряженного с ней основания (аниона). Чем стабильнее анион, тем сильнее кислота, а стабильность аниона зависит от степени делокализации электронной плотности (энтропийный фактор). Поэтому усиливают кислотность:
сопряжение с кислотным центром
большой радиус атома в кислотном центре
высокая электроотрицательность атома в кислотном центре
электроноакцепторные заместители в молекуле кислоты
Сравнительная сила кислот: карбоновые кислоты> фенолы > тиолы многоатомные спирты> одноатомные спирты > амины
1.Наиболее сильные кислоты (карбоновые кислоты, фенолы, тиолы) взаимодействуют со щелочами с образованием соли.
2. Средние по силе кислоты многоатомные спирты взаимодействуют с гидорксидом меди (II), с образованием хелатного комплекса.
3. Слабые кислоты одноатомные спирты взаимодействуют только со щелочными металлами.
Сила оснований определяется степенью локализации электронной плотности на основном центре, следовательно, все факторы, усиливающие кислотность будут в той же мере снижать силу оснований.
Сравнительная сила основных центров:
Сопряжение с основным центром максимально ослабляет основность. Электронодоноры усиливают основность.
Доказательство основных свойств аминов
Окислительно-восстановительными реакциями (ОВР) называют химические реакции, протекающие с изменением степени окисления атомов вследствие переноса электрона от одной частицы к другой.
1.Значение окислительно-восстановительных реакций (ОВР)
ОВР – основа существования живых систем, снижающих энтропию за счет получения энергии из окружающей среды. Основная часть энергии поступает в организм в процессе питания. Органические соединения пищи окисляются (экзэргонические реакции) и организм получает энергию для эндэргонических реакций синтеза, снижающих энтропию
Виды биохимических окислительно-восстановительных процессов
Б. ОВР, связанная с изменением содержания атомов кислорода в молекуле называют оксигеназная ОВР
альдегид карбоновая к-та
В. Свободнорадикальное окисление-восстановление идет по цепному механизму и не контролируется ферментами.
Субстрат – вещество, у которого происходит разрыв связи у атома углерода. Определяет тип реакции.
Реагент – вещество (частица), атакующая субстрат (радикал, электрофил, нуклеофил). Определяет механизм реакции.
А. Гомолиз, образование радикалов
R- Радикал (свободный радикал) это частица с неспаренным электроном, образуется в результате гомолитического разрыва связи:
Радикал определяет радикальный (цепной) механизм реакции.
Субстрат – вещество, у которого происходит разрыв связи у атома углерода. Определяет тип реакции.
Реагент – вещество (частица), атакующая субстрат (радикал, электрофил, нуклеофил). Определяет механизм реакции.
R- Радикал (свободный радикал) это частица с неспаренным электроном, образуется в результате гомолитического разрыва связи:
Радикал определяет радикальный (цепной) механизм реакции.
Б. нуклеофилы и электрофилы

характерно для насыщенных, ароматических, р, p-сопряженных соединений.
характерно для ненасыщенных соединений, содержащих p-связи и
малых циклов (циклопропан, циклобутан)
3


Характерна для спиртов, аминов, галогеналканов, в результате образуется двойная связь.
Презентация была опубликована 8 лет назад пользователемlanedu.ru
Похожие презентации
Презентация на тему: » Углеводы Что такое углеводы Углеводы – полифункциональные соединения это органические вещества, молекулы которых состоят из атомов углерода, водорода и.» — Транскрипт:
2 Что такое углеводы Углеводы – полифункциональные соединения это органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся в них, как правило, в таком же соотношении, как и в молекуле воды (2:1). Общая формула углеводов С n (H 2 O) m
3 Функции углеводов 1. Они поставляют энергию для биологических процессов. 2. Являются исходным материалом для синтеза в организме других gромежуточных или конечных метаболитов. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Пища человека состоит примерно на 70% из углеводов.
5 1. Свекловичный сахар в чистом виде был открыт лишь в 1747 г. немецким химиком А. Маргграфом 2. В 1811 г. русский химик Кирхгоф впервые получил глюкозу гидролизом крахмала 3. Впервые правильную эмпирическую формулу глюкозы предложил шведский химик Я. Берцеллиус в 1837 г. С 6 Н 12 О 6 4. Синтез углеводов из формальдегида в присутствии Са(ОН) 2 был произведён А.М. Бутлеровым в 1861 г.
7 Крахмал Целлюлоза Гликоген (С 6 Н 10 О 5 ) n (гидролизуются на большое количество молекул моносахаридов) Классификация углеводов Моносахариды Дисахариды Полисахариды Глюкоза ( виноградный сахар) Фруктоза Рибоза С 6 Н 12 О 6 (не гидролизуются) Сахароза (свекловичный или тростниковый сахар) Лактоза (молочный сахар) С 12 Н 22 О 11 (гидролизуются на 2 молекулы моносахаридов)
10 Дисахариды Сахароза (обычный пищевой сахар). Она содержится в большом количестве сахарной свекле, сахарном тростнике.
11 Мальтоза Мальтоза (солодовый сахар Мальтозу можно получить при гидролизе крахмала под действием ферментов, содержащихся в солоде.
12 Крахмал – резервный полисахарид многих растений. В промышленности его получают из картофеля. Это белый порошок. Полисахариды
13 Целлюлоза (клетчатка) – широко распространена в природе: из неё построены ткани растений. Вата, фильтровальная бумага – наиболее чистые формы целлюлозы (до 96%). Составная часть древесины – целлюлоза. Полисахариды
14 Гликоген – животный крахмал, который откладывается в печени и является резервным веществом в организме человека и животных. Полисахариды
15 1. Глюкоза является бифункциональным соединением – альдегидоспиртом 2. Глюкоза также существует в виде циклических форм