Что такое полиморфизм железа
Полиморфизм железа
Дата добавления: 2015-07-09 ; просмотров: 10079 ; Нарушение авторских прав
Полиморфизм. Некоторые металлы в зависимости от температуры могут существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением. Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре. Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
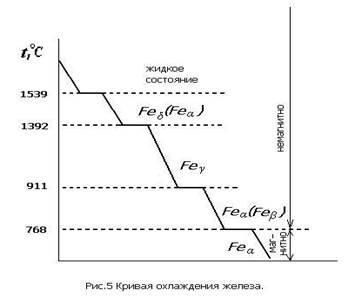
Важное значение имеет полиморфизм железа. На рис. 5 изображена кривая охлаждения железа.
Полиморфные превращения характеризуются горизонтальными участками на кривой охлаждения, так как при них происходит полная перекристаллизация металла. До 911°С устойчиво Feα, имеющее кубическую объемноцептрированную решетку. В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ. Остановка на кривой охлаждения при 768 °С связана не с полиморфным превращением, а с изменением магнитных свойств. До 768 °С железо магнитно, а выше — немагнитно.
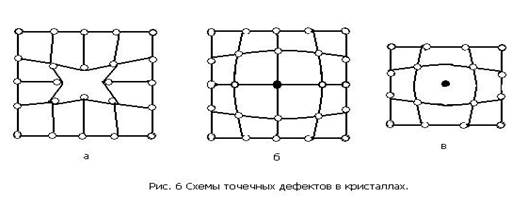
Дефекты кристаллического строения. Реальный металлический кристалл всегда имеет дефекты кристаллического строения. Они подразделяются на точечные, линейные и поверхностные (рис. 6).
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а), а также замещенные атомы примеси (рис. 6, б) и внедренные атомы (рис. 6, в) которые могут быть как примесными, так и атомами основного металла.
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
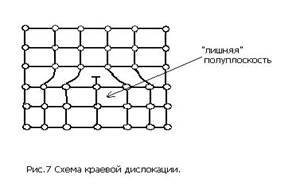
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями. Краевая дислокация (рис. 7) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости.
Поверхностные дефекты малы только в одном измерении. К ним относятся, например, границы между отдельными зернами или группами зерен.
Полиморфизм металлов



Полиморфизм это такое явление, когда материал в одном интервале температур или давлений имеет одну кристаллическую структуру, а в других интервалах – другую. Иными словами с изменением температуры или давления наблюдается изменение кристаллической структуры материала. Температуру и давление, при которых происходит смена кристаллической структуры материала, называют соответственно температурой и давлением полиморфного или аллотропического превращения.
Различные кристаллографические модификации одного материала принято обозначать буквами греческого алфавита α, β, g, δ, ε, σ и т.д. Модификацию, наблюдаемую при самых низких температурах, обозначают буквой α, при более высоких температурах – β, и т.д.
Ярким примером полиморфизма у неметаллических материалов является наличие двух кристаллографических модификаций чистого углерода, известных как алмаз и графит. Оба материала являются идентичными по химическому составу и отличаются лишь кристаллической структурой. В результате свойства алмаза и графита оказываются существенно различными. Графит это мягкий, хрупкий и непрозрачный материал, в то время как алмаз является одним из наиболее твёрдых минералов, встречающихся в природе, и, как правило, прозрачен.
Полиморфизм достаточно распространённое явление в мире металлов. Многие из металлов обладают полиморфизмом. Например, у Со с повышением температуры ГПУ-структура перестраивается в ГЦК-структуру, а у Ti ГПУ-структура перестраивается в ОЦК-структуру.
Наиболее ярко полиморфизм проявляется у железа, которое при нагреве два раза меняет свою кристаллическую структуру (рис. 11).
 |  |
 |  |
ОЦК ГЦК ОЦК жидкость
768 911 1392 1539 Т, °С.
Рис. 11. Кристаллографические модификации железа.
При температурах ниже 768°С железо является ферромагнитным материалом, а при температурах выше 768°С – парамагнитным. Ранее считали, что изменение магнитных свойств железа связано с изменением его кристаллической структуры и поэтому ферромагнитное железо стали обозначать α-Fe, а парамагнитное – β-Fe. Позже выяснилось, что это не так. И то и другое железо имеют одинаковую ОЦК-структуру. Однако исторически сложившееся подразделение железа на α-Fe и β-Fe сохранили. В настоящее время железо с ОЦК-структурой, наблюдаемое в интервале температур до 911 ° С, называют α-железом.
В интервале температур от 911 до 1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК-структуры более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение размера (объёма) образца.
В интервале температур от 1392 до 1539°С железо вновь имеет ОЦК-структуру. Однако период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe.
При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав.
Явление полиморфизма в очередной раз подчёркивает, что свойства материалов определяются не только их химическим составом, но и в значительной степени их структурой.
3. ФОРМИРОВАНИЕ МИКРОСТРУКТУРЫ МЕТАЛЛОВ
И СПЛАВОВ ПРИ ЗАТВЕРДЕВАНИИ
Процесс перехода вещества из жидкого состояния в твёрдое кристаллическое состояниеназывают кристаллизацией. Обратный процесс называют плавлением. Рассмотрим подробно процесс кристаллизации металлов.
Что такое полиморфизм железа
Полиморфные модификации железа
Железо имеет четыре полиморфные модификации. До 917 °С существует α-Fe с объемоцентрированной кубической решеткой, β-Fe существует в температурном интервале 769–917 °С, отличается от α-Fe только параметрами кристаллической решетки и магнитными свойствами. В интервале температур 917–1394 °С существует γ-Fe с гранецентрированной кубической решеткой, выше 1394 °С устойчиво δ-Fe с объемоцентрированной кубической решеткой.
Полиморфные модификации кобальта
Кобальт имеет две полиморфные модификации: низкотемпературную α-Co, которая кристаллизуется в гексагональной плотноупакованной решетке, и высокотемпературную β-Со, имеющую кубическую гранецентрированную решетку. Переход α-Co в β-Со происходит при температуре 450 °С.
Железо, кобальт и никель в свободном состоянии – серебристо-белые металлы. Железо имеет сероватый оттенок, кобальт – розоватый, никель – желтоватый. Чистые металлы пластичны, незначительные примеси повышают их твердость и хрупкость. Все металлы обладают магнитными свойствами.
Для железа и кобальта характерен полиморфизм. Железо имеет четыре кристаллические модификации, кобальт – две кристаллические модификации. Никель при обычном давлении кристаллизуется только в кубической гранецентрированной решетке.
Металлы триады железа тугоплавки, в ряду Fe – Co – Ni температура плавления уменьшается. Относятся к металлам средней активности.
Некоторые физические свойства металлов триады железа приведены в таблице.
Определение мутаций в генах BRCA1 и BRCA2 (кровь) в Москве
Приём и исследование биоматериала
Когда нужно сдавать анализ Определение мутаций в генах BRCA1 и BRCA2 (кровь)?
Подробное описание исследования
Состав генетического комплекса:
Рак молочной железы – самая распространённая форма рака у женщин. Так, в России, из всех женщин, заболевших раком, каждая пятая (21%) имеет именно эту патологию – рак молочной железы.
Каждый год страшный диагноз слышат более 65 тысяч женщин, из них уходят из жизни более 22 тысяч. Хотя полностью избавиться от болезни на ранних стадиях возможно в 94% случаев. В этот комплекс входит определение мутаций в генах BRCA1 и BRCA2.
Рак молочной железы и наследственность:
Рак молочной железы в семейной истории болезни вот уже многие годы считается фактором риска. Около ста лет назад были описаны случаи семейного рака молочной железы, передающиеся из поколения в поколение. В некоторых семьях болеют только раком груди; в других появляются и другие виды рака.
Около 10-15% случаев заболеваний раком молочной железы – наследственные. Риск заболеть раком груди для женщины, мать или сестра которой болели этой болезнью, в 1,5-3 раза выше по сравнению с женщинами, чьи ближайшие родственники не болели раком молочной железы.
Рак молочной железы во всем мире считается наиболее исследованным онкологическим заболеванием. Каждый год появляется новая информация о природе этого онкологического заболевания и разрабатываются методики лечения.
Гены BRCA1 и BRCA2:
Еще в начале 90-х годов BRCA1 и BRCA2 были идентифицированы как гены предрасположенности к раку молочной железы и раку яичников.
Наследственные мутации в генах BRCA1 и BRCA2 приводят к возрастающему в течение жизни риску развития рака груди. Оба этих гена имеют отношение к обеспечению стабильности генома, а точнее, в механизме гомологичной рекомбинации для репарации двухцепочечной ДНК.
Помимо рака молочной железы, мутации в гене BRCA1 проявляются при раке яичников, причем оба типа опухолей развиваются в более раннем возрасте, чем при ненаследственном РМЖ.
Риск заболевания раком груди у женщин с мутацией генов BRCA1 и BRCA2:
У женщин – носительниц мутаций в одном из генов BRCA1 и BRCA2, риск заболеть раком молочной железы и раком яичников (реже – другими видами рака) выше, чем у других.
Следует подчеркнуть, что степень риска заболеть раком груди меняется в зависимости от семейного анамнеза. Степень риска повторно заболеть раком груди у женщины – носительницы мутации, уже переболевшей раком груди, составляет 50%. Риск заболеть раком яичников у носительниц мутации в гене BRCA1 составляет 16-63%, а у носительниц мутации в гене BRCA2 – 16-27%.
Полиморфизм железа и принципы формирования твердых растворов
Железо, как и любой металл, имеет кристаллическое строение, то есть атомы железа расположены в пространстве в определенном порядке. При этом можно выделить группу атомов, которые при мысленном копировании и перенесении смогут образовать этот порядок, иными словами, можно выделить элементарную ячейку кристаллической решетки.
Согласно [1, стр. 19] кристаллическая решетка — это «правильное, регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях».
При различных условиях (различных температуре и давлении) железо (Fe) имеет разную кристаллическую решетку. Для чистого Fe, например, при нормальном атмосферном давлении справедливо следующее: ниже 911°С Fe имеет объемоцентрированную кубическую решетку (ОЦК), при 911—1392 °С– гранецентрированную кубическую решетку (ГЦК), выше 1392 °C – опять ОЦК [1, стр. 50].
Выше 1539 Fe плавится, и понятно, что никакой решетки нет.
1392—1539 °C и h0, то и E1>E0.
Так и с металлом: при нормальном атмсферном давлении при температуре 1392—1539°C энергетически выгодным является состояние с ОЦК. С 911 до 1392 – более выгодно ГЦК.
С полиморфизмом мы закончили. Переходим к твердым растворам.
Слова «чистое железо» выше выделены неслучайно, поскольку мы ведь реально-то имеем дело со сталями, а не с чистым железом.
Стали – твердые растворы на основе железа, с содержанием углерода до 2%, в которых помимо железа присутствуют другие элементы [2 стр.5, 3], которые влияют на положение этих критических температур и на другие свойства (это, кстати, отдельная тема и тоже обещанная статья).
Одни из элементов попадают в стали не по воле металлургов, а частично переходят из сырьевого материала (руда, агломерат, чугун, металлолом), частично в процессе производства (раскисление алюминием, добавление марганца, обработка кальцием и т.п.), другие элементы добавляют специально для целенаправленного влияния на свойства. Одни элементы могут раствориться в железе, другие не могут.
Железо образует твердые растворы со многими элементами: с металлами — растворы замещения, с углеродом, азотом водородом — растворы внедрения [1, стр. 145].
Чем ближе размер атома к атому железа, тем вероятнее, что растворение будет по принципу замещения, например, таким будет раствор Ni или Co в железе. Это как с яблоками на картинке: размер один, а сорта разные.
Рассмотрим идеальную углеродистую сталь (это значит только железо и только углерод, и ничего более). Углерод, имея меньший атомный радиус, растворяется в железе по принципу внедрения. Представим, что среди стройных рядов высоких солдат на Красной площади кое-где засели гражданские или что среди яблок «Грени Смит» лежит «Китайка». Углерод как раз сидит в свободном пространстве кристаллической решетки между атомами железа, внедряется в свободное пространство.
Растворы внедрения и замещения можно различить один от другого, измеряя период решетки, например, с помощью рентгеноструктурного анализа или измерения плотности сплава.
Есть два интересных момента, которые указаны выше и которые связаны с полиморфным превращением:
1. при превращении меняется параметр решетки;
2. при превращении меняется тип решетки.
А интересные моменты заключаются в том, что в ГЦК решетке атомы железа стоят друг от друга дальше, центр ячейки вообще свободный (см. рис. выше). А что делать нашим растворенным атомам хрома и углерода, когда с понижением температуры происходит превращение ГЦК в ОЦК? А тут как в игре со стульями, кто успел – тот и сел, остальные – из игры выбывают. То есть часть атомов остается в решетке, а другим придется уходить за ее пределы, например, образуя соединения. Углерод, например, когда уходит, может прихватить с собой как атомы хрома, так и железа, и образует с ними карбиды.
В следующей статье разберем вопрос микроструктур подробнее.
Ссылки
1. Гуляев А.П. — Металловедение, М. «Металлургия», 1986, 282 с.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.