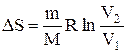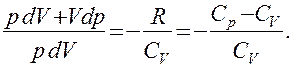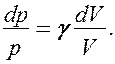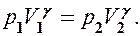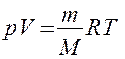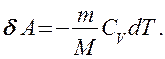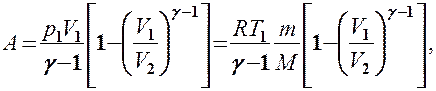Что такое политропа и адиабата
Разница между адиабатическим и политропным
В ключевое отличие между адиабатическими и политропными процессами заключается в том, что в адиабатических процессах теплообмен не происходит, тогда как в политропных процессах теплообмен происходит.
Содержание:
В ключевое отличие между адиабатическими и политропными процессами заключается в том, что в адиабатических процессах теплообмен не происходит, тогда как в политропных процессах теплообмен происходит.
Что такое адиабатический?
Например, подумайте, что происходит при образовании облаков и крупномасштабных конвекционных потоках. На больших высотах атмосферное давление ниже. Когда воздух нагревается, он стремится вверх. Поскольку внешнее давление воздуха низкое, поднимающийся воздушный пакет будет пытаться расшириться. При расширении молекулы воздуха работают, и это изменяет их температуру. Именно поэтому при подъеме температура понижается.
Согласно термодинамике, энергия в воздушном шарике остается постоянной, но она может быть преобразована в различные формы энергии (для выполнения работы расширения или, возможно, для поддержания ее температуры). Однако теплообмена с внешней средой отсутствует. Мы можем применить это же явление и к сжатию воздуха (например, поршня). В той ситуации, когда воздушный пакет сжимается, температура повышается. Эти процессы называются адиабатическим нагревом и охлаждением.
Что такое политропик?
Политропный процесс происходит с теплопередачей. Однако в этом процессе передача тепла происходит обратимо.
Когда газ подвергается такому типу теплопередачи, для политропного процесса справедливо следующее уравнение.
PVn = постоянный
В чем разница между адиабатическим и политропным?
Адиабатический процесс. Политропный процесс.
Адиабатическим называется процесс, при котором отсутствует теплообмен (dQ=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстро протекающие процессы. Например, адиабатическим процессом можно считать процесс в двигателях внутреннего сгорания(расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т.д.
Из первого начала термодинамики (dQ=dU+dA) для адиабатического процесса следует, что
dА=-dU, (2.6.1)
т.е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражение для произвольной массы газа перепишем уравнение в виде
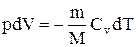
Продифференцировав уравнение состояния для идеального газа 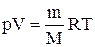
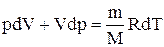
Исключим из (2.6.2) и (2.6.3) температуру Т:
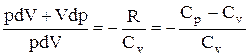
Разделив переменные и учитывая, что 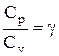
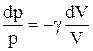
Интегрируя это уравнение в пределах от p1 до р2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению
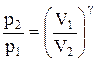
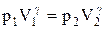
Так как состояния 1 и 2 выбраны произвольно, то можно записать
PV g =const. (2.6.4)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V или р, Т исключим из (2.6.4) с помощью уравнения Клапейрона-Менделеева:
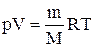
соответственно давление или объем:
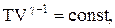
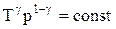
Эти выражения представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина
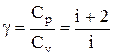
называется показателем адиабаты (или коэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i=3, g =1,67. Для двухатомных газов (Н2, N2, О2 и др.) i=5, g =1,4. Значения вычисленные по формуле (2.6.7), хорошо подтверждаются экспериментом.
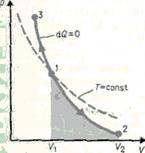
Диаграмма адиабатического процесса (адиабат а) в координатах р, V изображается гиперболой (рис. 2.6.1).
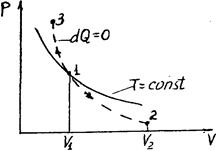 Рис. 2.6.1 Рис. 2.6.1 | На рисунке видно, что адиабата ( 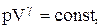 ) более крута, чем изотерма (pV=const). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. ) более крута, чем изотерма (pV=const). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. |
Вычислим работу, совершаемую газом в адиабатическом процессе.
Запишем уравнение в виде
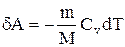
Если газ адиабатически расширяется от объема V1 до V2, то его температура уменьшается от T1 до Т2 и работа расширения идеального газа
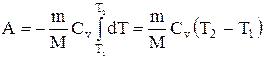
Применяя те же приемы, выражение (2.6.8) для работы при адиабатическом расширении можно преобразовать к виду
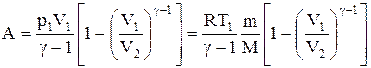
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C=const), можно вывести уравнение политропы:
2.7 Круговой процесс (цикл).
Обратимые и необратимые процессы.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (рис. 2.7.1).
Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1-2) и сжатия (2-1) газа. Работа расширения (определяется площадью фигуры 1а2V2V1) положительна (dV > 0), работа сжатия (определяется площадью фигуры 2blV1V22) отрицательна (dV 0 (цикл протекает по часовой стрелке), то он называется прямым (рис. 2.7.1,а), если за цикл совершается отрицательная работа 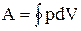
Выражения (2.8.3) и (2.8.4) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (2.8.3) и (2.8.4) можно представить в виде неравенства Клаузиуса
DS 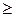
т.е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояние 2, то, согласно (2.8.2), изменение энтропии
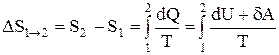
где подынтегральное выражение и пределы интегрирования надо выразить через величины, характеризующие исследуемый процесс. Формула (2.8.6) определяет энтропию лишь с точностью до аддитивной постоянной.
Физический смысл имеет не сама энтропия, а разность энтропии.
Исходя из выражения (2.8.6), найдем изменение энтропии в процессах идеального газа. Так как
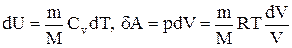
то 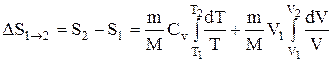
или 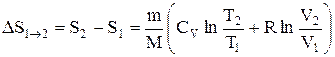
т.е. изменение энтропии 
Так как для адиабатического процесса dQ=0, то DS=0 и, следовательно, S=const, т.е. адиабатический обратимый процесс протекает при постоянной энтропии. Из формулы (2.8.7) следует, что при изотермическом процессе (T1=T2)
при изохорном процессе (V1 =V2)
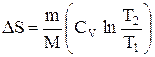
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропии тел, входящих в систему.
Согласно Больцману, энтропия S системы и термодинамическая вероятность связаны между собой следующим образом:
Сопоставляя выражения (2.8.5) и (2.8.8), видим, что энтропия и термодинамическая вероятность состояний замкнутой системы могут либо возрастать (в случае необратимых процессов), либо оставаться постоянными (в случае обратимых процессов).
Отметим, однако, что эти утверждения имеют место для систем, состоящих из очень большого числа частиц, но могут нарушаться в системах с малым числом частиц. Для «малых» систем могут наблюдаться флуктуации, т.е. энтропия и термодинамическая вероятность состояний замкнутой системы на определенном отрезке времени могут убывать, а не возрастать, или оставаться постоянными.
Адиабатический процесс. Политропный процесс



Адиабатическим называется процесс, при котором отсутствует теплообмен ( 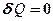
Из первого начала термодинамики ( 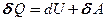
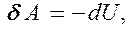
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (52.1) и (53.4), для произвольной массы газа перепишем уравнение (55.1) в виде
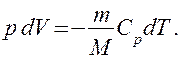
Продифференцировав уравнение состояния для идеального газа 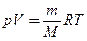
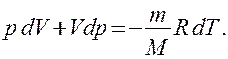
Исключим из (55.2) и (55.3) температуру Т:
Разделив переменные и учитывая, что 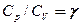
Интегрируя это уравнение в пределах от 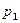
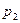
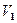
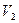
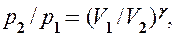
Так как состояния 1 и 2 выбраны произвольно, то можно записать
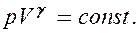
Полученное выражение естьуравнение адиабатического процесса, называемое такжеуравнением Пуассона.
Для перехода к переменным Т, V или р, Т исключим из (55.4) с помощью уравнения Клапейрона — Менделеева
соответственно давление или объем:
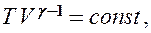
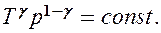
Выражения (55.4) — (55.6) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина (см. (53.8) и (53.2))
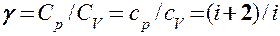
называетсяпоказателем адиабаты (или коэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i = 3, g = 1,67. Для двухатомных газов (Н2, N2, O2 и др.) i = 5, g = 1,4. Значения g, вычисленные по формуле (55.7), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой (рис.83). На рисунке видно, что адиабата (pV g = const) более крута, чем изотерма (pV = const). Это объясняется тем, что при адиабатическом сжатии 1—3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Вычислим работу, совершаемую газом в адиабатическом процессе. Запишем уравнение (55.2) в виде
Если газ адиабатически расширяется от объема V1 до V2, то его температура уменьшается от Т1 до T2 и работа расширения идеального газа
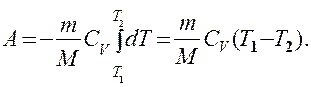
Применяя те же приемы, что и при выводе формулы (55.5), выражение (55.8) для работы при адиабатическом расширении можно преобразовать к виду
где 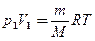
Работа, совершаемая газом при адиабатическом расширении 1—2 (определяется площадью, выполненной в цвете на рис. 83), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и Ср, в изотермическом процессе (dT = 0) теплоемкость равна ± 
Исходя из первого начала термодинамики при условии постоянства теплоемкости (C = const) можно вывести уравнение политропы:
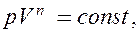
где n = (С—Ср)/(С— СV) — показатель политропы. Очевидно, что при С = 0, п = g из (55.9) получается уравнение адиабаты; при С = 
Блог об энергетике
энергетика простыми словами
Основные термодинамические процессы
Основными процессами в термодинамике являются:
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
Изохорный процесс

При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
т. е. давление газа прямо пропорционально его абсолютной температуре:
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Изменение энтропии в изохорном процессе определяется по формуле:
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
Количество теплоты при cp = const определяется по формуле:
Изменение энтропии будет равно:
Изотермический процесс
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
Адиабатный процесс
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
kвыхлопных газов ДВС = 1,33
Из предыдущих формул следует:
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
n > 0 – гиперболические кривые,
n По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.