Что такое полувыведение препарата
Что такое полувыведение препарата
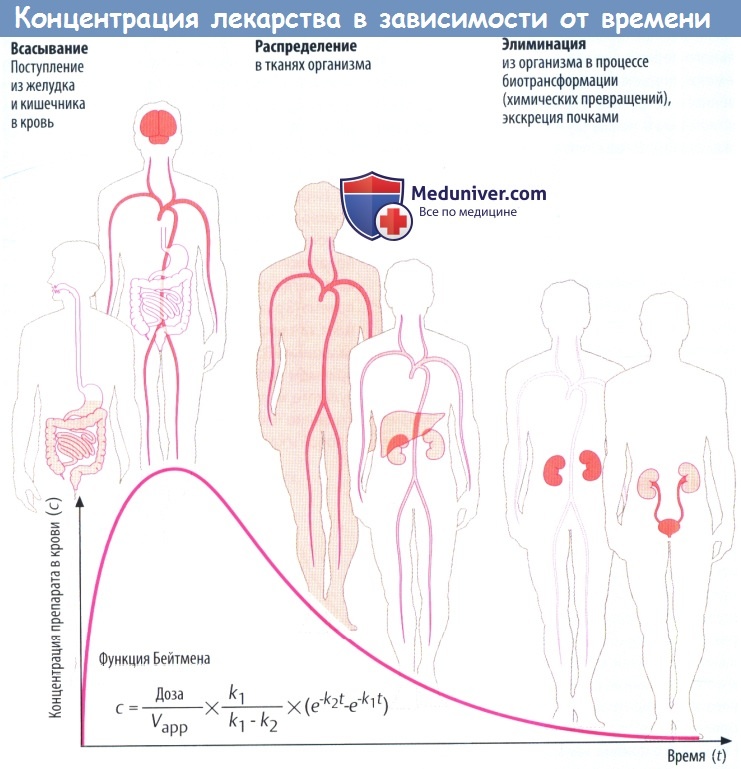
Такие процессы, как всасывание и выведение, обладают экспоненциальными характеристиками. В отношении всасывания это следует из простого факта: количество препарата, перемещающегося за единицу времени, зависит от разности концентраций (градиента) на границе двух тканей (закон Фика).
В процессе всасывания из пищеварительного тракта содержимое кишечника и кровь представляют собой ткани с изначально высокой и низкой концентрациями соответственно. При выведении лекарственного вещества через почки экскреция часто зависит от скорости клубочковой фильтрации, т. е. от количества препарата, попавшего в первичную мочу.
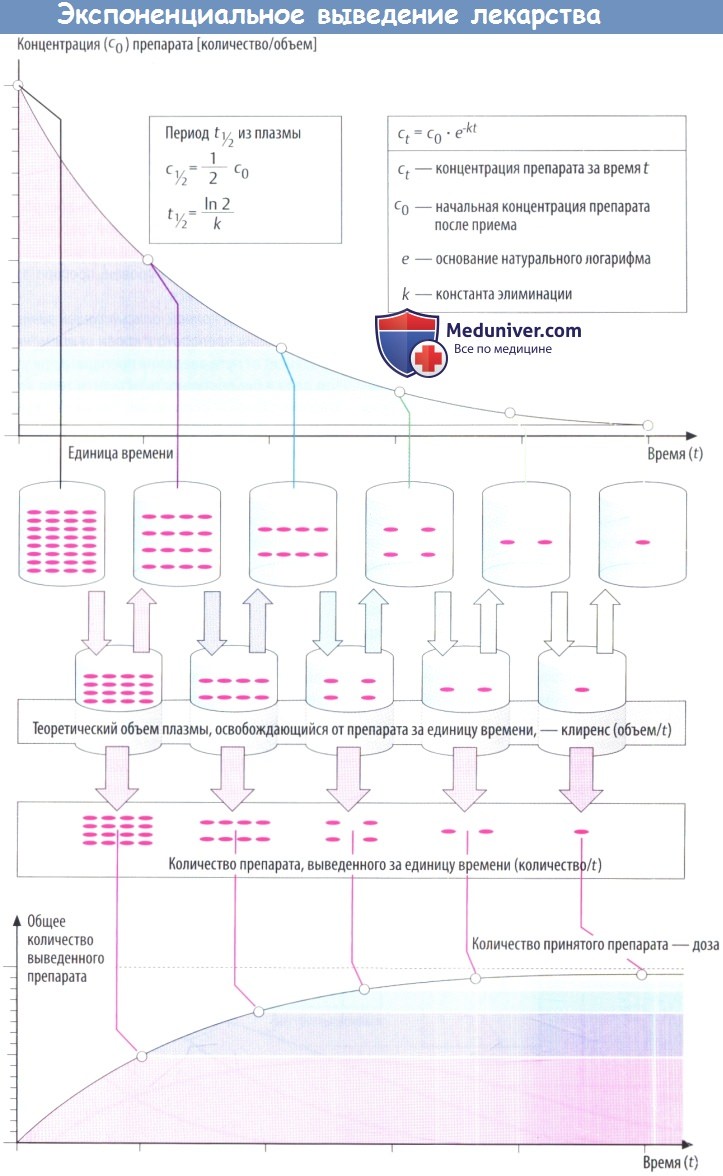
По мере снижения концентрации в крови количество лекарственного вещества, экскретируемого через почки за единицу времени, уменьшается. В результате происходит экспоненциальное снижение, показанное на рисунке ниже. Время экспоненциальногоснижения — постоянный интервал, в течение которого концентрация снижается в 2 раза.
Этот интервал представляет собой период полувыведения (t1/2) и связан с константой скорости элиминации (k) уравнением: t1/2 = (ln2)/k. Эти два параметра вместе с исходной концентрацией (с0) описывают скорость реакции первого порядка (экспоненциальную).
Поскольку эта скорость постоянная, она дает возможность вычислить объем плазмы, освобожденной от лекарственного вещества, учитывая, что оставшееся количество не распределено равномерно в общем объеме плазмы (условие, невозможное в реальности). Теоретический объем плазмы, освобождающейся от лекарственного вещества за единицу времени, называется клиренсом.
В зависимости от того, снижается концентрация в плазме в результате экскреции с мочой либо в результате разрушения в процессе метаболизма, клиренс называют почечным или печеночным. Почечный и печеночный клиренсы суммируются, образуя общий клиренс (Cltot) в случае, если препараты выводятся в неизмененном виде через почки и подвергаются биотрансформации в печени.
Cltot представляет собой сумму всех процессов, участвующих в выведении; он связан с периодом полувыведения (t1/2) и объемом распределения препарата (Vapp) формулой:
Чем меньше объем распределения и чем больше общий клиренс, тем короче период полувыведения.
Для препаратов, выводимых почками в неизмененном виде, t1/2 можно вычислить на основании кумулятивной экскреции с мочой; итоговое общее количество выведенного препарата соответствует количеству всосавшегося препарата.
Печеночная элиминация происходит по экспоненте, т. к. ферменты, катализирующие реакции метаболизма, действуют в квазилинейной области своей кривой активности концентрации; следовательно, количество вещества, подвергшегося метаболизму за единицу времени, уменьшается параллельно снижению концентрации в крови.
Самое известное исключение из экспоненциального закона — выведение алкоголя (этанола), которое происходит по линейному закону (кинетика нулевого порядка), во всяком случае, при концентрации в крови менее 0,02%. Это происходит потому, что лимитирующий скорость фермент алкогольдегидрогеназа достигает полунасыщения при очень низких концентрациях вещества — примерно 80 мг/л (0,008%).
Таким образом, при концентрации этанола в крови на уровне примерно 0,02% скорость реакции выходит на плато, при концентрациях выше этого уровня количество лекарственного вещества, выведенного за единицу времени, остается постоянным.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Период полувыведения (полужизни)
Период полувыведения [ править | править код ]
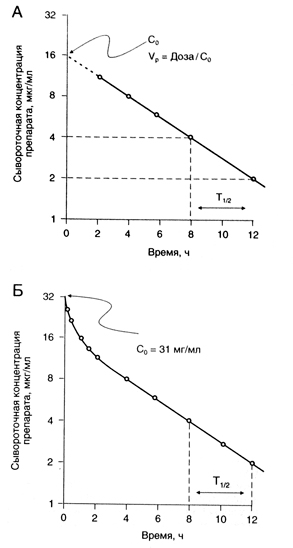
Период полувыведения (Т1/2) — это время, за которое сывороточная концентрация вещества (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели (рис. 1.4, А) определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, так как динамика их сывороточной концентрации описывается несколькими экспоненциальными функциями (рис. 1.4, Б). В таких случаях рассчитывают несколько значений Т1/2.
Раньше Т1/2 рассчитывали по участку фармакокинетической кривой, отражающему стадию равновесия (стадию элиминации). С появлением более чувствительных методов измерения концентрации веществ в крови оказалось, что конечный Т1/2 гораздо больше начального. Например, для гентамицина конечный Т1/2 равен 53 ч, тогда как в Приложении II приведен T1/2 2—3 ч. Чрезвычайно длительный конечный Т1/2 индометацина (120 ч) обусловлен, вероятно, активным кишечно-печеночным кругооборотом препарата (в Приложении II приведен Т 1/2 2,4 ч). Клиническая значимость Т1/2 для того или иного периода зависит от того, какая доля вещества выводится из организма и каков объем распределения в этот период, а также от того, какой из показателей — сывороточная концентрация препарата или его общее содержание в организме — лучше коррелирует с фармакологическими эффектами. В Приложении II приведены величины Т1/2, имеющие наибольшее практическое значение.
В прошлом изменение фармакокинетики лекарственных средств при разных патологических состояниях оценивали только на основании Т1/2. В настоящее время общепризнано, что Т1/2 зависит от клиренса и объема рас- пределения вещества. В стационарном состоянии зависимость между Т1/2, клиренсом и объемом распределения приблизительно описывается следующим уравнением:
T1/2 = 0.693 x Vc / Cl(1.12)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 должен увеличиваться. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т1/2 диазепама увеличивается, но не за счет уменьшения клиренса, а вследствие увеличения объема распределения (Klotzetal., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы и тканей, так что предсказать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно. При остром вирусном гепатите Т1/2 толбутамида уменьшается, а не увеличивается, как это можно было бы ожидать, из-за снижения степени связывания препарата с белками плазмы и тканей. Объем распределения толбутамида не меняется, а клиренс увеличивается вследствие увеличения сывороточной концентрации свободного препарата (Williams et al., 1977).
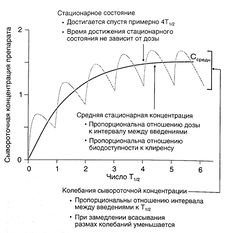
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Сывороточная концентрация, составляющая примерно 94% средней стационарной, достигается за время, равное 4Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полного удаления вещества из организма, и рассчитать интервал между введениями (см. ниже).
Стационарное состояние [ править | править код ]
Согласно уравнению 1.1, если вещество вводится путем инфузии с постоянной скоростью, в стационарном состоянии скорость поступления вещества (скорость инфузии) равна скорости его элиминации (произведение клиренса на сывороточную концентрацию препарата — уравнение 1.3). Уравнение 1.1 можно применять и при дробном введении (например, 250 мг каждые 8 ч): в этом случае также устанавливается стационарная сывороточная концентрация препарата, но в промежутках между введениями она колеблется от минимальной до максимальной (рис. 1.5).
Описание к рис. 1.5. Динамика сывороточной концентрации лекарственного средства при дробном введении. Серая кривая описывает накопление препарата при введении с интервалами, равными Т1/2, при условии, что скорость всасывания в 10 раз больше скорости элиминации. При увеличении скорости всасывания максимальная концентрация в стационарном состоянии стремится к 2, а минимальная — к 1. Черная кривая отражает динамику сывороточной концентрации препарата, который вводят в эквивалентной дозе путем инфузии. Обе кривые соответствуют однокамерной фармакокинетической модели. Средняя концентрация в стационарном состоянии вычисляется по уравнению:
Cсредн=F x Доза / (Cl x T)
Это уравнение можно получить путем замены в уравнении 1.1 скорости поступления вещества на выражение F х Доза / Т. Ссредн соответствует концентрации препарата в стационарном состоянии при введении путем инфузии.
Мидазолам: возможности и перспективы использования в интенсивной терапии
Одним из компонентов общей анестезии является седация,которая достигается введением препаратов различных фармакологических групп, это производные барбитуровой кислоты, бензодиазепины и другие.
К бензодиазепинам относятся лекарственные средства с 5-арил?1,4-бензодиазепиновой структурой, которая появилась в результате объединения бензольного кольца в семичленное диазепиновое[1]. Первый бензодиазепин (хлордиазопексид) был синтезирован в 1956 году, диазепам — первый из группы препарат для внутривенного введения — в 1960-е годы.
Все свои фармакологические эффекты бензодиазепины проявляют путем облегчения действия гаммааминомасляной кислоты (ГАМК) — главного ингибирующего нейтротрансмиттера в центральной нервной системе (ЦНС), уравновешивающего влияние активирующих нейротрансмиттеров, что приводит к ингибированию функциональной активности клеток ЦНС и угнетению нейрональной передачи в структурах ЦНС.
В настоящее время синтезированы тысячи различных бензодиазепинов, около 30 из которых применяются в клинической практике.
В зависимости от периода полувыведения все бензодиазепины делят на три группы. К препаратам длительного действия с периодом элиминации более суток относятся диазепам, мезапам,нитразепам. Среднюю длительность элиминации (5–24 часа) имеют нозепам и флунитразепам. Коротким периодом полувыведения (менее 5 часов) обладает препарат последней генерации этого класса мидазолам. Мидазолам находит все большее применение в анестезиологии в связи со значительно большей управляемостью, чем диазепам[2].
Мидазолам (8-хлор?6-(2-фторфенил)-1-метил?4H-имидазо[1,5-a][1,4]бензодиазепин в виде гидрохлорида (C 18H13ClFN 3 синтезирован в 1976 году.
Препарат»Мидазолам» (ФГУП»Московский эндокринный завод», Россия) представляет собой воспроизведенный препарат, активным компонентом которого является мидазолам (в форме гидрохлорида).
Мидазолам содержит имидазольное кольцо, которое отличает его от классических бензодиазепинов. Имидазольное кольцо мидазолама придает ему стабильность в растворе,обеспечивает быстрый метаболизм, наибольшую липофильность, а также растворимость в воде при низком значении pH. Основность мидазолама позволяет получать соли (например, гидрохлодрид, малеат, лактат) с хорошей растворимостью в воде. Мидазолам специально готовится в кислотном буфере с pH 3,5, так как раскрытие имидазольного кольца зависит от pH: при pH 4 (физиологические значение) кольцо закрывается и лекарственное средство становится
жирорастворимым — одним из наиболее липофильных бензодиазепинов[3].
Внутривенное и внутримышечное введение растворов мидазолама практически безболезненно и не сопряжено с местными реакциями.
Метильная группа в первой позиции имидазольного кольца обеспечивает небольшую продолжительность действия мидазолама. Эта группа быстро окисляется оксидазами печени, значительно быстрее, чем метиленовая группа в четвертой позиции диазепинового кольца, которая является мишенью для печеночных ферментов в классических бензодиазепинах.
Фармакокинетика
На фоне внутримышечного введения уровень абсорбции мидазолама составляет 80–100 %. Высокая липофильность мидазолама определяет относительно большой объем его распределения, который больше у женщин, чем у мужчин. Возраст на объем распределения мидазолама существенно не влияет. При избыточной массе тела объем распределения увеличивается, также удлиняется период полуэлиминации бензодиазепина при неизмененном клиренсе[4]. Период полуэлиминации 1-гидроксимидазолама составляет приблизительно 70 минут[4].
Мидазолам активно связывается с белками плазмы, лишь 4 % остаются в несвязанном виде. В связи с высокой липофильностью и преимущественной связью с альбумином мидазолам проникает через гистогематические барьеры: гематоэнцефалический и планцентарный, а также в грудное молоко. В эксперименте равновесие между плазменной концентрацией мидазолама и его содержанием в спинномозговой жидкости достигается в течение нескольких минут[4]. Мидазолам проникает через плаценту хуже, чем диазепам[6].
Период полувыведения мидазолама не зависит от способа его введения и составляет в среднем 1,5–3,5 часа. Большие операции способствуют увеличению объема распределения и удлиняют период полувыведения[4].
Основные фармакокинетические параметры мидазолама приведены в табл. 1.
| Параметр | Значение |
| Клиренс, мл/мин. | 350–500 |
| Клиренс, мл/кг/мин. | 6,4–11,0 |
| Vdss, л/кг | 0,7–1,7 |
| Период полураспределения, t1/2α, мин. | 25–30 |
| Период полувыведения, t1/2β, час. | 1,5–3,0 |
| Период полувыведения 1-гидроксимидазолама, час. | 1,5–3,0 |
| Связь с белками,% | 96 |
| Биодоступность при внутримышечно введении,% | 90 |
| tmax, мин. | 30 |
Быстрое распределение и ускоренный по сравнению с другими бензодиазепинами метаболизм объясняют особенности фармакодинамики мидазолама: быстрое начало действия,но короткая его продолжительность при болюсном введении. После внутривенного введения препарата здоровым добровольцам снижение его концентрации проходит в две фазы: начальная, быстрая, связана с распределением; вторая, медленная, зависит главным образом от метаболизма.
Первый этап метаболизма мидазолама заключается в его быстром окислении под действием CYP3A4 и CYP3A5 печени. Основным продуктом является 1-гидроксимидазолам (1-гидроксиметилмидазолам, α-гидроксимидазолам). Параллельно образуются небольшие количества 4-гидроксимидазолама и еще меньшие 1,4-дигидроксимидазолама. Оба основных продукта быстро конъюгируют с глюкуроновой кислотой и экскретируются с мочой в форме глюкуронидов (60–80 % от введенной дозы). Менее 1 % выводится в неизменном виде с мочой.
Метаболиты циркулируют также в крови в неконъюгированном виде. Они обладают фармакологической активностью[5]. Активность 1-гидроксимидазолама сопоставима с таковой неизмененного мидазолама и в высоких концентрациях может вносить значимый вклад в действие препарата. Эффект 4-гидроксимидазолама клинически не значим.
Доказано также наличие способности у мидазолама подвергаться внепеченочному метаболизму. Так, в рамках исследования образование метаболитов продолжалось при внутривенном введении мидазолама во время трансплантации печени в беспеченочном периоде[5].
Зависимость фармакокинетики от возраста пациентов
По данным ряда исследователей, у пожилых лиц снижается клиренс мидазолама и увеличивается период его полувыведения по сравнению с молодыми[5]. Возраст также влияет на фармакодинамику мидазолама. У больных старше 70 лет тот же уровень седации обеспечивается при меньших концентрациях, чем у более молодых пациентов (моложе 60 лет). Таким образом, при неизменном фармакокинетическом профиле мидазолама с возрастом возрастает чувствительность к его эффектам, что
необходимо учитывать при подборе доз у пожилых и молодых пациентов (во избежание избыточной и недостаточной седации соответственно).
Как и для большинства других препаратов, фармакокинетика мидазолама у детей во многом отличается от фармакокинетики у взрослых. У детей младше 6 месяцев удлиняется t1/2β и снижается клиренс мидазолама. Вероятно, такое отличие является следствием незрелости микросомальной системы печени у детей в возрасте до 6 месяцев[8].
Биодоступность внутримышечно вводимого мидазолама у детей не отличается от показателя у взрослых (90 %), биодоступность вводимого per os препарата в связи с эффектом первого прохождения через печень снижается до 27 %[8].
Фармакокинетика у пациентов с нарушениями почечных функций
У пациентов с почечной недостаточностью отмечается повышение свободной фракции мидазолама (6,5 %) по сравнению со здоровыми добровольцами (3,9 %)[5]. В то же время скоррегированный по уровню связи с белками показатель клиренса свободного мидазолама не отличается у лиц с хронической почечной недостаточностью и без почечной недостаточности.
Глюкуронид α-гидроксимидазолама — метаболит, накапливающийся у больных с почечной недостаточностью, вероятно, приводит к наблюдающейся у таких больных избыточной седации, что подтверждают ряд исследований.
Мидазолам и его неконъюгированный метаболит α-гидроксимидазолам не элиминируются в ходе гемодиализа, а конъюгированный α-гидроксимидазолам выводится. Сложно предсказать ответ на мидазолам у пациентов, находящихся на гемодиализе, так как и неизмененная субстанция и ее конъюгированный метаболит обладают фармакологической активностью.
Фармакокинетика у пациентов с нарушениями печеночных функций
Период полувыведения у пациентов с циррозом печени существенно увеличен (в среднем 2,89 часа) по сравнению с лицами без цирроза (в среднем 1,65 часа). Сниженный печеночный метаболизм и, как следствие, уменьшенный клиренс мидазолама у тяжелыхреанимационных пациентов требуют титрования дозы мидазолама во избежание избыточной седации[5].
Мидазолам как и другие препараты, производные бензодиазепинов, обладает снотворным, анксиолитическим, миорелаксирующим, противосудорожным действиями, вызывает антеградную амнезию.
Фармакодинамика
Седативный и снотворный эффекты
В ходе ряда исследований был доказан снотворный эффект мидазолама, причем не отмечено четкой дозозависимости эффекта, и максимум его достигался в первую треть ночи[5]. Установлено, что мидазолам увеличивает время до начала стадии сна —быстрого движения глаз (rapid eye movement), однако продолжительность этой стадии существенно не меняется[5]. Описана рикошетная бессонница после прекращения приема мидазолама в дозе 20 или 30 мг, но не 10 мг. Рикошетные бессонница и тревожность после отмены бензодиазепинов, в том числе мидазолама, — нередкое явление. Возможно развитие толерантности к снотворному эффекту. Краткосрочность действия не позволяет рассматривать мидазолам в качестве перспективного снотворного, однако быстрое наступление эффекта и небольшая его продолжительность полезные свойства для предоперационной седации. Так же как и в случае с другими препаратами с быстрым метаболизмом, развитие толерантности к действию мидазолама не позволяет его использовать для купирования длительно протекающих тревоги и нарушений сна. В то же время отсутствие локальных нежелательных эффектов при внутривенном введении, быстрое наступление снотворного эффекта и небольшая его продолжительность, а также антероградная амнезия делают мидазолам препаратом выбора для проведения быстрых диагностических и лечебных манипуляций (эндоскопия, стоматология)[5].
Влияние на психомоторные функции
При оценке психомоторных функций в рамках клинических исследований отмечено значительное снижение психомоторных функций через 1 час после приема мидазолама per os изолированно или в комбинации с алкоголем. Ежеденевный прием мидазолама в дозе 20 мг на ночь в течение четырех дней ассоциировался со снижением психомоторных функций спустя 10 часов после последнего приема. В то же время эффект был менее выраженным в сравнении с таковым на фоне приема флуразепама в дозе 30 мг. После внутривенного введения мидазолама в дозе 0,07–0,15 мг/кг здоровым субъектам психомоторные функции восстанавливались через 3 часа [5].
Влияние на память
Уже в ходе первых исследований мидазолама было показано, что он вызывает антероградную амнезию. Так, максимальная выраженность указанного эффекта наблюдается в период от 2 до 5 минут после инъекции. При анализе частоты развития и длительности антероградной амнезии после внутривенного введения эквивалентных доз различных бензодиазепинов обращают на себя внимание одинаковый профиль действия мидазолама и диазепама (более короткая продолжительность эффекта мидазолама) и отличный от них эффект лоразепама — медленное начало, но большая продолжительность действия. Ни один из препаратов не вызывает ретроградной амнезии.
Кратковременная антероградная амнезия — полезное свойство мидазолама, используемое при диагностических процедурах и в стоматологической практике. Пациенты забывают неприятные ощущения, возникающие, например, во время введения эндоскопа или введения местных анестетиков, а быстрое восстановление позволяет поддерживать адекватное самостоятельное дыхание и прочие физиологические функции при дальнейших манипуляциях.
Сердечно-сосудистые эффекты
Бензодиазепины, предназначенные для инъекционного введения, за исключением флунтиразепама, оказывают минимальное действие на функции сердечно-сосудистой системы. Это утверждение справедливо и для мидазолама. Мидазолам снижает периферическое сосудистое сопротивление у пациентов с ишемической болезнью сердца (ИБС). Эффект особенно заметен у лиц с исходно повышенным сопротивлением, например, на фоне артериальной гипертензии или при эмоциональном напряжении перед планируемым оперативным вмешательством. Депонирование крови в венах и снижение периферического сосудистого сопротивления под действием мидазолама способны уменьшить пред и постнагрузку на сердце, что потенциально может улучшить функции сердца при сердечной недостаточности.
В рамках ряда клинических исследований проводилась сравнительная оценка влияния мидазолама и диазепама на параметры сердечно-сосудстой системы у пациентов с ИБС. Оба бензодиазепина оказывали минимальные эффекты при индукции анестезии для проведения аортокоронарного шунтирования (АКШ). В условиях искусственного кровообращения диазепам индуцировал более выраженные вено и артериолодилатацию.
У пациентов на фоне премедикации индукция анестезии мидазоламом ассоциируется с менее выраженными изменениями частоты сердечных сокращений (ЧСС) и среднего артериального давления (АД), чем при индукции тиопенталом, а также обеспечивает меньший ответ на интубацию трахеи у больных перед оперативным лечением ИБС. Болюсное введение мидазолама (в отличие от тиопентала) не влияет на его гемодинамические эффекты.
В исследовании Forster et al. отмечалось снижение скорости мозгового кровотока у находящихся в сознании здоровых добровольцев на фоне введения мидазолама. У пациентов в состоянии наркоза несколько снижается мозговое перфузионное давление вследствие снижения среднего АД в аорте. У больных с опухолями мозга мидазолам в дозе 0,32 мг/кг внутривенно не снижал внутричерепного давления. Мидазолам снижает почечный кровоток.
Влияние на респираторные функции
Мидазолам при приеме внутрь в терапевтических дозах не приводит к каким-либо нарушениям дыхания у здоровых субъектов. Действие мидазолама на дыхательную систему в высоких дозах реализуется через два механизма. Во-первых, его влияние на мышечный тонус приводит к риску обструкции верхних дыхательных путей, поэтому бензодиазепины не рекомендуются, а по мнению отдельных экспертов, даже противопоказаны лицам с синдром обструктивного апноэ во сне. Во-вторых, с утратой сознания при введении мидазолама падает чувствительность к повышению уровня углекислого газа. Мидазолам подавляет дыхательный центр, хотя и периферические эффекты исключить нельзя. При совместном назначении мидазолама с опиоидами резко увеличивается риск угнетения дыхания. Важный механизм угнетения дыхания на фоне введения мидазолама — подавление реакции на гипоксемию в условиях гиперкапнии. У больных, страдающих хроническими обструктивными заболеваниями легких, угнетение дыхания под действием мидазолама более выражено и продолжается дольше, чем у здоровых субъектов. В связи с этим особое внимание требуется при применении препарата у пациентов с хроническими обструктивными заболеваниями легких[2].
В терапевтических дозах (0,1 мг/ кг) внутривенное введение мидазолама приводит к снижению дыхательного объема, что компенсируется увеличением частоты дыхания (ЧД), в результате минутный объем остается неизменным. При этом повышение ЧД обеспечивается за счет укорочения выдоха; длительность вдоха не меняется. Под действием мидазолама не меняются функциональная остаточная емкость и остаточный объем легких. В противоположность средствам для наркоза мидазолам уве-
личивает статическую податливость легких, что уменьшает нагрузку на грудную клетку, а также уменьшается участие
в дыхании брюшных мышц[7].
Влияние на функции вегетативной нервной и эндокринной систем
Бензодиазепины уменьшают реакцию на физиологический, так и на психологический стресс[5].
В сравнительном исследовании, проводившемся Croizer et al. с целью оценки гормональных изменений на фоне индукции этомидатом, мидазоламом или метогекситалом, у пациентов, подвергавшихся малоинвазивным ортопедическим вмешательствам,
выявлено, что уровни адреналина и норадреналина до вмешательства были сопоставимы у больных всех трех групп. К концу операции уровни катехоламинов значимо возросли у пациентов всех трех групп, однако в группе мидазолама степень повышения оказалась минимальной. Снижение уровня кортизола и альдостерона как на фоне введения этомидата, так и мидазолама было сопоставимым. Ответ на введение аденокортикотропного гормона (АКТГ) в группе мидазолама был значительно более выраженным, чем в группе этомидата. В результате нарушения механизма обратной связи уровень эндогенного АКТГ повышался в группе этомидата. Мидазолам не приводит к такому подавлению функции коры надпочечников в послеоперационном периоде.
Мидазолам при интратекальном введени обладает обезболивающим эффектом, что подтверждается снижением потребности в энфлуране и диаморфине во время хирургических вмешательств на органах брюшной полости.
Лекарственные взаимодействия
Фармакокинетические взаимодействия
Мидазолам подвергается метаболической биотрансформации с участием преимущественно цитохрома Р450 (CYP3A4) [4, 5]. Таким образом, лекарственные средства, обладающие способностью так или иначе изменять активность CYP3A4, могут потенциально оказывать влияние на метаболический профиль и, как следствие, на клинические эффекты мидазолама. Так, ингибиторы CYP3A4, такие как эритромицин, флуконазол, итраконазол, саквинавир и вориконазол, уменьшают клиренс мидозалама в условиях его внутривенного введения у здоровых добровольцев на 50–70 %. Таким образом, при длительной инфузии концентрация мидазолама на фоне приема сильных ингибиторов CYP3A4 должна увеличиваться в 3–4 раза и может приводить к незапланированному углублению седации и увеличению ее продолжительности. Пропофол и внутривенные гипнотики, используемые для индукции и поддержания наркоза, также снижают клиренс вводимого внутривенно мидазолама на 37 % за счет ингибирования цитохрома CYP3A4 в печени. Фентанил снижает клиренс мидазолама на 30 %.
К ингибиторам CYP3A4 также относятся такие препараты, как блокаторы кальциевых каналов дилтиазем и верапамил, блокаторы H2-гистаминовых рецепторов циметидин и ранитидин. В многочисленных исследованих доказано их влияние на фармакодинамику и фармакокинетику мидазолама.
Индукторы CYP3A4 приводят к резкому ускорению метаболизма мидазолама, что уменьшает его концентрацию и выраженность эффекта. К индукторам CYP3A4 относят рифампин, карбамазепин и фенитоин. Они ускоряют метаболизм мидазолама и, как следствие, снижают фармакологический эффект мидазолама.
Влияние на метаболизм мидазолама и, соответственно, на его фармакодинамику, могут оказывать и другие препараты, подавляющие или активирующие CYP3A4. Согласно базе данных Drugs.com, возможность лекарственных взаимодействий с мидазоламом описана для 1 682 лекарственных средств. Зз них 82 оказывают значимое влияние на эффект мидазолама, 1 392 — умеренное и небольшое — 208. К препаратам, оказывающим значимое влияние, относят противовирусные средства (атазанавир, дарунавир, эфавиренз, тенофовир, фосампренавир, индинавир, саквинавир), противогрибковые препараты (флуконазол, итраконазол, кетоконазол, позаконазол, вориконазол), анальгетики (оксибат натрия) и антипсихотики (клозапин, дроперидол, оланзапин).
Фармакодинамические взаимодействия
Клиническая значимость фармакодинамических взаимодействий мидазолама существенно больше фармакокинетических. Многие из них предсказуемы и могут быть предотвращены благодаря рациональному подходу к комбинированию препаратов. В то же время в ряде случаев фармакодинамические взаимодействия различных лекарственных средств с мидазоламом оказываются полезными в клинике. Так, очевидно, что сочетание препаратов с одинаковым действием позволяет снизить дозу каждого из них и, таким образом, добиться необходимого результата при меньшем количестве нежелательных эффектов.
По данным Hong et al., взаимодействие мидазолама и кетамина проявляется в суммировании их эффектов (аддитивный эффект). При сочетании мидазолама и тиопентала, а также пропофола и мидазолама отмечается синергизм (потенцированный), что,
вероятно, обусловлено их способностью к различным изменениям конформации ГАМК-рецепторного комплекса.
Флумазенил — антагонист бензодиазепинов, связывается с бензодиазепиновым рецептором и, не обладая собственной фармакологической активностью, блокирует все эффекты бензодиазепиновых агонистов, в том числе мидазолама. Дозы флумазенила в пределах 0,3–2,0 мг достаточно для уменьшения выраженности или полного устранения фармакологических эффектов бензодиазепинов при их передозировке[7].
Безопасность
Местные нежелательные эффекты
Боль в месте инъекции и постинъекционный тромбофлебит — частое осложнение, возникающее на фоне внутривенного введения бензодиазепинов (диазепама, лоразепама, флунитразепама)[1]. Растворимость в воде в кислой среде позволяет получать водные растворы мидазолама, что приводит к снижению частоты тромбофлебитов после внутривенного введения мидазолама (от 3 до 10 %)[4].
При интраназальном применении мидазолама (удобный способ введения препаратов в педиатрии) могут возникать жжение в носу, раздражение, слезотечение. После ингаляций мидазолама через небулайзер у 2 из 10 пациентов отмечался бронхоспазм, что связывалось с действием не самого препарата, а кислой pH его раствора[4].
Системные нежелательные эффекты
Мидазолам в монотерапии не дает значимых респираторных эффектов. Введение комбинации мидазолама и фентанила ассоциируется с гиповентиляцией в 90 % случаев[7]. Индуцированное мидазоламом угнетение дыхания может зависеть от скорости инфузии препарата: быстрое введение сопровождается большей частотой развития брадипноэ. Мидазолам уже в дозе 0,01 мг/кг снижает чувствительность к гипоксии и гиперкапнии[5].
Arcos et al. сообщили о трех случаях желудочковой бигемении и тригемении, а также желудочковой тахикардии после премедикации, включавшей внутримышечное введение мидазолама. Все аритмии спонтанно прекратились в пределах 2–4 часов
после введения мидазолама[4].
Yakel et al. описали случай ангионевротического отека и бронхоспазма после повторных внутривенных введений мидазолама. Fujita et al. также сообщили об анафилактоидной реакции на мидазолам.
Описаны также парадоксальные реакции на бензодиазепины, проявляющиеся враждебностью, агрессией, гневливостью. Случаи психоэмоционального возбуждения в ответ на введение мидазолама описаны как у взрослых, так и у детей[1]. Механизм возникновения делириозных состояний в ответ на введение мидазолама не ясен.
После прекращения длительной (более нескольких дней) инфузии мидазолама возможно появление синдрома отмены, включая развитие судорожных припадков.
Длительная антероградная амнезия — нередкое осложнение на фоне лечения мидазоламом. После премедикации бензодиазепинами, в том числе мидазоламом, отмечается замедленное восстановление когнитивных функций.
Мидазолам может индуцировать прочие менее клинически значимые нежелательные эффекты. К ним относятся икота, кашель, тошнота и рвота[1].
Применение мидазолама во время беременности и кормления грудью
Wilson et al. установили, что метаболизм мидазолама меняется в период беременности и особенно сильно во время родов. Возможно, увеличение связи с белками может вести к снижению объема распределения и клиренса препарата. Период полувыведения мидазолама у беременных составляет приблизительно 1 час[6]. Мидазолам обладает способностью к пенетрации
плацентарного барьера, однако уровень препарата в циркуляторном русле плода ниже, чем у матери [6]. Введение мидазолама непосредственно перед выполнением кесарева сечения или в ходе первого периода родов приводит к нарушению сердечного ритма плода, гипотонии, нарушению сосания, гипотермии и умеренному угнетению дыхания у новорожденных.
Так как мидазолам в небольших количествах проникает в грудное молоко, кормящим матерям следует прерывать кормление грудью на 24 часа.
Исследований по оценке безопасности мидазолама в первом триместре беременности или сообщений о пороках развития плода или новорожденного в литературе найти не удалось.
Клиническое применение (показания) у детей и у взрослых
Основное клиническое применение мидазолама — седация перед диагностическими или лечебными процедурами, а также во время их проведения. Мидазолам используют для премедикации, индукции и в качестве седативного компонента при комбинированной анестезии.
Мидазолам используется для седации в условиях интенсивной терапии, перед эндоскопическими исследованиями (фиброгастродуаденоскопия, колоноскопия, бронхоскопия), в стоматологической практике для купирования психомоторного возбуждения.
Cole et al. сравнили эффективность и безопасность применения диазепама и мидазолама у пациентов перед эндоскопическими вмешательствами. Мидазолам действовал быстрее и сильнее, чем диазепам — седация наступала в среднем через 2,5 минуты после введения, также отмечалось более быстрое прекращение эффекта. У больных, получавших мидазолам, отмечалось меньше побочных эффектов, включая меньшую степень угнетения дыхания. В исследовании Coughlin et al. по оценке эффективности и безопасности назначаемых внутривенно мидазолама и диазепама в челюстно-лицевой хирургии длительность седации достоверно не различалась, однако наблюдались клинически значимые отличия по частоте болей в области инъекции (32 % в группе диазепама против 6 % в группе мидазолама). Выраженность амнезии была большей в группе мидазолама.
Мидазолам эффективен для купирования судорог и рефрактерного эпилептического статуса при внутривенном и внутримышечном введениях. Мидазолам также эффективно применяется при мышечных спазмах в отделениях неотложной помощи, а также в качестве препарата для быстрой седации у пациентов перед интубацией трахеи.
Мидазолам может назначаться внутривенно, внутримышечно, внутрь, ректально и интраназально, что облегчает его использование в педиатрической практике, в интенсивной терапии. Дозировки и способы введения мидазолама подбираются индивидуально до достижения нужной выраженности эффекта, соответствующего клинической потребности, физическому состоянию и возрасту больного, а также сопутствующей медикаментозной терапии.
Основными противопоказаниями к использованию мидазолама являются повышенная чувствительность к бензодиазепинам или компонентам препарата, тяжелая дыхательная недостаточность, закрытоугольная глаукома, период родов.
Таким образом, применение мидазолама в практике анестезиологов-реаниматологов позволяет обеспечить главные принципы современной анестезиологии — безопасность и адекватность анестезии. А уникальная структура мидазолама обусловливает его
выгодные, с точки зрения клинициста, отличия от других бензодиазепинов [3]:
• высокую афинность к бензодиазепиновым рецепторам;
• водорастворимость солей, что позволяет готовить стабильные очищенные водные растворы, введение которых хорошо переносится больным;
• быстрое начало и короткую продолжительность действия за счет быстрого метаболизма.
Список литературы
1. Рациональная фармакоанестезиология: Рук. для практикующих врачей / Под общ. ред. А. А. Бунятяна, В. М. Мизикова. — М.:
«Литера», 2006. — 800 с.
2. Сумин С. А., Руденко М. В., Бородинов И. М. Анестезиология и реаниматология: Учебное пособие в 2 томах. Т.I. — М.:
ООО»Медицинское информационное агенство», 2010. — 928 с.: ил.
3. Gerecke M. Chemical structure and properties
of midazolam compared with other benzodiazepines. Br J Clin Pharmacol. 1983; 16 Suppl 1: 11S?16S.
4. Greenblatt DJ, Abernethy DR, Locniskar A, Harmatz JS et al. Effect of age, gender, and obesity on midazolam kinetics. Anesthesiology. 1984 Jul; 61 (1): 27–35.
5. Mandema JW1, Tuk B, van Steveninck AL, Breimer DD et al. Pharmacokinetic pharmacodynamicmodeling of the central nervous system effects of midazolam and its main metabolite alpha-hydroxymidazolam in healthy volunteers. Clin Pharmacol Ther. 1992 Jun; 51 (6): 715–28.
6. Kanto J, Sjovall S, Erkkola R, Himberg JJ et al. Placental transfer and maternal midazolam kinetics. Clin Pharmacol Ther. 1983 Jun; 33 (6): 786–91.
7. Ramoska EA, Linkenheimer R, Glasgow C. Midazolam use in the emergency department. J Emerg Med. 1991; 9: 247–51. 8. Blumer JL. Clinical pharmacology of midazolam in infants and children. Clin Pharmacokinet. 1998 Jul; 35 (1): 37–47.
В настройках компонента не выбран ни один тип комментариев