Что такое полярность растворителя
Разница между полярными и неполярными растворителями
В ключевое отличие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные сое
Содержание:
В ключевое отличие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.
Полярность соединения означает свойство иметь полюса. В химии это разделение зарядов в молекуле, которая имеет атомы или группы атомов с разной электроотрицательностью. Таким образом, это приводит к частичному положительному заряду и частичному отрицательному заряду в одном и том же соединении.
Что такое полярные растворители?
Полярность растворителя возникает из-за связи атомов с разными значениями электроотрицательности с образованием молекулы. Здесь более электроотрицательный атом притягивает пары электронов связи, что в конечном итоге дает менее электроотрицательному атому частичный положительный заряд из-за уменьшения электронной плотности вокруг себя. С другой стороны, более электроотрицательный атом получает частичный отрицательный заряд, поскольку электронная плотность вокруг этого атома увеличивается.
Кроме того, мы можем разделить полярные растворители на две группы: полярные протонные растворители и полярные апротонные растворители. Полярные протонные растворители содержат лабильный H + ионы. Это означает, что молекулы этих растворителей могут отдавать атомы водорода. Однако полярные апротонные растворители не могут отдавать атомы водорода.
Что такое неполярные растворители?
Неполярные растворители могут растворять неполярные соединения за счет сил притяжения, таких как силы Ван-дер-Вааль. Некоторые примеры неполярных растворителей включают пентан, гексан, бензол, толуол и т. Д.
В чем разница между полярными и неполярными растворителями?
В основном мы можем разделить растворители на две категории: полярные растворители и неполярные растворители. Ключевое различие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.Кроме того, еще одно существенное различие между полярными и неполярными растворителями заключается в том, что полярные растворители имеют высокий дипольный момент, в то время как неполярные растворители не имеют дипольного момента. Типичным примером полярного растворителя является вода. Некоторые примеры неполярных растворителей включают пентан, гексан, бензол, толуол и т. Д.
Более того, полярные растворители имеют молекулы с полярными связями (эти связи показывают разделение электрических зарядов из-за различий в электроотрицательности атомов в связи). У неполярных растворителей есть молекулы, содержащие химические связи, состоящие из атомов, имеющих почти одинаковые значения электроотрицательности.
Мы можем разделить растворители в основном на две категории: полярные растворители и неполярные растворители. Ключевое различие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.
Растворитель
Во франкоязычной Швейцарии и Бельгии английский термин « разбавитель» используется для обозначения органических растворителей, предназначенных для разбавления красок.
Резюме
Общий
Для жидких растворов (однородная жидкая фаза, содержащая несколько химических соединений ), если одна из разновидностей в значительной степени составляет большинство (по крайней мере, в 100 раз), это называется «растворителем». Так обстоит дело с водой для водных растворов (например, водный раствор сульфата меди : вода является растворителем, а ионы сульфата и меди (II) являются растворенными веществами).
Как правило, атомы или молекулы одной природы собираются в жидкость или твердое тело ( кристалл или аморфное твердое тело). В случае раствора растворитель предотвращает соединение атомов или молекул, он их диспергирует. В случае воды это происходит в соответствии с двумя явлениями:
Классификация
По их полярности
В следующей таблице сравниваются эти разные семейства:
| Растворители | Диэлектрическая постоянная | Диполярный момент | Атомы водорода | Водородные связи | Ионизирующая мощность | Сольватационная сила | Влияние на органические реакции |
|---|---|---|---|---|---|---|---|
| Аполярные апротики | Низкий | Низкий | Все они связаны с атомами углерода. | Нет | Низкий | Низкий | |
| Полярные апротики | Высокая | Высокая | Все они связаны с атомами углерода. | Только акцептант | Очень хорошо сольватировать катионы и мало анионов | Продвижение механизмов SN2 над SN1 и способствовать замене по устранению | |
| Полярные протики | Высокая | Высокая | По крайней мере, один связан с гетероатомом | Акцептор и донор | Ученик | Ученик | Отдавайте предпочтение механизмам SN1 по сравнению с SN2 |
По химической природе
Органические растворители содержат атомы углерода. Они делятся на три семейства:
По их нагрузке
По своему происхождению
Важно указать, что происхождение растворителя не влияет на его токсичность ; Растворитель на агро-основе может быть вредным для человека или окружающей среды (в случае фурфуролдегида ).
Физические свойства обычных растворителей
Приведенные ниже растворители сгруппированы в неполярные, апротонные полярные и протонные полярные растворители, классифицируемые по возрастающей полярности.
Растворение
Кислотное растворение
Растворение в стакане
При высокой температуре (выше 2000 ° C ) стекло ( диоксид кремния SiO 2 ) жидкий. Таким образом, в нем может быть растворено определенное количество продуктов, которые сами по себе являются твердыми при этой температуре.
Хотя это происходит при высокой температуре и с другим растворителем, принцип аналогичен растворению в воде (диспергирование, сольватация, растворение кислоты).
Альтернативные растворители
Ионные жидкости классифицируются как зеленые растворители из-за их нелетучести. Однако остается много сомнений в токсичности этих соединений. Наиболее изученными ионными жидкостями являются производные имидазолия, но их доказанная токсичность заставляет ученых обращаться к менее токсичным структурам, которые иногда могут быть получены даже из возобновляемых источников. Это, например, случай с ацетатом холина.
Использует
Токсичность
Таким образом, несколько типов простых эфиров гликоля были причастны к серьезным случаям рака ; девять были классифицированы как репротоксичные (опасные для плодов беременных).
Какой растворитель самый полярный?
Кроме того, полярная вода апротична?
Протический против Апротический Растворители. Полярный протик растворители воды, этанол, метанол, аммиак, уксусная кислота и другие. Полярный апротический растворители не содержат атомов водорода, непосредственно связанных с электроотрицательным атомом, и они не способны образовывать водородные связи.
Таким образом, что является примером неполярного растворителя? Неполярные растворители липофильны, поскольку растворяются неполярный такие вещества, как масла, жиры, смазки. Примеры of неполярные растворители: четыреххлористый углерод (CCl4), бензол (C6H6) и диэтиловый эфир (CH3CH2OCH2CH3), гексан (CH3 (CH2) 4CH3), метиленхлорид (CH2Cl2).
Является ли спирт полярным растворителем?
Как правило, гидроксильная группа делает спиртыполярный. Эти группы могут образовывать водородные связи с одним другим и с большинством других соединений. Благодаря наличиюполярный ОН-спирты более растворимы в воде, чем простые углеводороды. Метанол, этанол, и пропанол смешиваются с водой.
Является ли спирт полярным растворителем?
Спирт этиловый как растворитель. Спирт этиловый очень полярный молекула из-за ее гидроксильной (ОН) группы, с высокой электроотрицательностью кислорода, позволяющей образовывать водородные связи с другими молекулами. Спирт этиловый поэтому привлекает полярный и ионные молекулы. Таким образом, этанол может растворить оба полярный и не-полярный веществ.
Бензол полярный или неполярный?
Мы могли бы сказать, что бензол is неполярныйпотому что это углеводород, который содержит только связи CC и CH, а углеводороды неполярный. Но C немного более электроотрицателен, чем H (на 0.35 единицы), поэтому связь CH очень незначительна. полярный и имеет небольшой дипольный момент.
Какие примеры полярных растворителей?
Что такое типичный неполярный растворитель?
A нет–полярный растворитель молекулы, имеющие примерно одинаковый электрический заряд со всех сторон; другими словами, он имеет низкую статическую диэлектрическую проницаемость. не–полярные растворители Он типично углеводороды, такие как пентан и гексан. не–полярные растворители используются для растворения других углеводородов, таких как масла, жиры и воски.
Этанол полярный или неполярный?
Спирт этиловый очень полярный молекула из-за своей гидроксильной (ОН) группы, с высокой электроотрицательностью кислорода, что позволяет образовывать водородные связи с другими молекулами. Фетил (C2H5) группа в этанол isнеполярный. Таким образом, этанол может растворить обаполярный и неполярный веществ.
Что такое типичный полярный растворитель?
Полярные растворители: вода, ацетон, этанол. Не-полярные растворители: гексан, бензол, толуол. Диэтиловый эфир представляет собой слегка полярный растворитель.
Ацетон полярный или неполярный?
Вода это полярный молекула, в то время как тетрахлорид углерода представляет собой неполярный молекула. Если мы воспользуемся концепцией «нравится, нравится, нравится», тогда ацетон это оба полярныйи неполярный. Этот двойственный характер ацетон Это связано с его способностью образовывать водородные связи с водой и наличием двух метильных групп.
Какие бывают типы растворителей?
| растворитель | Точка кипения, Цельсия | Диэлектрическая постоянная |
|---|---|---|
| Гексан, C6H14 | 69 | 1.9 |
| Бензол, C6H6 | 80 | 2.3 |
| Хлороформ, CHCl3 | 61 | 4.8 |
| Диэтиловый эфир, (CH3CH2)2O | 35 | 4.3 |
Что полярное, а что неполярное?
Полярный молекулы возникают, когда существует разница электроотрицательностей между связанными атомами. Неполярные молекулы возникают, когда электроны делятся равными между атомами двухатомной молекулы или когда полярный связи в более крупной молекуле нейтрализуют друг друга.
Гексан полярный или неполярный?
гексан is неполярный за счет связей C – H и симметричной геометрической структуры. Углерод и водород имеют разность электроотрицательностей 0.35, что классифицирует молекулу как неполярный.
Какие примеры полярных растворителей?
Почему полярный апротонный растворитель пользу SN2реакции вообще? Это так, потому что ДМСО стабилизирует разделение зарядов, связанное с переходным состоянием SN2реакция (1-ступенчатая бимолекулярная реакция). Другой полярный апротикирастворители также можно использовать с той же целью.
Какие примеры полярных растворителей?
Что такое полярный раствор?
Что это за растворитель THF?
Другое основное применение ТГФ как промышленный растворитель для поливинилхлорида (ПВХ) и лакокрасочных материалов. Это апротический растворитель с диэлектрической проницаемостью 7.6. Это умеренно полярный растворитель и может растворять широкий спектр неполярных и полярных химических соединений.
Что делает нуклеофил сильным?
Заряд. «Сопряженное основание всегда лучше.нуклеофил». HO- лучше нуклеофил чем H2O. Чем больше отрицательный заряд, тем больше вероятность, что атом отдаст свою пару электронов для образования связи.
Что такое полярное и неполярное соединение?
Полярные соединения Он соединений которые имеют небольшие заряды (слегка положительные и слегка отрицательные) в пределах соединение. Неполярные соединения Он соединений которые не имеют слегка отрицательных и положительных зарядов в пределах соединение. Различия электроотрицательности неполярные соединения находятся между 0 и. 2.
В химии существует общее правило для определения того, растворитель растворяет данное растворенное вещество, «подобное растворяется подобным». Растворители состоит из полярных молекул, таких как водырастворяют другие полярные молекулы, например поваренную соль, в то время как неполярные растворители, например, бензин, растворяются неполярный такие вещества, как воск.
Почему пентан неполярен?
Пентаны молекулярные, и, конечно же, они неполярный, и, следовательно, добавление n-пентан вода образует два несмешивающихся слоя с МЕНЬШЕ плотной пентан плавает в верхней части воронки. Пониженное поверхностное натяжение пентан, также можно объяснить отсутствием межмолекулярного взаимодействия.
Вода полярная?
Вода (H2О) полярный из-за изогнутой формы молекулы. Форма означает, что большая часть отрицательного заряда кислорода находится на стороне молекулы, а положительный заряд атомов водорода находится на другой стороне молекулы. Это пример полярный ковалентная химическая связь.
Вода полярная?
Полярный протонный растворители часто используются для растворения солей. В общем, эти растворители обладают высокими диэлектрическими постоянными и высокой полярностью. Примеры включают воду, большинство спиртов, муравьиную кислоту, фтороводород и аммиак.
Является ли уксус растворителем?
Sn1 или sn2 быстрее?
Затем он утверждает SN1 доходы быстрее чемSN2. BR, с другой стороны, говорит SN2 isбыстрее.
Вода полярная или неполярная?
Вода это «полярный”Молекулы, что означает неравномерное распределение электронной плотности. Водаимеет частичный отрицательный заряд () около атома кислорода из-за нераспределенных пар электронов и частичный положительный заряд () около атомов водорода.
Пропиленгликоль полярный или неполярный?
ДМФ является основным или кислым?
В химии существует общее правило для определения того, растворитель растворяет данное растворенное вещество, «подобное растворяется подобным». Растворители состоит из полярных молекул, таких как водырастворяют другие полярные молекулы, например поваренную соль, в то время как неполярные растворители, например, бензин, растворяются неполярный такие вещества, как воск.
Г. Полярность растворителя



Растворимость препарата в данном растворителе в значительной степени зависит от полярности растворителя. По диэлект- рической константе растворители классифицируют на полярные (е >50), полуполярные (е = 20-50) или неполярные (е = 1-20) (табл. 12.5).
Таблица 12.5.Диэлектрическая константа растворителей
| Растворитель | Диэлектрическая константа, е, 20 град.C |
| N-метилформамид | 190 |
| Вода | 80 |
| Раствор сорбитола (70%) | 62 |
| Сироп (64%) | 56 |
| Глицерин | 46 |
| Пропиленгликоль | 32,1 |
| Этанол | 25 |
| Полиэтиленгликоль 400 | 12,4 |
| Хлороформ | 5 |
| Касторовое масло | 4,6 |
| Эфир | 4,3 |
| Оливковое масло | 3,1 |
Полярные растворители растворяют соли или высокополярные (дипольные) молекулы. Неполярные растворители растворяют непо- лярные молекулы. Полуполярные растворители (спирты и кетоны) могут растворять и те и другие в зависимости от их свойств. Таким образом, в фармации существует универсальное правило выбора растворителя: «Подобное растворяется в подобном».
Существует 2 способа увеличения растворимости веществ в полуполярных растворителях:
1. Изменяя рН, чтобы изменять полярность вещества (соль или основание). Увеличение концентрации соли приводит к увеличению
2. Смешивая растворители различных полярностей, чтобы изменять полярность растворителя.
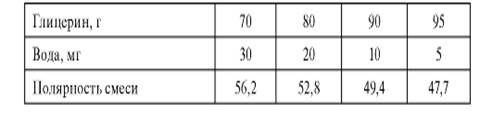
Пример 2
Заменить спирт на глицерин в составе раствора фурацилина 1:1500. Для определения диэлектрической константы растворителя готовят смеси этанола с водой. Затем готовят в данных смесях растворы, остав- ляют на ночь, наблюдая осаждение (табл. 12.6).
Таблица 12.6.Влияние спирта на осаждение фурацилина
| % v/v спирта | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Осаждение | + | + | + | + | + | + | — | — | — | — | — |
Смесь 95 г глицерина и 5 мл воды рекомендована для получения не содержащего спирта раствора фурацилина.
Лекция № 12.
Контрольные вопросы
1. Дайте определение растворам с точки зрения дисперсологической классификации.
2. Какие существуют методы получения воды очищенной?
3. Какие требования предъявляются к качеству воды очищенной?
4. Какие существуют требования к качеству воды для инъекций?
5. Какие существуют методы получения воды для инъекций?
6. Как хранят воду очищенную и воду для инъекций?
Тесты
1. Жидких. 2. Твердых. 3. Газообразных веществ в соответствующем растворителе
2. Истинные растворы низкомолекулярных веществ:
1. Проходят сквозь фильтр.
2. Проходят через диализирующую мембрану.
3. Не изменяют свойства при центрифугировании.
3.Способы получения воды очищенной:
1. Дистилляция. 2. Обратный осмос. 3. Ионный обмен.
4. Дистиллятор состоит из следующих основных блоков:
1. Охладитель (конденсатор). 2. Уравнитель. 3. Наполнитель.
4. Камера испарения (испаритель). 5. Электронагреватели. 6. Датчик уровня.
5. Ежедневно перед началом работы проводят пропаривание дистиллятора и трубопроводов при закрытых вентилях подачи воды в конденсатор в течение:
1. 5 мин. 2. 10 мин. 3. 15 мин. 4. 20 мин. 5. Затем 15-20 мин отбрасывают первые порции воды.
6. В аквадистилляторах для получения апирогенной воды АА-1 имеются сепараторы для:
1. Отделения механических включения.
2. Для удаления из пара капельножидкой фазы.
3. Для удаления микроорганизмов.
1. Воду для инъекций используют свежеприготовленную;
8. Пирогенными веществами называют продукты:
1. Жизнедеятельности микроорганизмов.
2. Распада микроорганизмов.
3. Погибшие микробные клетки.
4. Жизнеспособные микроорганизмы.
9. Пирогенные вещества разрушаются при:
1. Кипячении в течение 6 ч.
Г. Полярность растворителя
Растворимость препарата в данном растворителе в значительной степени зависит от полярности растворителя. По диэлект- рической константе растворители классифицируют на полярные (е >50), полуполярные (е = 20-50) или неполярные (е = 1-20) (табл. 12.5).
Таблица 12.5.Диэлектрическая константа растворителей
| Растворитель | Диэлектрическая константа, е, 20 град.C |
| N-метилформамид | |
| Вода | |
| Раствор сорбитола (70%) | |
| Сироп (64%) | |
| Глицерин | |
| Пропиленгликоль | 32,1 |
| Этанол | |
| Полиэтиленгликоль 400 | 12,4 |
| Хлороформ | |
| Касторовое масло | 4,6 |
| Эфир | 4,3 |
| Оливковое масло | 3,1 |
Полярные растворители растворяют соли или высокополярные (дипольные) молекулы. Неполярные растворители растворяют непо- лярные молекулы. Полуполярные растворители (спирты и кетоны) могут растворять и те и другие в зависимости от их свойств. Таким образом, в фармации существует универсальное правило выбора растворителя: «Подобное растворяется в подобном».
Существует 2 способа увеличения растворимости веществ в полуполярных растворителях:
1. Изменяя рН, чтобы изменять полярность вещества (соль или основание). Увеличение концентрации соли приводит к увеличению
2. Смешивая растворители различных полярностей, чтобы изменять полярность растворителя.
Пример 2
Заменить спирт на глицерин в составе раствора фурацилина 1:1500. Для определения диэлектрической константы растворителя готовят смеси этанола с водой. Затем готовят в данных смесях растворы, остав- ляют на ночь, наблюдая осаждение (табл. 12.6).
Таблица 12.6.Влияние спирта на осаждение фурацилина
| % v/v спирта | |||||||||||
| Осаждение | + | + | + | + | + | + | — | — | — | — | — |
Смесь 95 г глицерина и 5 мл воды рекомендована для получения не содержащего спирта раствора фурацилина.
Лекция № 12.
1. Дайте определение растворам с точки зрения дисперсологической классификации.
2. Какие существуют методы получения воды очищенной?
3. Какие требования предъявляются к качеству воды очищенной?
4. Какие существуют требования к качеству воды для инъекций?
5. Какие существуют методы получения воды для инъекций?
6. Как хранят воду очищенную и воду для инъекций?
Тесты
1. Жидких. 2. Твердых. 3. Газообразных веществ в соответствующем растворителе
2. Истинные растворы низкомолекулярных веществ:
1. Проходят сквозь фильтр.
2. Проходят через диализирующую мембрану.
3. Не изменяют свойства при центрифугировании.
3.Способы получения воды очищенной:
1. Дистилляция. 2. Обратный осмос. 3. Ионный обмен.
4. Дистиллятор состоит из следующих основных блоков:
1. Охладитель (конденсатор). 2. Уравнитель. 3. Наполнитель.
4. Камера испарения (испаритель). 5. Электронагреватели. 6. Датчик уровня.
5. Ежедневно перед началом работы проводят пропаривание дистиллятора и трубопроводов при закрытых вентилях подачи воды в конденсатор в течение:
1. 5 мин. 2. 10 мин. 3. 15 мин. 4. 20 мин. 5. Затем 15-20 мин отбрасывают первые порции воды.
6. В аквадистилляторах для получения апирогенной воды АА-1 имеются сепараторы для:
1. Отделения механических включения.
2. Для удаления из пара капельножидкой фазы.
3. Для удаления микроорганизмов.
1. Воду для инъекций используют свежеприготовленную;
8. Пирогенными веществами называют продукты:
1. Жизнедеятельности микроорганизмов.
2. Распада микроорганизмов.
3. Погибшие микробные клетки.
4. Жизнеспособные микроорганизмы.
9. Пирогенные вещества разрушаются при:
1. Кипячении в течение 6 ч.