Что такое полярный растворитель и неполярный
Растворитель – определение, виды и примеры
Определение растворителя
Растворитель является молекула который обладает способностью растворять другие молекулы, известные как растворенные вещества. Растворитель может быть твердым, жидким или газообразным. Молекулы растворителя работают, чтобы положить растворенное вещество молекулы друг от друга. В конечном итоге молекулы растворенного вещества равномерно распределяются по всему растворителю. Эта гомогенная смесь идеально ровная и не может быть разделена физически. Тепло или другой химический процесс должен быть применен к решение для разделения растворителя и растворенного вещества.
Типы растворителей
Молекулы вообще имеют два класса, полярные и неполярные. Полярные молекулы разделили электрические заряды на разных сторонах молекулы. Неполярные молекулы, хотя они могут колебаться в заряде, не несут статический заряд. Оба типа молекул могут действовать как растворители, как описано ниже.
Полярный Растворитель
Полярные растворители действуют через действия положительных и отрицательных концов каждого атома, взаимодействуя друг с другом и растворенным веществом. Полярный растворитель растворяет растворенное вещество электрическими зарядами, притягивающими различные части растворенного вещества. Полярные растворители могут растворять ионные соединения, такие как соль, притягивая противоположно заряженные молекулы. Отрицательная сторона молекул растворителя притягивает положительные ионы в соединении. Положительная сторона других молекул растворителя притягивает отрицательные ионы. Таким образом, ионы равномерно распределяются по всему растворителю.
Неполярный Растворитель
Неполярные растворители работают аналогично полярным растворителям. Неполярные молекулы, которые действуют как растворители, обычно являются спонтанными диполями, поскольку они иногда образуют противоположные электрические заряды между связями. Эти мгновенные электрические диполи приводят к тому, что соседние молекулы растворителя также образуют диполи. Эти мимолетные взаимодействия могут растворить другие неполярные соединения. Однако полярные соединения обычно имеют более сильное взаимодействие между собой, чем с мгновенными диполями неполярных молекул. Вот почему неполярные и полярные растворители, такие как вода и масло, не смешиваются.
Примеры Растворителя
Вода является наиболее важным биологическим растворителем. Все клетки, независимо от домен или вид, полагайтесь на воду. H2O имеет очень уникальную структуру, когда речь идет о молекулах. Большой кислород притягивает электроны ближе и, таким образом, становится более отрицательным электрически. Каждый из атомов водорода получает меньшую долю общих электронов и становится более положительным. Это делает воду очень сильной дипольной молекулой. Эти противоположные электрические заряды могут растворить большое разнообразие веществ. Вода является полярным растворителем, что означает, что она может легко растворить ионы и молекулы, созданные клетка.
Некоторые вещества, продуцируемые клетками, являются неполярными и имеют тенденцию собираться вместе вдали от воды. Все клетки используют это свойство воды в качестве растворителя для создания мембран из липидов. Фосфолипиды – это большие молекулы, которые имеют полярный глава и неполярный хвост. Когда два слоя фосфолипидов помещаются вместе, неполярные хвосты притягиваются друг к другу, а полярные головки притягиваются к воде. Это создает водный барьер между двумя резервуарами. Вода действует как растворитель на молекулах внутри и снаружи клетки, но клетка может использовать специальные белки для переноса важных молекул внутрь и выброса молекул наружу. Эти растворенные молекулы быстро перемещаются по клетке, поскольку они будут следовать за диффузия градиент или перейти из областей высокой концентрации в области низкой концентрации с помощью растворителя. Растворители также могут насыщаться растворенным веществом, что приводит к тому, что растворенное вещество больше не растворяется.
В более широком масштабе весь океан представляет собой гигантский раствор различных солей и химических веществ. Когда идет дождь, дождь падает на землю, растворяя твердые вещества. Эти растворенные вещества переносятся в реку и текут вниз по течению. Все реки текут к океану, и эти растворы также переносятся в океан. Разные организм полагаться на эти растворы в качестве питательных веществ или важных метаболических солей. Часто в поисках жизни на других планетах вода считается ключевым компонентом, потому что это такой важный и разнообразный растворитель.
Растворители в повседневной кулинарии
Обычная процедура приготовления, дегазирования – это когда клейкое и карамелизованное дно сковороды растворяется в растворителе. Поскольку используется тепло, и неполярные растворители, и полярные растворители способствуют растворению липкого и сгоревшего вещества на дне поддона. Неполярные вещества, такие как масло, можно использовать для приготовления горячего раствора, в котором можно жарить другие продукты. Это частично вводит растворенные в растворителе растворенные вещества в готовую пищу. Повара используют это, чтобы добавить пик к жареным продуктам. Воду также можно использовать для размазывания сковороды, которая может создать бульон для супа, соуса и множества других соусов.
викторина
1. Диэтиловый эфир – это неполярная молекула, которая существует в виде жидкости, если ее хранить в довольно холодном состоянии. Ученые используют диэтиловый эфир для растворения неполярных твердых веществ. Когда диэтиловый эфир нагревается, он испаряется и оставляет твердое вещество в кристаллической форме. Ученый может изучать кристаллы, чтобы узнать больше о молекулах, которые их создали. Какой тип молекулы представляет собой диэтиловый эфир?A. растворенное веществоB. растворительC. Решение
Ответ на вопрос № 1
В верно. В этом случае диэтиловый эфир действует как неполярный растворитель, растворяя твердое вещество. Поскольку диэтиловый эфир имеет очень низкую температуру кипения, его можно выпаривать при низкой температуре. Это означает, что практически любые органические неполярные растворители можно легко и быстро выделить и изучить в лаборатории.
2. Латунь – это смесь меди и цинка. Для изготовления латуни медь плавится в жидкость. Цинк помещается в медь и растворяется медью. Полученную жидкость помещают в форму и дают остыть. Когда он затвердевает, цинк идеально распределяется по всей меди, создавая более прочную структуру. Что такое латунь, цинк и медь соответственно?A. Раствор, Растворяющий, РастворительB. Растворитель, Раствор, РастворенныйC. Растворенный, Растворитель, Раствор.
Ответ на вопрос № 2
верно. Медь растворяет цинк, а полярность молекул распределяет цинк равномерно. Таким образом, медь является растворителем, а цинк растворенным. Полученный раствор – латунь.
3. Ацетон – это полярный растворитель, используемый в основном для растворения лака для ногтей. Если ацетон может не испаряться, можете ли вы использовать одну и ту же порцию ацетона для многократного растворения лака для ногтей?A. даB. нетC. Возможно, если вы позволите лаку для ногтей опускаться на дно.
Ответ на вопрос № 3
В верно. В конце концов, ваш ацетон станет насыщенным лаком. Это означает, что каждая доступная молекула ацетона в настоящее время обладает полной способностью к количеству взаимодействий, с которыми она может справиться. Это делает почти невозможным растворение полироли в растворе. Растворители из гомогенных смесей, которые не отделяются из-за силы тяжести. Чтобы отделить это решение, вы должны были бы выпарить ацетон, и в этом случае вы потеряете его.
Разница между полярными и неполярными растворителями
В ключевое отличие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные сое
Содержание:
В ключевое отличие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.
Полярность соединения означает свойство иметь полюса. В химии это разделение зарядов в молекуле, которая имеет атомы или группы атомов с разной электроотрицательностью. Таким образом, это приводит к частичному положительному заряду и частичному отрицательному заряду в одном и том же соединении.
Что такое полярные растворители?
Полярность растворителя возникает из-за связи атомов с разными значениями электроотрицательности с образованием молекулы. Здесь более электроотрицательный атом притягивает пары электронов связи, что в конечном итоге дает менее электроотрицательному атому частичный положительный заряд из-за уменьшения электронной плотности вокруг себя. С другой стороны, более электроотрицательный атом получает частичный отрицательный заряд, поскольку электронная плотность вокруг этого атома увеличивается.
Кроме того, мы можем разделить полярные растворители на две группы: полярные протонные растворители и полярные апротонные растворители. Полярные протонные растворители содержат лабильный H + ионы. Это означает, что молекулы этих растворителей могут отдавать атомы водорода. Однако полярные апротонные растворители не могут отдавать атомы водорода.
Что такое неполярные растворители?
Неполярные растворители могут растворять неполярные соединения за счет сил притяжения, таких как силы Ван-дер-Вааль. Некоторые примеры неполярных растворителей включают пентан, гексан, бензол, толуол и т. Д.
В чем разница между полярными и неполярными растворителями?
В основном мы можем разделить растворители на две категории: полярные растворители и неполярные растворители. Ключевое различие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.Кроме того, еще одно существенное различие между полярными и неполярными растворителями заключается в том, что полярные растворители имеют высокий дипольный момент, в то время как неполярные растворители не имеют дипольного момента. Типичным примером полярного растворителя является вода. Некоторые примеры неполярных растворителей включают пентан, гексан, бензол, толуол и т. Д.
Более того, полярные растворители имеют молекулы с полярными связями (эти связи показывают разделение электрических зарядов из-за различий в электроотрицательности атомов в связи). У неполярных растворителей есть молекулы, содержащие химические связи, состоящие из атомов, имеющих почти одинаковые значения электроотрицательности.
Мы можем разделить растворители в основном на две категории: полярные растворители и неполярные растворители. Ключевое различие между полярными и неполярными растворителями заключается в том, что полярные растворители растворяют полярные соединения, тогда как неполярные растворители растворяют неполярные соединения.
Какой растворитель самый полярный?
Кроме того, полярная вода апротична?
Протический против Апротический Растворители. Полярный протик растворители воды, этанол, метанол, аммиак, уксусная кислота и другие. Полярный апротический растворители не содержат атомов водорода, непосредственно связанных с электроотрицательным атомом, и они не способны образовывать водородные связи.
Таким образом, что является примером неполярного растворителя? Неполярные растворители липофильны, поскольку растворяются неполярный такие вещества, как масла, жиры, смазки. Примеры of неполярные растворители: четыреххлористый углерод (CCl4), бензол (C6H6) и диэтиловый эфир (CH3CH2OCH2CH3), гексан (CH3 (CH2) 4CH3), метиленхлорид (CH2Cl2).
Является ли спирт полярным растворителем?
Как правило, гидроксильная группа делает спиртыполярный. Эти группы могут образовывать водородные связи с одним другим и с большинством других соединений. Благодаря наличиюполярный ОН-спирты более растворимы в воде, чем простые углеводороды. Метанол, этанол, и пропанол смешиваются с водой.
Является ли спирт полярным растворителем?
Спирт этиловый как растворитель. Спирт этиловый очень полярный молекула из-за ее гидроксильной (ОН) группы, с высокой электроотрицательностью кислорода, позволяющей образовывать водородные связи с другими молекулами. Спирт этиловый поэтому привлекает полярный и ионные молекулы. Таким образом, этанол может растворить оба полярный и не-полярный веществ.
Бензол полярный или неполярный?
Мы могли бы сказать, что бензол is неполярныйпотому что это углеводород, который содержит только связи CC и CH, а углеводороды неполярный. Но C немного более электроотрицателен, чем H (на 0.35 единицы), поэтому связь CH очень незначительна. полярный и имеет небольшой дипольный момент.
Какие примеры полярных растворителей?
Что такое типичный неполярный растворитель?
A нет–полярный растворитель молекулы, имеющие примерно одинаковый электрический заряд со всех сторон; другими словами, он имеет низкую статическую диэлектрическую проницаемость. не–полярные растворители Он типично углеводороды, такие как пентан и гексан. не–полярные растворители используются для растворения других углеводородов, таких как масла, жиры и воски.
Этанол полярный или неполярный?
Спирт этиловый очень полярный молекула из-за своей гидроксильной (ОН) группы, с высокой электроотрицательностью кислорода, что позволяет образовывать водородные связи с другими молекулами. Фетил (C2H5) группа в этанол isнеполярный. Таким образом, этанол может растворить обаполярный и неполярный веществ.
Что такое типичный полярный растворитель?
Полярные растворители: вода, ацетон, этанол. Не-полярные растворители: гексан, бензол, толуол. Диэтиловый эфир представляет собой слегка полярный растворитель.
Ацетон полярный или неполярный?
Вода это полярный молекула, в то время как тетрахлорид углерода представляет собой неполярный молекула. Если мы воспользуемся концепцией «нравится, нравится, нравится», тогда ацетон это оба полярныйи неполярный. Этот двойственный характер ацетон Это связано с его способностью образовывать водородные связи с водой и наличием двух метильных групп.
Какие бывают типы растворителей?
| растворитель | Точка кипения, Цельсия | Диэлектрическая постоянная |
|---|---|---|
| Гексан, C6H14 | 69 | 1.9 |
| Бензол, C6H6 | 80 | 2.3 |
| Хлороформ, CHCl3 | 61 | 4.8 |
| Диэтиловый эфир, (CH3CH2)2O | 35 | 4.3 |
Что полярное, а что неполярное?
Полярный молекулы возникают, когда существует разница электроотрицательностей между связанными атомами. Неполярные молекулы возникают, когда электроны делятся равными между атомами двухатомной молекулы или когда полярный связи в более крупной молекуле нейтрализуют друг друга.
Гексан полярный или неполярный?
гексан is неполярный за счет связей C – H и симметричной геометрической структуры. Углерод и водород имеют разность электроотрицательностей 0.35, что классифицирует молекулу как неполярный.
Какие примеры полярных растворителей?
Почему полярный апротонный растворитель пользу SN2реакции вообще? Это так, потому что ДМСО стабилизирует разделение зарядов, связанное с переходным состоянием SN2реакция (1-ступенчатая бимолекулярная реакция). Другой полярный апротикирастворители также можно использовать с той же целью.
Какие примеры полярных растворителей?
Что такое полярный раствор?
Что это за растворитель THF?
Другое основное применение ТГФ как промышленный растворитель для поливинилхлорида (ПВХ) и лакокрасочных материалов. Это апротический растворитель с диэлектрической проницаемостью 7.6. Это умеренно полярный растворитель и может растворять широкий спектр неполярных и полярных химических соединений.
Что делает нуклеофил сильным?
Заряд. «Сопряженное основание всегда лучше.нуклеофил». HO- лучше нуклеофил чем H2O. Чем больше отрицательный заряд, тем больше вероятность, что атом отдаст свою пару электронов для образования связи.
Что такое полярное и неполярное соединение?
Полярные соединения Он соединений которые имеют небольшие заряды (слегка положительные и слегка отрицательные) в пределах соединение. Неполярные соединения Он соединений которые не имеют слегка отрицательных и положительных зарядов в пределах соединение. Различия электроотрицательности неполярные соединения находятся между 0 и. 2.
В химии существует общее правило для определения того, растворитель растворяет данное растворенное вещество, «подобное растворяется подобным». Растворители состоит из полярных молекул, таких как водырастворяют другие полярные молекулы, например поваренную соль, в то время как неполярные растворители, например, бензин, растворяются неполярный такие вещества, как воск.
Почему пентан неполярен?
Пентаны молекулярные, и, конечно же, они неполярный, и, следовательно, добавление n-пентан вода образует два несмешивающихся слоя с МЕНЬШЕ плотной пентан плавает в верхней части воронки. Пониженное поверхностное натяжение пентан, также можно объяснить отсутствием межмолекулярного взаимодействия.
Вода полярная?
Вода (H2О) полярный из-за изогнутой формы молекулы. Форма означает, что большая часть отрицательного заряда кислорода находится на стороне молекулы, а положительный заряд атомов водорода находится на другой стороне молекулы. Это пример полярный ковалентная химическая связь.
Вода полярная?
Полярный протонный растворители часто используются для растворения солей. В общем, эти растворители обладают высокими диэлектрическими постоянными и высокой полярностью. Примеры включают воду, большинство спиртов, муравьиную кислоту, фтороводород и аммиак.
Является ли уксус растворителем?
Sn1 или sn2 быстрее?
Затем он утверждает SN1 доходы быстрее чемSN2. BR, с другой стороны, говорит SN2 isбыстрее.
Вода полярная или неполярная?
Вода это «полярный”Молекулы, что означает неравномерное распределение электронной плотности. Водаимеет частичный отрицательный заряд () около атома кислорода из-за нераспределенных пар электронов и частичный положительный заряд () около атомов водорода.
Пропиленгликоль полярный или неполярный?
ДМФ является основным или кислым?
В химии существует общее правило для определения того, растворитель растворяет данное растворенное вещество, «подобное растворяется подобным». Растворители состоит из полярных молекул, таких как водырастворяют другие полярные молекулы, например поваренную соль, в то время как неполярные растворители, например, бензин, растворяются неполярный такие вещества, как воск.
Растворители
Внешний вид автомобиля может многое сказать как о самом средстве передвижения, так и о его владельце. Грамотно выполненная покраска способна преобразить даже старую машину. А вот качество этой процедуры во многом зависит от правильно выбранного растворителя.
Он представляет собой химическое соединение (органическое или неорганическое) или смесь, обладающую способностью растворять различные вещества. 
ВНИМАНИЕ! Найден совершенно простой способ сократить расход топлива! Не верите? Автомеханик с 15-летним стажем тоже не верил, пока не попробовал. А теперь он экономит на бензине 35 000 рублей в год! Читать дальше»
Если его планируется использовать для разбавления краски или эмали, то его выбор главным образом зависит от химического состава данной краски.
Полярные и неполярные растворители
В зависимости от ориентации атомов внутри молекул, растворители делятся на:
Чтобы избежать возможных проблем с совместимостью краски и растворителя (на покрашенной поверхности могут появиться различные дефекты), специалисты советуют пользоваться материалами одного производителя.
Полярные растворители — это спирты, кетоны и прочие вещества, в составе молекул которых имеется кислород. К неполярным относятся уайт-спирит, керосин и другие углеводородные составы.

Спирты и эфиры хорошо использовать для разбавления водорастворимых эмалей и водоэмульсионных автомобильных красок. А вот уайт-спирит в данном случае применять нельзя.
Универсальный состав, хорошо взаимодействующий как с полярными, так и с неполярными лакокрасочными материалами, ксилол.
Ацетон можно сочетать только с полярными веществами, для разведения классических эмалей он не пригоден.
Итак, полярные и неполярные растворители подбираются в зависимости от химического состава красочного покрытия. Но нередко производитель, с целью сохранения технической тайны, не указывает точный состав материала. В таком случае полученную смесь лучше протестировать на пробной поверхности. Если разбавленная краска не свернулась, то использовать ее, по крайней мере, уже допустимо. Но специалисты рекомендуют дождаться полного высыхания покрашенного тестового изделия, после чего проверить покрытие на прочность.
Как правильно использовать растворитель
Приступая к разведению краски или эмали, следует внимательно прочитать инструкцию, указанную на упаковке. В ней содержится информация о рекомендуемом соотношении красочного покрытия и растворяющего состава. Ведь данный показатель влияет на качество выполняемых работ.
Для контроля вязкости краски рекомендуется приобрести специальный прибор – вискозиметр. При его отсутствии все придется определять на глаз: если краска льется – она слишком сильно разбавлена, если капает – разведена нормально.
На вязкость краски влияет температура воздуха и влажность в помещении. Даже небольшое отклонение от комнатной температуры (4-6º) ведет к необходимости менять объем добавляемого растворителя.
Кроме того, на количество растворителя влияет такой показатель, как степень наполненности краски. Он определяет количество растворяющего состава, которое производитель уже добавил в красочное покрытие, чтобы во время хранения оно не засохло.
В зависимости от концентрации компонентов, автоэмали подразделяются на:
Такие краски маркируют соответствующим образом — LS, HD, HS, MS, UHS и VHS (в порядке возрастания).
Как сэкономить на растворителе
Покупая растворитель, можно сэкономить средства, если приобрести составы отечественного производства. Но в этом случае нужно знать тип используемой краски, иначе результат может быть печальным — потребуется перекраска автомобиля.
Акриловые эмали лучше разводить специальным растворителем. Но в целях финансовой экономии можно использовать отечественный Р-12 или 651.
Для алкидных красок подходит растворитель Р-4, ксилол или чистый толуол.
Для нитроэмалей можно использовать состав 646. Но работать с ним нужно очень аккуратно, поскольку он является достаточно агрессивным.
Водоэмульсионные краски, как уже ранее было сказано, можно разбавлять эфирами, спиртом и водой.
Содержание
Решения и сольватация
Когда одно вещество растворенный в другой, решение сформирован. [2] Это противоположно ситуации, когда соединения нерастворимый как песок в воде. В растворе все ингредиенты равномерно распределены на молекулярном уровне и не остается остатков. Смесь растворителя и растворенного вещества состоит из одного фаза со всеми молекулами растворенного вещества, встречающимися как сольваты (растворитель-растворенный комплексы), в отличие от отдельных непрерывных фаз, как в суспензиях, эмульсиях и других типах смесей, не являющихся растворами. Способность одного соединения растворяться в другом известна как растворимость; если это происходит во всех пропорциях, это называется смешивающийся.
Помимо перемешивания, вещества в растворе взаимодействуют друг с другом на молекулярном уровне. Когда что-то растворяется, молекулы растворителя располагаются вокруг молекулы растворенного вещества. Теплопередача участвует и энтропия увеличивается, делая решение более термодинамически стабильнее, чем растворенное вещество и растворитель по отдельности. Такое расположение опосредуется соответствующими химическими свойствами растворителя и растворенного вещества, такими как водородная связь, дипольный момент и поляризуемость. [3] Сольватация не вызывает химической реакции или изменений химической конфигурации растворенного вещества. Однако сольватация напоминает координационный комплекс реакция образования, часто со значительной энергетикой (теплота сольватации и энтропия сольватации) и, таким образом, далека от нейтрального процесса.
Классификация растворителей
Растворители можно условно разделить на две категории: полярный и неполярный. Особый случай Меркурий, решения которой известны как амальгамы; также другие металлические решения существуют жидкие при комнатной температуре. Как правило, диэлектрическая постоянная Количество растворителя позволяет приблизительно определить полярность растворителя. На сильную полярность воды указывает ее высокая диэлектрическая проницаемость 88 (при 0 ° C). [4] Растворители с диэлектрической проницаемостью менее 15 обычно считаются неполярными. [5] Диэлектрическая проницаемость измеряет тенденцию растворителя частично компенсировать напряженность электрического поля заряженная частица погрузился в него. Это сокращение затем сравнивается с напряженность поля заряженной частицы в вакууме. [5] Эвристически диэлектрическую проницаемость растворителя можно рассматривать как его способность снижать эффективность растворенного вещества. внутренний заряд. Как правило, диэлектрическая проницаемость растворителя является приемлемым показателем способности растворителя растворять обычные ионные соединения, например соли.
Другие шкалы полярности
В Грюнвальд – Винштейн мY шкала измеряет полярность с точки зрения влияния растворителя на накопление положительного заряда растворенного вещества во время химической реакции.
Kosowerс Z шкала измеряет полярность с точки зрения влияния растворителя на УФ-максимумы поглощения соли, обычно пиридиний йодид или пиридиний цвиттерион. [6]
Номер донора и шкала акцептора донора измеряет полярность с точки зрения того, как растворитель взаимодействует с определенными веществами, например, сильным Кислота Льюиса или сильная база Льюиса. [7]
В Параметр Хильдебранда квадратный корень из плотность когезионной энергии. Его можно использовать с неполярными соединениями, но он не подходит для сложных химических процессов.
Полярность, дипольный момент, поляризуемость и водородная связь растворителя определяет, какой тип соединения он способен растворяться и с какими другими растворителями или жидкими соединениями он смешивающийся. Обычно полярные растворители лучше всего растворяют полярные соединения, а неполярные растворители лучше всего растворяют неполярные соединения: «подобное растворяется в подобном». Сильно полярные соединения, такие как сахара (например, сахароза) или ионные соединения, такие как неорганический соли (например. столовая соль) растворяются только в очень полярных растворителях, таких как вода, в то время как сильно неполярные соединения, такие как масла или же воск растворяются только в очень неполярных органических растворителях, таких как гексан. Точно так же вода и гексан (или же уксус и растительное масло) не смешивающийся друг с другом и быстро разделятся на два слоя даже после хорошего встряхивания.
Полярность может быть разделена на разные вклады. Например, Параметры Камлета-Тафта диполярность / поляризуемость (π *), водородно-связывающая кислотность (α) и основность водородных связей (β). Их можно рассчитать по сдвигу длин волн 3–6 различных сольватохромных красителей в растворителе, обычно включая Краситель Рейхардта, нитроанилин и диэтилнитроанилин. Другой вариант, параметры Хансена, разделяют плотность энергии когезии на вклады дисперсии, полярности и водородных связей.
Полярный протон и полярный апротический
Многокомпонентный
Многокомпонентные растворители появились после Второй мировой войны в СССР и продолжают использоваться и производиться в постсоветских странах.
Растворители
| Имя | Сочинение |
|---|---|
| Растворитель 645 | толуол 50%, бутилацетат 18%, этилацетат 12%, бутанол 10%, этанол 10%. |
| Растворитель 646 | толуол 50%, этиловый спирт 15%, бутанол 10%, бутил- или амилацетат 10%, этилцеллозольв 8%, ацетон 7% [9] |
| Растворитель 647 | бутилацетат или амилацетат 29,8%, ацетат этила 21,2%, бутанол 7,7%, толуол или пиробензол 41.3% [10] |
| Растворитель 648 | бутил ацетат 50%, этанол 10%, бутанол 20%, толуол 20% [11] |
| Растворитель 649 | этилцеллозольв 30%, бутанол 20%, ксилол 50% |
| Растворитель 650 | этилцеллозольв 20%, бутанол 30%, ксилол 50% [12] |
| Растворитель 651 | белый дух 90%, бутанол 10% |
| Растворитель КР-36 | бутилацетат 20%, бутанол 80% |
| Растворитель П-4 | толуол 62%, ацетон 26%, бутилацетат 12%. |
| Растворитель П-10 | ксилол 85%, ацетон 15%. |
| Растворитель П-12 | толуол 60%, бутилацетат 30%, ксилол 10%. |
| Растворитель П-14 | циклогексанон 50%, толуол 50%. |
| Растворитель П-24 | растворитель 50%, ксилол 35%, ацетон 15%. |
| Растворитель П-40 | толуол 50%, этилцеллозольв 30%, ацетон 20%. |
| Растворитель П-219 | толуол 34%, циклогексанон 33%, ацетон 33%. |
| Растворитель Р-3160 | бутанол 60%, этанол 40%. |
| Растворитель RCC | ксилол 90%, бутилацетат 10%. |
| Растворитель РМЛ | этанол 64%, этилцеллозольв 16%, толуол 10%, бутанол 10%. |
| Растворитель ПМЛ-315 | толуол 25%, ксилол 25%, бутилацетат 18%, этилцеллозольв 17%, бутанол 15%. |
| Растворитель ПК-1 | толуол 60%, бутилацетат 30%, ксилол 10%. |
| Растворитель ПК-2 | уайт-спирит 70%, ксилол 30%. |
| Растворитель RFG | этанол 75%, бутанол 25%. |
| Растворитель РЭ-1 | ксилол 50%, ацетон 20%, бутанол 15%, этанол 15%. |
| Растворитель РЕ-2 | Растворитель 70%, этанол 20%, ацетон 10%. |
| Растворитель РЭ-3 | растворитель 50%, этанол 20%, ацетон 20%, этилцеллозольв 10%. |
| Растворитель РЭ-4 | растворитель 50%, ацетон 30%, этанол 20%. |
| Растворитель ФК-1 (?) | абсолютный спирт (99,8%) 95%, этилацетат 5% |
Разбавители
| Имя | Сочинение |
|---|---|
| Разбавитель РКБ-1 | бутанол 50%, ксилол 50% |
| Разбавитель РКБ-2 | бутанол 95%, ксилол 5% |
| Разбавитель РКБ-3 | ксилол 90%, бутанол 10% |
| Разбавитель М | этанол 65%, бутилацетат 30%, этилацетат 5%. |
| Разбавитель П-7 | циклогексанон 50%, этанол 50%. |
| Разбавитель Р-197 | ксилол 60%, бутилацетат 20%, этилцеллозольв 20%. |
| Разбавитель WFD | толуол 50%, бутилацетат (или амилацетат) 18%, бутанол 10%, этанол 10%, этилацетат 9%, ацетон 3%. |
Физические свойства
Таблица свойств распространенных растворителей
Растворители сгруппированы в неполярный, полярный апротический, и полярный протический растворители, причем каждая группа упорядочена по возрастанию полярности. В характеристики растворители, превышающие водные, выделены жирным шрифтом.
| Растворитель | Химическая формула | Точка кипения [13] (° C) | Диэлектрическая постоянная [14] | Плотность (г / мл) | Дипольный момент (D) |
|---|---|---|---|---|---|
| 36.1 | 1.84 | 0.626 | 0.00 | ||
| Циклопентан | 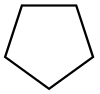 C5ЧАС10 | 49.2 | 1.97 | 0.751 | 0.00 |
| Гексан | 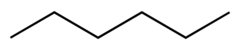 | 69 | 1.88 | 0.655 | 0.00 |
| Циклогексан |  C6ЧАС12 | 80.7 | 2.02 | 0.779 | 0.00 |
| Бензол | 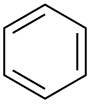 C6ЧАС6 | 80.1 | 2.3 | 0.879 | 0.00 |
| Тетрахлорметан | CCl4 | 76.7 | 2.3 | 1.5867 | 0.00 |
| Толуол | C6ЧАС5-CH3 | 111 | 2.38 | 0.867 | 0.36 |
| 1,4-диоксан |  C4ЧАС8О2 | 101.1 | 2.3 | 1.033 | 0.45 |
| Диэтиловый эфир |  Полярный апротический растворители | 100–103 | 35.87 | 1.1371 | 3.56 |
| Пропиленкарбонат |  Полярный протический растворители | 1.42 | |||
| Муравьиная кислота |  Н-С (= O) ОН | 100.8 | 58 | 1.21 | 1.41 |
| п-Бутанол |  | 64.7 | 33 | 0.791 | 1.70 |
| Уксусная кислота |  CH3-С (= О) ОН | 118 | 6.2 | 1.049 | 1.74 |
| Вода |  H-O-H | 100 | 80 | 1.000 | 1.85 |
В ACS Green Chemistry Institute поддерживает инструмент для выбора растворителей на основе Анализ главных компонентов свойств растворителя. [15]
