Что такое правило частот
Квантовые постулаты Бора
В свое время планетарная модель атома была предложена Резерфордом. Фактически, это была неудачная попытка перенести классические представления о движении тел в область явлений атомных масштабов. Планетарная модель оказалась несостоятельной, так как атом неустойчив по причине ускорения, с которым электроны якобы движутся по орбите. В таких условиях электроны должны достаточно быстро растрачивать свою энергию на электромагнитное излучение и падать на ядро.
На смену планетарной теории пришли постулаты Бора. В 1913 году выдающийся датский физик Нильс Бор на основе своих наблюдений и фактов, полученных опытным путем, установил, что большая часть представлений о строении атома не соответствовала действительности. Он же стал основоположником новой теории о строении атома.
Рассмотрим два постулата Бора подробнее.
Первый постулат Бора
В соответствии с классической механикой энергия электрона, движущегося по орбите вокруг ядра, может быть любой. В этом плане первый постулат Бора находится в явном противоречии и с планетарной моделью атома, и с классической механикой.
Второй постулат Бора
Энергия кванта при этом определяется как разность энергий двух квантовых состояний:
где h – постоянная Планка.
VI. Квантовая физика
Тестирование онлайн
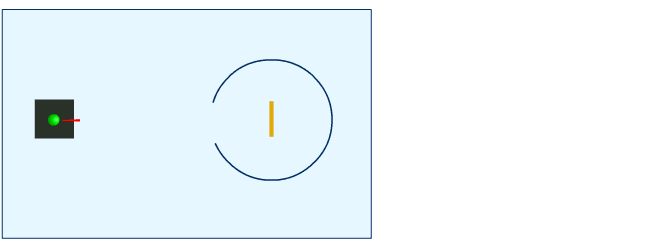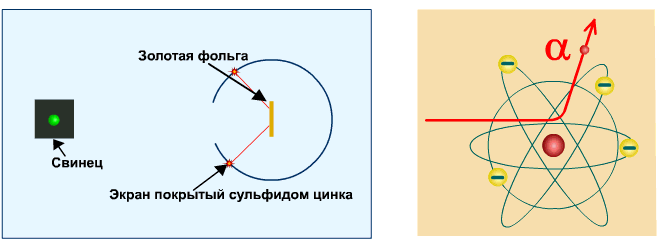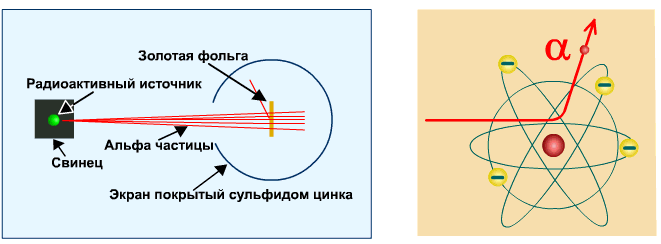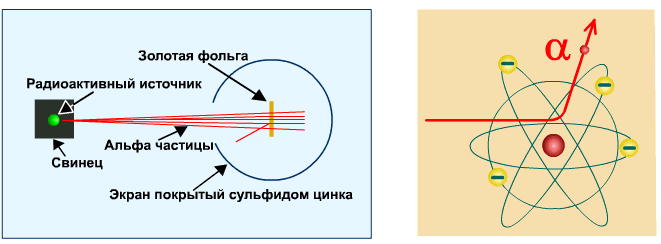
Опыт Резерфорда
Опыт Резерфорда. Пучок положительно заряженных альфа-частиц, излучаемые радиоактивными элементами, направлялся на сверхтонкую золотую фольгу толщиной около 400 нм. Частицы, прошедшие через фольгу, регистрировались на экране при помощи микроскопа.
Что бы это могло значить? То, что внутри атома имеется очень сильное электрическое поле, которое создается положительным зарядом, сконцентрированном в очень малом объеме. Название «ядро» было предложено Резерфордом. В ядре сосредоточена также вся масса атома.
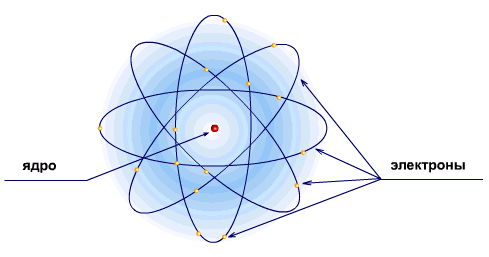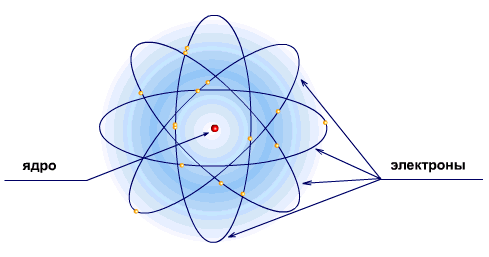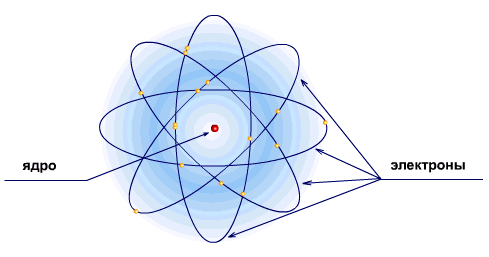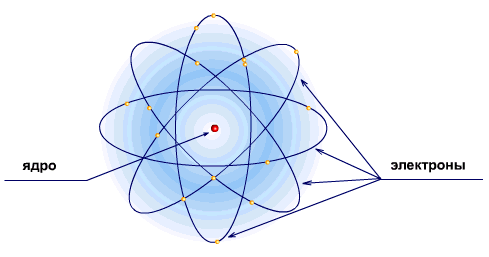
Ядерная модель атома
В 1911 г. Эрнест Резерфорд предложил ядерную модель атома.
Квантовые постулаты Бора
I постулат Бора (постулат стационарных состояний): электрон в атоме может находиться только в особых (квантовых) состояниях, каждому из которых соответствует определенная энергия. Когда электрон находится в стационарном состоянии, вращаясь по орбите, он не излучает.
Стационарные состояния можно пронумеровать, причем каждое состояние обладает своей фиксированной энергией.
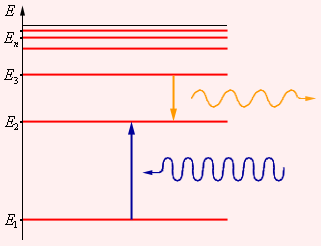
II постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергий электрона в данных состояниях.
II постулат Бора позволил объяснить линейчатую структуру атомных спектров.
III постулат Бора (правило квантования орбит): стационарные электронные орбиты находятся из условия
Квантовые постулаты Бора
Квантовые постулаты Бора – это два основных допущения, введённые Н.Бором для объяснения устойчивости атома и спектральных закономерностей (в рамках модели атома Резерфорда).
Планетарная модель атома Резерфорда позволила объяснить результаты опытов по рассеянию α-частиц вещества, но она не способна объяснить факт существования атома и его устойчивость.
В соответствии с планетарной моделью электроны атома должны двигаться вокруг неподвижного ядра. Двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, электрон должен, как и всякий ускоренно движущийся электрический заряд, излучать электромагнитные волны с частотой, равной частоте обращения электрона вокруг ядра.
Энергия электрона в атоме должна при этом непрерывно уменьшаться за счёт излучения. Сам электрон должен с каждым оборотом приближаться по спирали к ядру и упасть на него под действием электрической силы притяжения. При этом атом потеряет всю электронную оболочку, а также присущие ему физические и химические свойства. Кроме того, атом должен потерять спектр излучения частоты, то есть атом должен давать излучение с непрерывным (сплошным) спектром частот.
В 1913 году датский физик Нильс Бор (1885 – 1962) ввёл идеи квантовой теории в ядерную модель атома Резерфорда и разработал теорию атома водорода, которая подтвердилась всеми известными тогда опытами. Бор сформулировал в виде постулатов основные положения новой теории, которые налагали лишь некоторые ограничения на допускаемые классической физикой движения. Однако последовательной теории атома Бор не дал. Впоследствии теория Бора была включена как частный случай в квантовую механику. В основе теории Бора лежат два постулата.
Первый постулат Бора: постулат стационарных состояний
Второй постулат Бора: правило частот
Частота излучения равна:
Или, длина волны излучения λ равна:
Где h – постоянная Планка, с – скорость света в вакууме.
Правило квантования орбит позволяет определить радиусы стационарных орбит:
где n = 1, 2, 3…, m – масса электрона, rn – радиус n-ой орбиты, vn – скорость электрона на этой орбите.
Число n – положительное число, которое называется главное квантовое число.
Величина (mvn)rn – момент импульса электрона.
h’ – это величина, которая равна:
где h – постоянная Планка.
Главное квантовое число указывает номер орбиты, по которой может обращаться электрон.
Кулоновская сила сообщает электрону на орбите центростремительное ускорение:
Согласно второму закону Ньютона:
rn = 4πε0n 2 h’ / me 2 (так как h’ = h / 2π)
Радиус первой орбиты в атоме водорода носит название первый Боровский радиус и служит единицей длины в атомной физике.
Полная энергия Е электрона в атоме водорода, согласно механике Ньютона, равна сумме кинетической энергии Еk и потенциальной энергии П взаимодействия электрона с ядром:
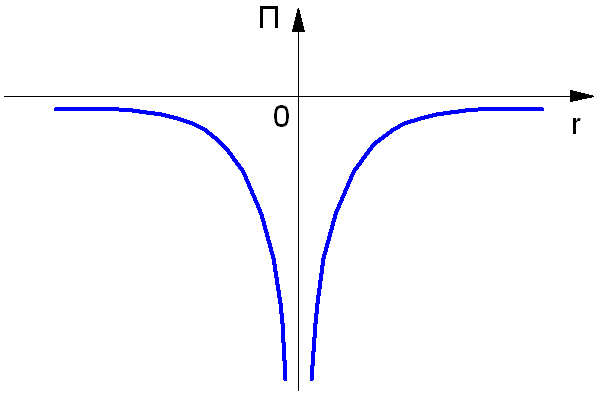
Потенциальная энергия электрона в атоме отрицательна:
Так как нулевой уровень отсчёта берётся на бесконечности (рис. 1.3), а по мере приближения электрона к ядру его потенциальная энергия уменьшается. Взаимодействующие частицы – ядро и электрон – имеют заряды противоположных знаков.
Рис. 1.3. Потенциальная энергия электрона в атоме.
Подставляя значение скорости
в выражение полной энергии, получим:
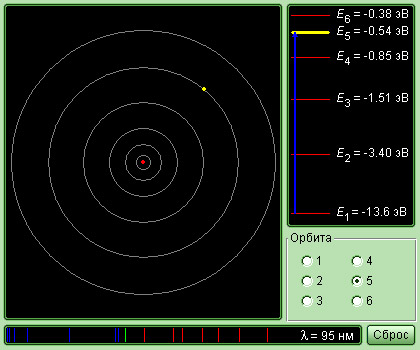
Подставляя в эту формулу выражение для радиусов орбит, получим энергетические уровни электрона в атоме водорода (значения энергий стационарных состояний атома):
Значение энергии, соответствующее первому (низшему) энергетическому уровню в атоме водорода равно:
В этом состоянии атом может находиться сколько угодно долго. Для того чтобы ионизировать атом водорода, ему нужно сообщить энергию 13,53 эВ, которая называется энергия ионизации.
Частота излучения атома водорода:
Постоянная Ридберга определяется через постоянную Планка, массу и заряд электрона.
Длина волны излучения определяется соотношением:
с = 3*10 8 м/с – скорость света в вакууме.
Теоретическое значение R совпадает с экспериментальным значением, полученным из спектроскопических измерений.
Энергия обычно измеряется в электронвольтах (эВ). Электронвольт – это значение энергии, которую приобретает электрон, пройдя ускоряющую разность потенциалов в 1 В:
Что такое правило частот
Выход из тупика был найден датским ученым Нильсом Бором в 1913 году, получившим Нобелевскую премию в 1922 году.
 | БОР Нильс Хендрик Давид (1885–1962) – выдающийся датский физик-теоретик, один из создателей современной физики. Сформулировал идею о дискретности энергетических состояний атомов, в свете новых идей построил атомную модель, открыв условия устойчивости атомов, и объяснил большой круг явлений. Создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам. Автор теории составного ядра, один из создателей капельной модели ядра и теории деления атомного ядра. |
Бор высказал предположения, которые были названы постулатами Бора.
· Первый постулат(постулат стационарных состояний): электроны движутся только по определенным (стационарным) орбитам. При этом, даже двигаясь с ускорением, они не излучают энергию.
· Второй постулат(правило частот): излучение и поглощение энергии в виде кванта света (hn) происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний, между которыми совершается скачок электрона: 
Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:
Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка:
где n = 1, 2, 3,… – главное квантовое число.
Получим выражение для энергии электрона в атоме.
Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью 
 |  |
| а | б |
Уравнение движения электрона имеет вид:
Из формулы (6.3.3) видно, что центробежная сила равна кулоновской силе, где 
Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б):
Радиус первой орбиты водородного атома называют боровским радиусом. При n =1, Z = 1 для водорода имеем:

Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с ядром:

Из уравнения движения электрона следует, что 

Подставим сюда выражение для радиуса первой орбиты и получим:
Здесь учтено, что постоянная Планка 

Для атома водорода при Z = 1 имеем:
Из формулы (6.3.6) видно, что 
Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7.

При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией:


Получена обобщенная формула Бальмера, которая хорошо согласуется с экспериментом. Выражение перед скобками, как уже было сказано, носит название постоянной Ридберга:

Серьезным успехом теории Бора явилось вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых спектров. Бору удалось объяснить линии спектра ионизованного гелия. Он теоретически вычислил отношение массы протона к массе электрона 
Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8).
Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и явилась квантовая механика.
Что такое правило частот
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на ядро, растратив всю энергию на излучение электромагнитных волн (рис. 6.2.1).
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Второй постулат Бора ( правило частот ) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией в другое стационарное состояние с энергией излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
где – постоянная Планка. Отсюда можно выразить частоту излучения:
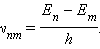 |
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона.