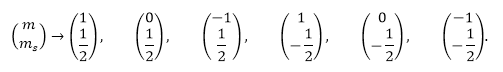Что такое правило хунда
Правило Хунда
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: модуль суммарного значения спинового квантового числа электронов данного подслоя должен быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина):
Как видно, сначала появляется один электрон на 2px-орбитали, затем один электрон на 2py-орбитали, после этого один электрон на 2pz-орбитали, затем появляются парные электроны на 2px-, 2py— и 2pz-орбиталях.
Мнемоническое правило
Для запоминания Правила Хунда существует мнемоническое «правило трамвайного вагона»:
Ты приглядись, решив присесть,
К местам трамвайного вагона:
Когда ряды пустые есть,
Подсаживаться нет резона.
См. также
Полезное
Смотреть что такое «Правило Хунда» в других словарях:
правило Хунда — Hundo taisyklė statusas T sritis fizika atitikmenys: angl. Hund’s rule vok. Hundsche Regel, f rus. правило Хунда, n pranc. règle de Hund, f … Fizikos terminų žodynas
Правило Клечковского — (также Правило n+l; также используется название правило Маделунга) эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах. Правило Клечковского гласит: Заполнение электронами орбиталей в атоме… … Википедия
ХУНДА ПРАВИЛО — правило для нахождения самых глубоких уровней энергии, соответствующих определённой э л е к т р о н н о й к о н ф и г у р а ц и и атома при н о р м а л ь н о й с в я з и спиновых и орбитальных моментов образующих эти конфигурации электронов,… … Физическая энциклопедия
ХУНДА ПРАВИЛА — приближенные правила, определяющие относит. расположение энергетич. уровней атома. Получены Ф. Хундом в 1927 в результате анализа атомных спектров. Формулировка X. п. предполагает, что состояние многоэлектронного атома можно описать, указав т.… … Химическая энциклопедия
МАГНЕТИЗМ — 1) особая форма вз ствия между электрич. токами, между токами и магнитами (т. е. телами с магнитным моментом) и между магнитами; 2) раздел физики, изучающий это взаимодействие и св ва в в (магнетиков), в к рых оно проявляется. Основные проявления … Физическая энциклопедия
Мнемоника — Содержание 1 Основной метод запоминания в современной мнемонике 2 История … Википедия
Комплексные соединения — Цис платин одно из многих координационных соединений Комплексные соединения (лат. complexus сочетание, обхват) или координационные соединения (л … Википедия
Хунд, Фридрих — Фридрих Хунд нем. Friedrich Hund … Википедия
КРИСТАЛЛИЧЕСКОГО ПOЛЯ ТЕОРИЯ — квантовохим. теория, в к рой низшие по энергии состояния молекулы описываются как состояния одного атома (иона), находящегося в электростатич. поле, созданном остальными частицами. Как правило, К. п. т. применяется к координац. соед., кристаллам… … Химическая энциклопедия
P-элементы (химические) — p элементами называют химические элементы, в атомах которых электрон с наивысшей энергией занимает p орбиталь. p элементами являются: в 1 м периоде нет p элементов во 2 м периоде B Ne в 3 м периоде Al Ar в 4 м периоде Ga Kr в 5 м периоде In Xe в… … Википедия
Правило Хунда
Вы будете перенаправлены на Автор24
Последовательность заполнения электронных оболочек атомов
Два принципа определяют строение электронной оболочки атома элемента:
принцип Паули, который гласит: в атоме может существовать только один электрон с определенным набором квантовых чисел, что учитывает квантовые свойства возможных состояний атома;
принципом минимума энергии: при известном суммарном количестве электронов в атоме реализуется состояние с наименьшей энергией. Данный принцип является естественным для существования устойчивого состояния атома. Так как, если состояние атома не является состоянием с наименьшей энергией, то атом может под воздействием внутренних причин перейти в состояние с минимумом энергии.
Анализируя строение атома в первом приближении, пренебрегают энергией взаимодействия электронов. При этом энергию атома приравнивают к суммарной энергии электронов в поле, которое создается ядром атома. Отталкиваясь от данной известной энергии, находят распределение электронов по разным состояниям при учете принципа Паули и минимума энергии. При этом получают идеальную схему заполнения оболочек. Надо отметить, что идеальная схема заполнения может сильно отличаться от реально существующей. Исходя из принципа Паули, максимальное количество электронов (N), которое может находиться в оболочке равно:
Правило Хунда
Готовые работы на аналогичную тему
При этом состояния заполняются как:
Другими словами правило Хунда можно сформулировать так:
в большинстве случаев электроны в атоме являются неспаренными, по возможности они имеют параллельные спины.
Правило Хунда вызвано тем, что электроны в атоме взаимно отталкиваются. В результате энергия атома уменьшается с увеличением расстояния между электронами. Электроны, которые находятся в одной подоболочке и имеют одинаковые направления спинов, имеют разные величины магнитного квантового числа и, следовательно, определяются волновыми функциями с отличными распределениями в пространстве. Получается, что электроны, обладающие параллельными спинами, отстоят в пространстве дальше друг от друга, чем спаренные электроны. Такая конфигурация имеет меньшую энергию и значит, является более устойчивой.
Следствие правила Хунда
Только те атомы могут образовать молекулы, у которых присутствует один или более неспаренных электронных спинов. По правилу Хунда в одной подоболочке электроны имеют столько параллельных спинов, сколько это возможно (то есть направление спина одинаково у максимального числа электронов). При этом все атомы (исключая атомы с замкнутыми подоболочками) обладают неспаренными электронами, следовательно, могут создавать связи (вступать в реакции). Из сказанного выше можно сделать вывод о том, что все элементы с незамкнутыми внешними оболочками могут создавать химические соединения.
Правила Хунда (используются для построения основного терма):
Задание: Объясните, каковы структуры молекул водорода, кислорода и азота?
Решение:
Внешняя оболочка имеет три электрона, спины которых параллельны. Валентность атома азота равна трем. Соответственно, структурная формула молекулы азота запишется как:
Задание: Каким будет основной терм и основные состояния у атома углерода?
Решение:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 22 06 2021
Правило Хунда: в чём оно заключается, примеры, формулировка
Содержание:
Фридрих Хунд (в некоторых источниках Гунд) – немецкий ученый, внесший вклад в развитие атомной физики. Большую часть жизни посвятил квантовой механике, спектроскопии. Он создатель более 250 научных статей.
В 1927 г. ученый в области химии Фридрих Хунд сформулировал правило, которое отражает порядок заполнения орбиталей. Это открытие позволило разгадать многие загадки нашей планеты. Формулировка правила Гунда: электроны в ячейках располагаются таким образом, чтобы суммарный спин был максимальным.
Пример доказательства правила Хунда
Например, в атоме на р-орбитали располагаются три электрона. Для р-орбитали характерно три ячейки. Электроны могут располагаться разными способами:
Чтобы определить, какой из вариантов верен, необходимо посчитать магнитное спиновое квантовое число для каждого случая.
Т. о. исходя из максимальной суммы спинов, верен последний вариант.
Последствия правила Гунда
Явление ферромагнетизма железа, кобальта, никеля – следствие закона Гунда. 3d-подоболочки этих химических элементов заполнены только частично. В данной ситуации спиновые магнитные моменты не компенсируются. В железе из шести 3d-электронов пять обладают параллельными спинами. У каждого атома железа суммарный спиновой момент большой.
Из-за того что внутри атома электроны отталкиваются и возникло правило Гунда. В итоге энергия атома уменьшается с увеличением расстояния между электронами. Для электронов из одной подоболочки характерны одинаковые направления спинов и различные величины магнитного квантового числа. Поэтому они определяются волновыми функциями с отличными распределениями в пространстве. Электроны с параллельными спинами находятся на большом расстоянии друг от друга, по сравнению со спаренными электронами. Такая конфигурация имеет меньшую энергию и, значит, является более устойчивой.
Правило Хунда
С помощью правила Хунда (Гунда) определяется порядок заполнения орбиталей определенного подслоя. Формулировка правила звучит следующим образом: совокупное количество электронов данного подслоя должно быть максимальным.
Есть и другая формулировка правила Хунда: ниже по энергии находится атомный терм, для которого соблюдаются 2 условия:
Наибольшую распространенность получили следующее правила Хунда:
С правилами Хунда тесно переплетается важный для теории молекулярных орбиталей принцип заполнения: из нескольких конфигураций молекулы ниже по энергии те, для которых сумма значений орбитальных энергий атомов меньше.
Правило Хунда ограничено низко лежащими состояниями атомов с условием, что воздействие электронной корреляции (взаимной обусловленности движений электронов) небольшое и не нарушает границ применимости одно-конфигурационного приближения.
2 -е правило Хунда имеет более ограниченное применение и определяется, как правило, тем, насколько существенно межэлектронное отталкивание в анализируемых состояниях. Данное правило выполнимо иногда и для линейных молекул (при замене L на модуль проекции момента количества движения на ось молекулы).
Правила Хунда зачастую нарушаются, поскольку на одно-конфигурационные модели атомов и молекул редко можно положиться. С появлением прецизионных экспериментальных данных о спектрах атомов они утрачивают свою значимость.
Периодичность изменения свойств элементов
Радиус атомов и ионов
Атомные радиусы применяются только в случае, когда атомы соединяются ковалентной или же металлической связью. Эта связь выполняется, если атомы приближаются друг к другу на расстояние, когда каждый атомный радиус приблизительно равняется радиусу максимума радиальной плотности заряда.
Ионные радиусы применяются только в случае, когда внешний электрон полностью удален с внешней орбитали электроотрицательного атома.
Сродство к Электрону
Термодинамическое определение сродства к электрону, стандартная энтальпия ∆ H 0 0 реакции ( 1 ) при абсолютном нуле температуры:
Наибольшее сродство к электрону имеют атомы галогенов. Для ряда элементов сродство к электрону близко к 0 или меньше 0. Последнее значит, что для данного элемента устойчивого отрицательного иона не существует.
Сродство к электрону определяет окислительную способность частицы. Молекулы с высокими значениями сродства к электрону являются сильными окислителями. При помощи них удалось получить химические соединения благородных газов, соединения внедрения в графите.
Электроотрицательность
Электроотрицательность – это величина, которая характеризует способность атома к поляризации ковалентных связей.
Для количественного описания электроотрицательности, помимо термохимических данных, применяют и данные о геометрии молекул (например, метод Сандерсона), спектральные характеристики (например, метод Горди).
Окислительно-восстановительные способности
Окислительно-восстановительный потенциал (редокс-потенциал от англ. “redox” – “reduction-oxidation reaction”, E h или E h ) – это мера способности химического вещества присоединять электроны (восстанавливаться).
тогда количественная зависимость окислительно-восстановительного потенциала от концентрации (вернее активностей) реагирующих веществ определяется по уравнению Нернста.
Энергия ионизации и ионизационный потенциал
Энергия ионизации – это вид энергии связи или, как еще иногда называют, первый ионизационный потенциал ( I 1 ) ; это наименьшая энергия, необходимая для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации представляет собой одну из основных характеристик атома, от которой существенно зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома в большей мере зависят также и восстановительные свойства соответствующего простого вещества.
У энергии ионизации всегда наблюдается эндо-энергетическое значение (чтобы оторвать электрон от атома, нужно приложить энергию, само собой это случиться не может).
На энергию ионизации атома наибольшее воздействие оказывают следующие факторы:
Энергия ионизации также зависит и от таких менее значительных факторов, как квантовомеханическое обменное взаимодействие, спиновая и зарядовая корреляция и пр.
Энергия ионизации элементов измеряется в Электрон-Вольт на 1 атом либо в Джоуль на 1 моль.
Что такое правило Хунда или принцип максимальной множественности?
Правило Хунда или принцип максимальной кратности эмпирически устанавливает, как вырожденные орбитальные электроны должны занимать энергию. Это правило, как указывает его единственное название, пришло от немецкого физика Фридриха Хунда в 1927 году, и с тех пор оно стало очень полезным в квантовой и спектроскопической химии..
Есть действительно три правила Хунда, применяемые в квантовой химии; тем не менее, первый является самым простым для базового понимания того, как электронно структурировать атом.
Первое правило Хунда, максимальное из множества, важно для понимания электронных конфигураций элементов; устанавливает, каким должен быть порядок электронов на орбиталях, чтобы генерировать атом (ион или молекулу) большей стабильности.
Первая и третья серии соответствуют правильным способам упорядочения электронов, а вторая и четвертая серии показывают, как электроны не должны размещаться на орбиталях..
Порядок заполнения орбиталей по правилу Хунда
Хотя не упоминается о двух других правилах Хунда, при правильном выполнении порядка заполнения подразумевается одновременное применение этих трех правил одновременно..
Что общего между первой и третьей сериями орбиталей на изображении? Почему они правы? Начнем с того, что каждая орбита может «удерживать» только два электрона, поэтому первый ящик завершен. Поэтому заполнение должно продолжаться с тремя прямоугольниками или орбиталями справа.
Спиновое соединение
Обратите внимание, что три электрона занимают разные орбитали, но с непарные спины.
Четвертая серия ящиков или орбиталей нарушает принцип исключения Паули, согласно которому ни один электрон не может иметь одинаковые четыре квантовых числа. Правило Хунда и принцип исключения Паули всегда идут рука об руку.
Поэтому стрелки должны быть расположены таким образом, чтобы они оставались распакованными до тех пор, пока не займут все коробки; и затем они заканчивают заполняться стрелками, указывающими в противоположном направлении.
Параллельные и антипараллельные спины
Недостаточно, чтобы спины электронов были спарены: они также должны быть параллельными. Это в представлении прямоугольников и стрелок гарантируется размещением последних так, чтобы их концы были параллельны друг другу.
Вторая серия представляет ошибку, что электрон в третьем боксе встречает свой антипараллельный спин относительно других.
Таким образом, можно резюмировать, что фундаментальное состояние атома является тем, которое подчиняется правилам Хунда, и, следовательно, имеет наиболее устойчивую электронную структуру.
Теоретическая и экспериментальная основа утверждает, что, когда атом имеет электроны с большим количеством неспаренных и параллельных спинов, он стабилизируется в результате увеличения электростатических взаимодействий между ядром и электронами; увеличение, что связано с уменьшением экранирующего эффекта.
множественность
Слово «множественность» упоминалось в начале, но что это значит в этом контексте? Первое правило Хунда гласит, что наиболее стабильным основным состоянием для атома является то, которое имеет наибольшее число спиновых множественностей; другими словами, тот, который представляет свои орбитали с наибольшим числом неспаренных электронов.
Формула для расчета кратности вращения
Где S равно числу неспаренных электронов, умноженному на 1/2. Таким образом, имея несколько электронных структур с одинаковым количеством электронов, 2S + 1 можно оценить для каждого, и что с наибольшим значением кратности будет наиболее стабильным.
Кратность спина можно рассчитать для первой серии орбиталей с тремя электронами с их неспаренными и параллельными спинами:
И множественность тогда
Это первое правило Хунда. Наиболее стабильная конфигурация также должна соответствовать другим параметрам, но для целей химического понимания не совсем необходимы.
обучение
плавиковый шпат
Вы должны сначала заполнить орбиту 2 с, а затем три орбитали р. Для заполнения 2s-орбитали двумя электронами достаточно разместить их таким образом, чтобы их спины были спарены.
Остальные пять электронов для трех 2p-орбиталей расположены, как показано ниже
Красная стрелка представляет последний электрон, который заполняет орбитали. Обратите внимание, что первые три электрона, которые входят в 2p-орбитали, расположены непарно и их спины параллельны.
титан
На этот раз было показано заполнение орбиты 4s. Поскольку на 3-х орбиталях есть только два электрона, практически нет проблем или путаницы при размещении их с непарными и параллельными спинами (синие стрелки).
железо
Если бы не правило Хунда и принцип исключения Паули, не было бы известно, как распорядиться такими шестью электронами на его пяти орбиталях..
Хотя это может показаться простым, без этих правил может возникнуть много неправильных возможностей в отношении порядка заполнения орбиталей..
Благодаря этому, это логично и однообразно продвижение золотой стрелки, которая не больше, чем последний электрон, который находится на орбитали.