Что такое правило вант гоффа
Вант-Гоффа правило
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °С до 100 °С). Я.Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза. Уравнение, которое описывает это правило следующее:
где V2-скорость реакции при данной температуре(T2), V1-скорость реакции при температуре T1, Y-температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиватся в 2 раза при повышении температуры на 10 градусов).
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Смотреть что такое «Вант-Гоффа правило» в других словарях:
Вант-Гоффа правило — ЭМБРИОЛОГИЯ ЖИВОТНЫХ ВАНТ ГОФФА ПРАВИЛО – изменение температуры (если оно не выходит за определенные для каждого вида животного рамки нормальных температур) не приводит к качественным изменениям в развитии, а лишь сказывается на темпе дробления … Общая эмбриология: Терминологический словарь
Вант-Гоффа правило — приближённое правило, согласно которому при повышении температуры на 10°С скорость химической реакции увеличивается примерно в 2 4 раза. Найдено Я. Х. Вант Гоффом. См. Кинетика химическая … Большая советская энциклопедия
Правило Вант-Гоффа — Правило Вант Гоффа эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант Гофф на… … Википедия
ПРАВИЛО ВАНТ-ГОФФА-АРРЕНИУСА — правило, сформулированное Вант Гоффом и дополненное Аррениусом, которое в биологической модификации гласит, что скорость обмена веществ организмов при повышении температуры на 10° может быть повышена в 2 3 раза. Экологический энциклопедический… … Экологический словарь
правило Вант-Гоффа — Правило Вант Гоффа: при повышении температуры на каждые 10° скорость большинства химических реакций увеличивается в 2 4 раза. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
правило Вант-Гоффа — van’t Hofo dėsnis statusas T sritis fizika atitikmenys: angl. Van’t Hoff law vok. Van’t Hoffsche Regel, f; Van’t Hoffsches Gesetz, m rus. закон Вант Гоффа, m; правило Вант Гоффа, m pranc. loi de Van’t Hoff, f … Fizikos terminų žodynas
правило Вант-Гоффа — van’t Hofo taisyklė statusas T sritis Standartizacija ir metrologija apibrėžtis Teiginys, kuriuo teigiama, kad padidinus temperatūrą 10 laipsnių reakcijos sparta padidėja nuo 2 iki 4 kartų. atitikmenys: angl. van’t Hoff law; van’t Hoff rule vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
правило Вант-Гоффа — van t Hofo taisyklė statusas T sritis chemija apibrėžtis Pakėlus temperatūrą 10 laipsnių reakcijos greitis padidėja 2–4 kartus. atitikmenys: angl. van t Hoff law; van t Hoff rule rus. правило Вант Гоффа … Chemijos terminų aiškinamasis žodynas
закон Вант-Гоффа — van’t Hofo dėsnis statusas T sritis fizika atitikmenys: angl. Van’t Hoff law vok. Van’t Hoffsche Regel, f; Van’t Hoffsches Gesetz, m rus. закон Вант Гоффа, m; правило Вант Гоффа, m pranc. loi de Van’t Hoff, f … Fizikos terminų žodynas
ПРАВИЛО — (1) буравчика определяет направление вектора напряжённости магнитного поля прямолинейного проводника с постоянным током. Если буравчик ввёртывается по направлению тока, то направление его вращения определяет направление магнитных силовых линий… … Большая политехническая энциклопедия
Правило Вант-Гоффа
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
где 




Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 o C. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Полезное
Смотреть что такое «Правило Вант-Гоффа» в других словарях:
правило Вант-Гоффа — Правило Вант Гоффа: при повышении температуры на каждые 10° скорость большинства химических реакций увеличивается в 2 4 раза. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
правило Вант-Гоффа — van’t Hofo dėsnis statusas T sritis fizika atitikmenys: angl. Van’t Hoff law vok. Van’t Hoffsche Regel, f; Van’t Hoffsches Gesetz, m rus. закон Вант Гоффа, m; правило Вант Гоффа, m pranc. loi de Van’t Hoff, f … Fizikos terminų žodynas
правило Вант-Гоффа — van’t Hofo taisyklė statusas T sritis Standartizacija ir metrologija apibrėžtis Teiginys, kuriuo teigiama, kad padidinus temperatūrą 10 laipsnių reakcijos sparta padidėja nuo 2 iki 4 kartų. atitikmenys: angl. van’t Hoff law; van’t Hoff rule vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
правило Вант-Гоффа — van t Hofo taisyklė statusas T sritis chemija apibrėžtis Pakėlus temperatūrą 10 laipsnių reakcijos greitis padidėja 2–4 kartus. atitikmenys: angl. van t Hoff law; van t Hoff rule rus. правило Вант Гоффа … Chemijos terminų aiškinamasis žodynas
ПРАВИЛО ВАНТ-ГОФФА-АРРЕНИУСА — правило, сформулированное Вант Гоффом и дополненное Аррениусом, которое в биологической модификации гласит, что скорость обмена веществ организмов при повышении температуры на 10° может быть повышена в 2 3 раза. Экологический энциклопедический… … Экологический словарь
Вант-Гоффа правило — Правило Вант Гоффа эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °С до 100 °С). Я.Х. Вант Гофф на основании множества… … Википедия
Вант-Гоффа правило — ЭМБРИОЛОГИЯ ЖИВОТНЫХ ВАНТ ГОФФА ПРАВИЛО – изменение температуры (если оно не выходит за определенные для каждого вида животного рамки нормальных температур) не приводит к качественным изменениям в развитии, а лишь сказывается на темпе дробления … Общая эмбриология: Терминологический словарь
Вант-Гоффа правило — приближённое правило, согласно которому при повышении температуры на 10°С скорость химической реакции увеличивается примерно в 2 4 раза. Найдено Я. Х. Вант Гоффом. См. Кинетика химическая … Большая советская энциклопедия
закон Вант-Гоффа — van’t Hofo dėsnis statusas T sritis fizika atitikmenys: angl. Van’t Hoff law vok. Van’t Hoffsche Regel, f; Van’t Hoffsches Gesetz, m rus. закон Вант Гоффа, m; правило Вант Гоффа, m pranc. loi de Van’t Hoff, f … Fizikos terminų žodynas
ПРАВИЛО — (1) буравчика определяет направление вектора напряжённости магнитного поля прямолинейного проводника с постоянным током. Если буравчик ввёртывается по направлению тока, то направление его вращения определяет направление магнитных силовых линий… … Большая политехническая энциклопедия
Правило Вант-Гоффа
Из Википедии — свободной энциклопедии
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Якоб Хендрик Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее:
V 2 = V 1 ⋅ γ T 2 − T 1 10 <\displaystyle V_<2>=V_<1>\cdot \gamma ^<\frac
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400 o C. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
γ = ( V 2 / V 1 ) 10 / ( T 2 − T 1 ) <\displaystyle \gamma =(V_<2>/V_<1>)^<10/(T_<2>-T_<1>)>>
Правило Вант-Гоффа. Температурный коэффициент скорости реакции
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2-4 раза.
Математически правило Вант-Гоффа выражается так:

где v(T2) и v(T1) — скорости реакций, соответственно при температурах Т2 и T1 (T2> T1);
γ-температурный коэффициент скорости реакции.
Значение γ для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2-4.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Поскольку скорость реакции и константа скорости химической реакции прямопропорциональны, то выражение (3.6) часто записывают в следующем виде:

где k(T2), k(T1)- константы скорости реакции соответственно
при температурах T2 и T1;
Пример 8. На сколько градусов надо повысить температуру, что бы скорость реакции возросла в 27 раз? Температурный коэффициент реакции равен 3.
Решение. Используем выражение (3.6):

Получаем: 27 = 

Ответ: на 30 градусов.
Скорость реакции и время, за которое она протекает, связаны обратно пропорциональной зависимостью: чем больше v, тем
меньше t. Математически это выражается соотношением

Пример 9. При температуре 293 К реакция протекает за 2 мин. За какое время будет протекать эта реакция при температуре 273 К, если γ = 2.
Решение. Из уравнения (3.8) следует:

Используем уравнение (3.6), поскольку 

Правило Вант-Гоффа применимо для ограниченного числа химических реакций. Влияние температуры на скорость процес-сов чаще определяют по уравнению Аррениуса.
Уравнение Аррениуса. В 1889 г. шведский ученый С. Арре-1иус на основании экспериментов вывел уравнение, которое на-звано его именем

где k — константа скорости реакции;
k0 — предэксноненциальный множитель;
е — основание натурального логарифма;
Ea — постоянная, называемая энергией активации, определяемая природой реагентов:
R-универсальная газовая постоянная, равная 8,314 Дж/моль×К.
Значения Еa для химических реакций лежат в пределах 4 — 400 кДж/моль.
Многие реакции характеризуются определенным энергети-ческим барьером. Для его преодоления необходима энергия актации — некоторая избыточная энергия (по сравнению со вредней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным, т. е. привело бы к образованию нового ве-щества. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
В общем случае, если температура реакции изменяется от Т1 до Т2, уравнение (3.9) после логарифмирования примет вид:

Это уравнение позволяет рассчитывать энергию активации реакции при изменении температуры от Т1 до Т2.
Скорость химических реакций возрастает в присутствии катализатора. Действие катализатора заключается в том, что он образует с реагентами неустойчивые промежуточные соединения (активированные комплексы), распад которых приводит к. образованию продуктов реакции. При этом энергия активации, понижается, и активными становятся молекулы, энергия которых была недостаточна для осуществления реакции в отсутствие, катализатора. В результате возрастает общее число активных£ молекул и увеличивается скорость реакции.
Изменение скорости реакции в присутствии катализатора выражается следующим уравнением:

где vкат, и Ea(кат) — скорость и энергия активации химической реакции в присутствии катализатора;
v и Еа — скорость и энергия активации химической реакции без катализатора.
Пример 10. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, с катализатором — 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при температуре 298 К? Решение. Воспользуемся уравнением (3.11). Подставляя в уравнение данные
Еа = 75,24 кДж / моль = 75,24 ×103 Дж / моль и
Еа(кат)=- 50,14 кД/моль= 50,14 ×103 Дж /моль, получим
Окончательно находим:
Таким образом, снижение энергии активации на 25,1 кДж/моль привело к увеличению скорости реакции в 25 000 раз.
ВАНТ-ГОФФА ПРАВИЛО
ВАНТ-ГОФФА ПРАВИЛО. Почти все химические реакции при повышении температуры идут быстрее. Зависимость скорости реакции от температуры описывается уравнением Аррениуса:
Однако из уравнения Аррениуса следует, что температурный коэффициент реакции зависит как от энергии активации, так и от абсолютной температуры. Для данной реакции с определенным значением Еа ускорение при повышении температуры на 10° будет тем больше, чем ниже температура. Это почти очевидно и без расчетов: повышение температуры от 0 до 10° С должно сказаться на скорости реакции значительно сильнее, чем такое же повышение температуры, например, от 500 до 510° С.
С другой стороны, для данного температурного интервала ускорение реакции будет тем сильнее, чем больше ее энергия активации. Так, если энергия активации реакции мала, то такая реакция идет очень быстро, и при повышении температуры на 10° С ее скорость почти не изменяется. Для таких реакций температурный коэффициент намного меньше 2. Для реакций же с большой энергией активации, которые при невысоких температурах идут медленно, ускорение при повышении температуры на 10° С может значительно превысить 4-кратное.
Например, реакция диоксида углерода со щелочным раствором с образованием гидрокарбонат-иона (СО2 + ОН® НСО3 – ) имеет энергию активации 38,2 кДж/моль, поэтому при повышении температуры, например, от 50 до 60° С эта реакция ускорится всего в 1,5 раза. В то же время реакция распада этилбромида на этилен и бромоводород (С2Н5Вr ® С2Н4 + НВr) с энергией активации 218 кДж/моль ускорится при повышении температуры от 100 до 110 o С в 6,3 раза (правда, в этом интервале температур реакция идет очень медленно). Кинетика реакции атомов водорода с этаном H + C2H6 ® H2 + C2H5 была изучены в широком температурном интервале – от 300 до 1100 К (27–827° С). Для этой реакции Eа = 40,6 кДж/моль. Следовательно, повышение температуры на 10° вызовет увеличение скорости реакции в 1,7 раза в интервале 300–310 K и только в 1,04 раза в интервале 1090–1100 K. Так что при высоких температурах скорость этой реакции практически не зависит от температуры. А для реакции присоединения атома водорода к двойной связи H + C2H4 ® C2H5 энергия активации мала (Eа = 3,4 кДж/моль, так что ее скорость слабо зависит от температуры в широком температурном интервале. И только при температурах намного ниже 0° С начинает сказываться наличие активационного барьера.
Подобных примеров можно привести множество. Очевидно, что правило Вант-Гоффа противоречит не только уравнению Аррениуса, но и многим экспериментальным данным. Откуда же оно взялось и почему нередко выполняется?
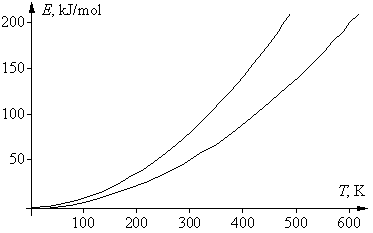
Если посмотреть, какие реакции «укладываются» в указанную довольно узкую область, то окажется, что все эти реакции идут не слишком быстро и не слишком медленно, а с удобной для измерения (при данной температуре) скоростью. Скорость только таких реакций и могли изучать химики во времена Вант-Гоффа. Например, если энергия активации была невелика (меньше 50 кДж/моль), то такая реакция при комнатной температуре заканчивалась за 1–2 секунды; поэтому для изучения ее кинетики следовало значительно понизить температуру, чтобы реакция проходила не быстрее, чем за 10–20 минут. Только в этом случае химики 19 в. успевали отбирать пробы по ходу реакции и анализировать изменение в них концентрации реагентов. Других способов изучения скорости реакции в то время не было. Если это не удавалось (например, водный раствор замерзал), то скорость такой реакции не изучали. Если же энергия активации реакции была велика и при комнатной температуре она шла слишком медленно (многие сутки, или даже недели), то температуру повышали, чтобы реакция шла с удобной для измерения скоростью. И здесь были свои ограничения – например, раствор мог закипеть, т.е. в любом случае исследователи фактически «подстраивали» изучаемую реакцию под область между двумя параболами.
Сейчас химики имеют возможность с помощью различных приборов экспериментально изучать и очень быстрые (идущие в микросекундной области), и очень медленные реакции, для которых температурный коэффициент может быть значительно меньше 2 или значительно больше 4. Поэтому правило Вант-Гоффа, которое, в отличие от уравнения Аррениуса, не имеет четкого физического смысла, представляет лишь чисто исторический интерес и в современной науке не используется. В подавляющем большинстве учебников и монографий по химической кинетике, а также в 5-томной Химической Энциклопедии это правило даже не упоминается. И, тем не менее, если изучаемая реакция идет с удобной для измерения скоростью, например, заканчивается за 30–40 мин, а энергия активации ее еще не измерена, то для предварительной грубой оценки зависимости скорости такой реакции от температуры можно использовать правило Вант-Гоффа. Поэтому это правило приводится во всех школьных учебниках химии.