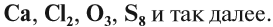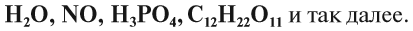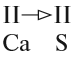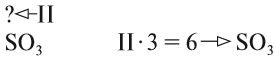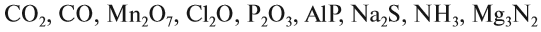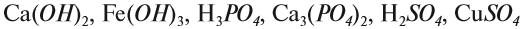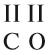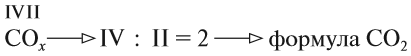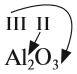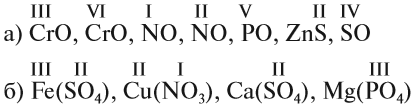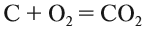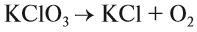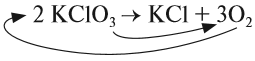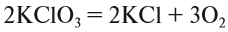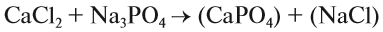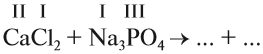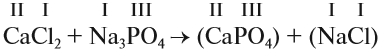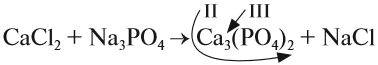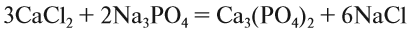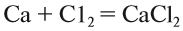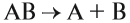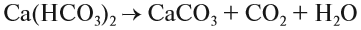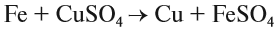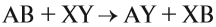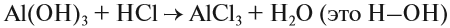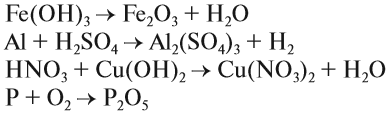Что такое предмет химии 8 класс
Предмет химии. вещества
Урок 1. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Предмет химии. вещества»
Химия играет огромную роль в жизни современного человека, как в его быту, так и в промышленности. Химия – это наука о веществах, их свойствах и превращениях.
На рисунке представлены физические тела. Их объединяет одно свойство – все они сделаны из стекла. Стекло и является веществом. Поэтому можно сделать вывод, что вещество – это то, из чего состоят физические тела.
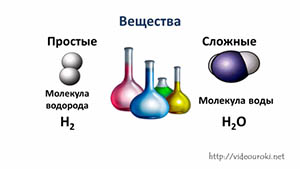
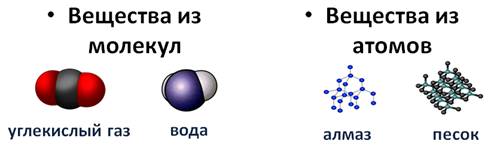
Некоторые вещества состоят из молекул. Такие как молекула углекислого газа, молекула воды, а такие вещества как алмаз или песок, состоят из атомов.
Представьте, атомы настолько малы, что на человеческом волосе их поместиться несколько миллиардов. Однако видов атомов всего 114. Определенный вид атомов называется химическим элементом.
Из таких вот отдельных изолированных атомов состоят такие вещества как ксенон, аргон, неон, криптон, гелий. Их еще называют благородными или инертными газами, потому что их атомы не соединяются друг с другом и почти не соединяются с атомами другими химических элементов.
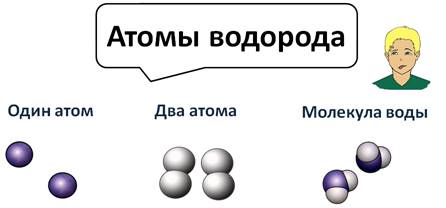
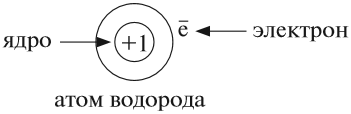
Атомы водорода могут существовать поодиночке, могут соединяться в молекулы по два атома, а могут соединяться с другими атомами, как в молекуле воды они соединены с кислородом.
Таким образом, если вещество состоит из атомов одного вида, то оно называется простым. А если вещество состоит из атомов разных химических элементов, то оно называется сложным, или химическим соединением. Например, это молекула воды – Н2О.
Все вещества отличаются друг от друга своими свойствами. Свойства – это признаки, по которым вещества отличаются друг от друга.
Следует различать физические и химические свойства веществ. С химическими свойствами мы познакомимся позже.
Физические свойства вещества:
1. Агрегатное состояние (их три: газообразное, жидкое и твёрдое).
3. Запах (есть или нет).
4. Твердость (описывается по шкале Мооса).
5. Плотность (больше или меньше единицы).
6. Температура кипения и плавления (эти данные указаны в таблицах в учебнике).
7. Электропроводность и теплопроводность (в основном это свойство характерно для металлов).
8. Растворимость в воде (т.е. растворяется вещество или не растворяется в воде).
9. Пластичность, ковкость (это свойство тоже характерно в основном для металлов).
Зная различные свойства веществ, человек может использовать их с пользой для себя. Рассмотрим пример использования алюминия.
Благодаря легкости и прочности его используют в самолёто- и ракетостроении. Лёгкость и хорошую электропроводность алюминия используют для изготовления электрических проводов, его теплопроводность и неядовитость – при изготовлении алюминиевой посуды, неядовитость и пластичность даёт возможность применять алюминий для изготовления фольги, а такое его свойство, как способность гореть ослепительным пламенем позволят его использовать при производстве бенгальских огней.
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
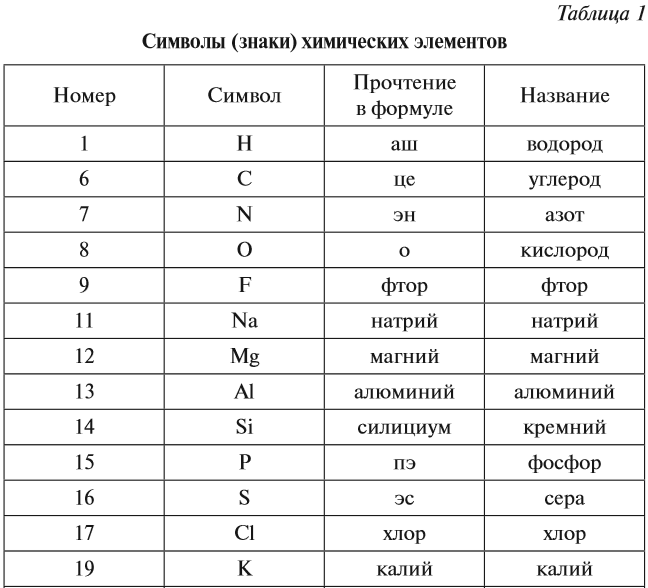
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
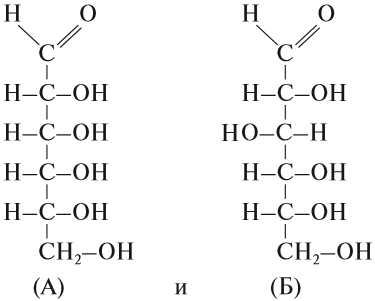
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
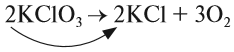
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
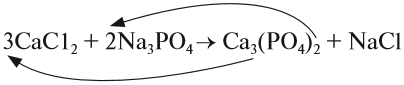
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Конспект 1 урока в 8 классе Предмет химии
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
ТЕМА 1. ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
УРОК 1. Предмет химии. Химия как часть естествознания. Вещества и их свойства
Цель урока. Сформировать представления о химии как науке, о месте химии среди других наук, о роли химии в жизни и хозяйственной деятельности человека.
Основные понятия. Химия, вещество, тело, свойства веществ.
Планируемые результаты обучения
Предметные. Знать определение предмета химии. Уметь различать вещества и физические тела. Выявлять черты сходства и различия различных веществ.
Метапредметные. Уметь понимать проблему, ставить вопросы, выдвигать гипотезы. Развивать умения самостоятельно работать с различными информационными ресурсами, формулировать выводы.
Личностные. Формировать: мотивацию к целенаправленной познавательной деятельности; понимание ценности здорового и безопасного образа жизни; основы экологической культуры.
Основные виды деятельности учащихся. Различать предметы изучения естественных наук. Описывать физические свойства веществ.
Демонстрации. Примеры тел и веществ из школьной лаборатории.
Лабораторный опыт. Рассмотрение веществ с различными физическими свойствами.
Тип урока: урок изучения нового материала и первичного закрепления знаний.
Форма урока : беседа с демонстрационными и лабораторными опытами.
Оборудование: раздаточный материал (опорный конспект), карточки с вопросами викторины и описанием веществ, листы ватмана, таблички с изображением атомов разных видов, цветные карточки-смайлики, оборудование и реактивы для демонстрационного опыта (дихромат аммония, спирт, лучина, спички, асбестовая сетка), компьютер, мультимедийный проектор.
Организационный момент. Знакомство с классом.
Учитель: откройте учебник § 10 на стр.37 и выясните, какие рубрики есть в параграфе («Важная информация», «Определение», «Лабораторный опыт», дополнительный текст для любознательных, «Основные понятия», «Подумай, ответь, выполни», «Тестовые задания», «Личный результат»).
1. С какой целью материал в параграфе разделён на отдельные рубрики?
2. Какой материал помещён в каждой рубрике?
Учитель : вспомните, как переводятся слова: «география», «геометрия», «биология», а как переводится слово «химия»?
а) Хми (египетск.) – «черная» земля. Древнее название Египта, где зародилась наука химия.
б) Кеме (египетск.) – «черная» наука. Алхимия как темная, дьявольская наука (сравнить с чернокнижием – колдовством, основанным на действии нечистой силы).
в) Хюма (древнегреч.) – «литье» металлов; того же корня и греческое хюмос – «сок».
г) Ким (древнекитайск.) – «золото». Тогда химию можно толковать как «златоделие».
Учитель : скажите, что изучает химия?
Стадия вызова (ликвидация чистого листа):
Учитель : ребята, сегодня мы приступаем к изучению нового для вас предмета – химии. Новый материал запоминается легче, если он нанизывается на уже полученные знания. Поэтому сейчас предстоит работа с извлечением этого материала из памяти.
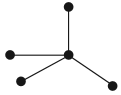
— и ндивидуальная работа – в течение 1 минуты ребята индивидуально в тетради составляют кластер “Что я сам знаю о химии? ” (рис.1) :

— работа в группах – в течение 5 минут ребята рассказывают о своих ассоциациях учащимся группы (группа по 4 человека), дополняют свой кластер новыми понятиями.
— « защита схемы » – каждая группа представляет свою схему учащимся других групп (четверть ватмана) и отвечает на вопрос «Что мы вместе знаем о химии?». Составляем единый кластер на доске (каждая группа рассказывает по одной ассоциации, не повторяясь, один ученик записывает ключевые слова на доске) – 5 минут.
Ребята маркируют текст и дополняют свой кластер новыми понятиями.
После маркировки текста вместе с учителем обсуждаем опорный конспект – ключевые определения, дополняем кластер на доске.
Вопросы викторины “Такая ли уж сложная химия?”
• Почему мы дуем на спичку, когда хотим ее потушить?
(В выдыхаемом воздухе содержится СО 2 .)
• Почему горящий бензин нельзя тушить водой?
(Бензин легче воды и не смешивается с ней.)
• Как пронести в ладошке 1 литр воды, не пролив ни капли?
• Что теплее: три рубашки или рубашка тройной толщины?
• В каком море нельзя утонуть? Почему?
(В Мертвом море, оно очень соленое.)
• Что тяжелее: 1 кг железа или 1 кг ваты?
• Из 1 г какого металла можно вытянуть проволоку длиной 2,5 км?
• Можно ли заполнить воздухом только половину баллона?
• Что означает выражение “как с гуся вода”?
(Перья водоплавающих птиц не смачиваются водой.)
• Соединения какого металла придают планете Марс красный оттенок?
• Три одинаковые горящие свечи одновременно накрыли тремя банками емкостью 0,4 л, 0,6 л и 1 л. Что при этом произойдет?
(Свеча погаснет тем раньше, чем меньше объем банки.)
Учитель : вспомните, что означает понятие «вещество», известное им из курса физики.
Демонстрируя вещества и тела из школьной лаборатории, он предлагает учащимся объяснить, чем различаются понятия «вещество» и «тело». Далее учитель вводит понятие «свойства веществ» и рассматривает с учащимися физические свойства веществ: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло- и электропроводимость, температуры плавления и кипения. Затем учащиеся выполняют лабораторный опыт (с. 5 учебника) и сравнивают свойства веществ, т. е. выявляют черты сходства и различия в свойствах конкретных веществ. Учитель просит учащихся сформулировать вывод по лабораторному опыту (чему научились в результате выполнения опыта) и сравнить его с содержанием рубрики «Личный результат». Учитель обращает внимание учащихся на то, что в этой рубрике приведены главные умения, которыми должен овладеть каждый в результате изучения того или иного параграфа.
По ходу обсуждения закрепляем полученную информацию через выполнение тренировочных упражнений (10 минут):
вещества физические тела
На экране показываем изображения веществ и физических тел (карандаш, уголь, чашка, дерево, вода, алюминий, вилка, парта, гвоздь, железо, кольцо, золото, сода, пластмасса, хрусталь)
Учащиеся выходят все из одного ряда и записывают каждое название в соответствующий столбик. В заключение упражнения: подытожить – что такое вещество (то, из чего состоят физические тела).
2) свойства веществ: демонстрационный опыт – «извержение вулкана»
Обсуждение : каким свойствами обладает вещество – дихромат аммония (оранжевый цвет, твердое, сыпучее, блеск, при нагревании разлагается).
С тадия рефлексии (5 минут).
В завершение поделитесь своими впечатлениями об уроке. Для этого допишите предложения, посвященные сегодняшнему дню.
Сегодня я узнал ____________________________________________
Я удивился _________________________________________________
Я хотел бы ______________________________________________
4. Анализ настроения учащихся после урока : при выходе из класса учащиеся проходят через учительский стол, берут цветные карточки-смайлики (рис.2) и кладут их на чашу весов с аналогичной рожицей. Анализируем, какое настроение учащихся перевешивает.


Литература и источники:
1. Учитель химии МБОУ “Средняя общеобразовательная школа №26” г. Калуги Тесник Юлия Валерьевна
2. С.И.АБРАМОВА, учитель химии средней школы № 2 (г. Лихославль, Тверская обл.)
Хозяин своей жизни тот, кто способен преодолевать свои настроения.
Химия – это наука о веществах, их свойствах и превращениях. А что же такое вещество?
Различные вещества отличаются друг от друга своими свойствами.
Свойства веществ – это признаки, по которым одни вещества отличаются от других. Например, мы можем отличить железо от воды по их свойствам.

_______________ ____________ _____________

_______________ ____________ _____________




_______________ ____________ _____________

Ф.И.О. __________________________ ____ класс
Ф.И.О. __________________________ ____ класс
1. Любой предмет, нас окружающий – это:
а) физическое тело; б) вещество
2. Стеклянная ваза, стеклянный стакан, стеклянная колба – это: а) тела; б) вещества.
а) то, из чего состоит физическое тело;
б) любой предмет нас окружающий.
4. В каком из предложений, приведенном ниже, речь идет о стекле как о физическом теле?
а) он разбил оконное стекло;
б) ваза сделана из стекла.
5. Свойства вещества – это:
а) признаки, по которым вещества сходны или отличаются друг от друга;
7. Выберите простое вещество:
а) кислород б) вода в) серная кислота
8. Выберите смесь веществ:
а) воздух б) оксид магния в) алюминий
1. Любой предмет, нас окружающий – это:
а) физическое тело; б) вещество
2. Стеклянная ваза, стеклянный стакан, стеклянная колба – это: а) тела; б) вещества.
а) то, из чего состоит физическое тело;
б) любой предмет нас окружающий.
4. В каком из предложений, приведенном ниже, речь идет о стекле как о физическом теле?
а) он разбил оконное стекло;
б) ваза сделана из стекла.
5. Свойства вещества – это:
а) признаки, по которым вещества сходны или отличаются друг от друга;
7. Выберите простое вещество:
а) кислород б) вода в) серная кислота
8. Выберите смесь веществ:
а) воздух б) оксид магния в) алюминий

_______________ ____________ _____________

_______________ ____________ _____________

_______________ ____________ _____________

_______________ ____________ _____________

_______________ ____________ _____________
Домашнее задание : Выучить определения §1-2, стр.3-13.

_______________ ____________ _____________

_______________ ____________ _____________

_______________ ____________ _____________

_______________ ____________ _____________

_______________ ____________ _____________
Домашнее задание : Выучить определения §1-2, стр.3-13.
Хозяин своей жизни тот, кто способен преодолевать свои настроения.
Химия – это наука о веществах, их свойствах и превращениях. А что же такое вещество?
Различные вещества отличаются друг от друга своими свойствами.
Свойства веществ – это признаки, по которым одни вещества отличаются от других. Например, мы можем отличить железо от воды по их свойствам.
Хозяин своей жизни тот, кто способен преодолевать свои настроения.
Химия – это наука о веществах, их свойствах и превращениях. А что же такое вещество?
Различные вещества отличаются друг от друга своими свойствами.
Свойства веществ – это признаки, по которым одни вещества отличаются от других. Например, мы можем отличить железо от воды по их свойствам.