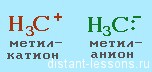Что такое радикальное замещение
Радикальное замещение: описание реакции, особенности, пример
В химии радикальным замещением называют реакции, в которых свободные радикалы атакуют молекулу вещества, замещая собой отдельные ее атомы. При реакции замещения образуются новые радикалы. Цепная реакция продолжается до момента, когда иссякнут все свободные радикалы.
Определение радикала
Радикал – это атом или молекула, имеющие на внешнем электронном слое один или более неспаренных электронов. То есть таких электронов, у которых нет пары. Радикал может образоваться, когда молекула приобретает один электрон или наоборот, теряет его. В своем большинстве свободные радикалы нестабильны, так как их внешний электронный слой не завершен. Поэтому радикалы легко вступают в реакции с некоторыми веществами, образуя при этом новые вещества и свободные радикалы.
Какими бывают радикалы?
Основные группы, по которым происходит классификация радикалов:
Стабильные радикалы
Обычно радикалы «живут» мало и спешат скорее вступить в реакцию. Такие радикалы существуют секунды или доли секунд и называются нестабильными. Но есть те, что отличаются стабильностью, период существования их может достигать нескольких лет. В неорганической химии к стабильным относят O3, NO, ClO2, NO2 и другие. В разделе же органической больше стабильных радикалов. Их делят на несколько групп:

Механизм реакции радикального замещения
В механизме реакции выделяют три стадии:
Типичные реакции замещения
Алканы
Алканы – насыщенные углеводороды, содержащие только простые связи. Общая формула алканов – CnH2n+2. Насыщенными называются те углеводороды, которые содержат максимальное количество атомов водорода. Ранее алканы называли парафинами из-за того, что эти вещества не реагировали с кислотами, щелочами и т. д. На самом деле устойчивость к взаимодействию с сильными реагентами объясняется прочностью С-С и С-Н связей. Насыщенность алканов также говорит о том, что они не участвуют в реакциях присоединения. Для них характерны реакции разложения, замещения и прочие.
Галогены
Чтобы провести реакцию радикального замещения, нужно дать определение галогенам. Галогены – это элементы 17-й группы таблицы Менделеева. Галогенами являются Cl (хлор), I (йод), F (фтор), Br (бром) и At (астат). Все галогены являются неметаллами и сильными окислителями. Самую высокую окислительную активность имеет фтор, а самую низкую – астат. В процессе галогенирования алканов один или больше атомов водорода в веществе заменяется на галоген.
Механизм замещения на примере галогенирования метана
Зарождение цепи. Под воздействием солнечного, ультрафиолетового излучения или от нагревания молекула хлора Cl2 распадается на два свободных радикала. У каждого один неспаренный электрон на внешнем слое.
Развитие или рост цепи. Взаимодействуя с молекулами метана, свободные радикалы образуют новые и продолжают цепь превращений.
СН3 + Cl2 → СН3Cl + Cl
Далее реакция идет до тех пор, пока не исчезнут все свободные радикалы.
Обрыв цепи – заключительная стадия радикального замещения алканов. Радикалы соединяются друг с другом и образуют новые молекулы.
СН3· + ·СН3 → СН3 – СН3
Хлорирование метана
Под действием солнечного света радикалы хлора замещают все атомы водорода в метане. Для полного замещения водорода доля хлора в смеси должна быть достаточной. Таким образом, из метана может получиться четыре его производных:
CHCl3 – трихлорметан (хлоформ).
Галогенирование других алканов
Начиная с пропана (С3Н8) у алканов появляются третичные и вторичные атомы углерода. Галогенирование разветвленных алканов может давать разные результаты. В результате реакции радикального замещения образуются изомеры алканов. Масса каждого получившегося вещества может сильно различаться в зависимости от температуры.
При термическом галогенировании состав получившегося продукта определяется исходя из соотношения количества С―Н–связей атомов углерода, которые в сложных алканах бывают первичными, вторичными и третичными. В результате фотохимического галогенирования состав получившихся продуктов будет зависеть от скорости, с которой атомы галогена сменяют атомы водорода. Галогенам легче всего встать на место третичного атома водорода. Сложнее заместить вторичный и первичный.
Хлорирование пропана
При хлорировании пропана с катализатором в виде повышения температуры до 450 ⁰С образуются 2-хлорпропан в количестве 25 % и 1-хлорпропан в количестве 75 %.
2СН3СН2СН3 + 2Cl2 → СН3СН(Cl)СН3 + СН3СН2СН2Cl + 2HCl
Если проводить реакцию радикального замещения алкана с помощью солнечного света, выходит 57 % 2-хлорпропана и 43 % 1-хлорпропана.
Реакции окисления
В реакциях окисления алканов опять же участвуют свободные радикалы. В этом случае радикал О2 присоединяется к молекуле алкана, и происходит реакция полного или неполного окисления. Полное окисление называется горением:
СН4 + 2О2 → СО2 + 2Н2О
Реакция горения алканов по механизму радикального замещения широко используется в промышленности как топливо для ТЭЦ, для двигателей внутреннего сгорания. В такие машинные двигатели можно помещать только разветвленные алканы. Простые линейные алканы в ДВС взрываются. Из нелетучего осадка, образовавшегося в результате радикального замещения, производят смазки, асфальт, парафин и т. д.
Частичное окисление
В промышленности смеси, которые образуются при частичном окислении метана, используются для изготовления синтетических алканов. Из метана при неполном окислении воздухом можно получить метиловый спирт (СН3ОН), формальдегид (НСНО), муравьиную кислоту (НСООН). А при окислении бутана в промышленности вырабатывается уксусная кислота:
2С4Н10 + 5О2 → 4СН3СООН + 2Н2О
Для того чтобы алканы окислялись частично, используют катализаторы (Со2+, Mn2+и т. д.) при сравнительно невысоких температурах воздуха.
Радикальное замещение: описание реакции, особенности, пример
В химии радикальным замещением называют реакции, в которых свободные радикалы атакуют молекулу вещества, замещая собой отдельные ее атомы. При реакции замещения образуются новые радикалы. Цепная реакция продолжается до момента, когда иссякнут все свободные радикалы.
Определение радикала
Радикал – это атом или молекула, имеющие на внешнем электронном слое один или более неспаренных электронов. То есть таких электронов, у которых нет пары. Радикал может образоваться, когда молекула приобретает один электрон или наоборот, теряет его. В своем большинстве свободные радикалы нестабильны, так как их внешний электронный слой не завершен. Поэтому радикалы легко вступают в реакции с некоторыми веществами, образуя при этом новые вещества и свободные радикалы.
Какими бывают радикалы?
Основные группы, по которым происходит классификация радикалов:
Стабильные радикалы
Обычно радикалы «живут» мало и спешат скорее вступить в реакцию. Такие радикалы существуют секунды или доли секунд и называются нестабильными. Но есть те, что отличаются стабильностью, период существования их может достигать нескольких лет. В неорганической химии к стабильным относят O3, NO, ClO2, NO2 и другие. В разделе же органической больше стабильных радикалов. Их делят на несколько групп:

Механизм реакции радикального замещения
В механизме реакции выделяют три стадии:
Типичные реакции замещения
Алканы
Алканы – насыщенные углеводороды, содержащие только простые связи. Общая формула алканов – CnH2n+2. Насыщенными называются те углеводороды, которые содержат максимальное количество атомов водорода. Ранее алканы называли парафинами из-за того, что эти вещества не реагировали с кислотами, щелочами и т. д. На самом деле устойчивость к взаимодействию с сильными реагентами объясняется прочностью С-С и С-Н связей. Насыщенность алканов также говорит о том, что они не участвуют в реакциях присоединения. Для них характерны реакции разложения, замещения и прочие.
Галогены
Чтобы провести реакцию радикального замещения, нужно дать определение галогенам. Галогены – это элементы 17-й группы таблицы Менделеева. Галогенами являются Cl (хлор), I (йод), F (фтор), Br (бром) и At (астат). Все галогены являются неметаллами и сильными окислителями. Самую высокую окислительную активность имеет фтор, а самую низкую – астат. В процессе галогенирования алканов один или больше атомов водорода в веществе заменяется на галоген.
Механизм замещения на примере галогенирования метана
Зарождение цепи. Под воздействием солнечного, ультрафиолетового излучения или от нагревания молекула хлора Cl2 распадается на два свободных радикала. У каждого один неспаренный электрон на внешнем слое.
Развитие или рост цепи. Взаимодействуя с молекулами метана, свободные радикалы образуют новые и продолжают цепь превращений.
СН3 + Cl2 → СН3Cl + Cl
Далее реакция идет до тех пор, пока не исчезнут все свободные радикалы.
Обрыв цепи – заключительная стадия радикального замещения алканов. Радикалы соединяются друг с другом и образуют новые молекулы.
СН3· + ·СН3 → СН3 – СН3
Хлорирование метана
Под действием солнечного света радикалы хлора замещают все атомы водорода в метане. Для полного замещения водорода доля хлора в смеси должна быть достаточной. Таким образом, из метана может получиться четыре его производных:
CHCl3 – трихлорметан (хлоформ).
Галогенирование других алканов
Начиная с пропана (С3Н8) у алканов появляются третичные и вторичные атомы углерода. Галогенирование разветвленных алканов может давать разные результаты. В результате реакции радикального замещения образуются изомеры алканов. Масса каждого получившегося вещества может сильно различаться в зависимости от температуры.
При термическом галогенировании состав получившегося продукта определяется исходя из соотношения количества С―Н–связей атомов углерода, которые в сложных алканах бывают первичными, вторичными и третичными. В результате фотохимического галогенирования состав получившихся продуктов будет зависеть от скорости, с которой атомы галогена сменяют атомы водорода. Галогенам легче всего встать на место третичного атома водорода. Сложнее заместить вторичный и первичный.
Хлорирование пропана
При хлорировании пропана с катализатором в виде повышения температуры до 450 ⁰С образуются 2-хлорпропан в количестве 25 % и 1-хлорпропан в количестве 75 %.
2СН3СН2СН3 + 2Cl2 → СН3СН(Cl)СН3 + СН3СН2СН2Cl + 2HCl
Если проводить реакцию радикального замещения алкана с помощью солнечного света, выходит 57 % 2-хлорпропана и 43 % 1-хлорпропана.
Реакции окисления
В реакциях окисления алканов опять же участвуют свободные радикалы. В этом случае радикал О2 присоединяется к молекуле алкана, и происходит реакция полного или неполного окисления. Полное окисление называется горением:
СН4 + 2О2 → СО2 + 2Н2О
Реакция горения алканов по механизму радикального замещения широко используется в промышленности как топливо для ТЭЦ, для двигателей внутреннего сгорания. В такие машинные двигатели можно помещать только разветвленные алканы. Простые линейные алканы в ДВС взрываются. Из нелетучего осадка, образовавшегося в результате радикального замещения, производят смазки, асфальт, парафин и т. д.
Частичное окисление
В промышленности смеси, которые образуются при частичном окислении метана, используются для изготовления синтетических алканов. Из метана при неполном окислении воздухом можно получить метиловый спирт (СН3ОН), формальдегид (НСНО), муравьиную кислоту (НСООН). А при окислении бутана в промышленности вырабатывается уксусная кислота:
2С4Н10 + 5О2 → 4СН3СООН + 2Н2О
Для того чтобы алканы окислялись частично, используют катализаторы (Со2+, Mn2+и т. д.) при сравнительно невысоких температурах воздуха.
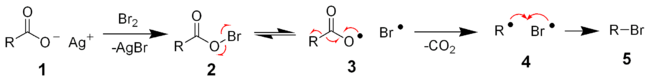
Реакции радикального замещения
Реакции радикального замещения (англ. substitution radical reaction ) — реакции замещения, в которых атаку осуществляют свободные радикалы — частицы, содержащие один или несколько неспаренных электронов.
Реакции радикального замещения обозначают SR.
Содержание
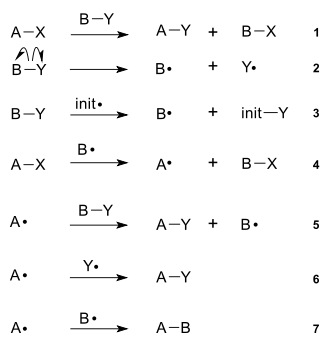
Механизм радикального замещения
2. Вторая стадия (4,5) — развитие цепи. На этой стадии радикалы реагируют с молекулами, образуя продукты реакции и новые радикалы.
3. Третья стадия (6,7) — обрыв цепи или рекомбинация свободных радикалов.
Реакции радикального замещения ускоряются в условиях генерирования свободных радикалов и замедляются в присутствии веществ, улавливающих свободные радикалы.
Типовые реакции радикального замещения
Радикальное галогенирование
Инициация галогенирования, обычно, происходит под действием облучения:
Радикальное окисление
При низких температурах в присутствии кислорода воздуха, света, а также иногда следов некоторых металлов органические соединения вступают в реакции автоокисления [2] :
Прочие реакции радикального замещения
Примечания
 Химические реакции в органической химии Химические реакции в органической химии | |
|---|---|
| Реакции замещения | Реакции нуклеофильного замещения · Реакции электрофильного замещения · Реакции радикального замещения |
| Реакции присоединения | Реакции нуклеофильного присоединения · Реакции электрофильного присоединения · Реакции радикального присоединения · Реакции синхронного присоединения |
| Реакции элиминирования | Реакции гетеролитического элиминирования · Реакции перициклического элиминирования · Реакции радикального элиминирования |
| Реакции перегруппировки | Нуклеофильные перегруппировки · Электрофильные перегруппировки · Радикальные перегруппировки |
| Реакции окисления и восстановления | Реакции окисления · Реакции восстановления |
| Прочее | Именные реакции в органической химии |
Полезное
Смотреть что такое «Реакции радикального замещения» в других словарях:
Реакции нуклеофильного замещения — (англ. nucleophilic substitution reaction) реакции замещения, в которых атаку осуществляет нуклеофил реагент, несущий неподеленную электронную пару.[1] Уходящая группа в реакциях нуклеофильного замещения называется нуклеофуг. Все … Википедия
Реакции электрофильного замещения — (англ. substitution electrophilic reaction) реакции замещения, в которых атаку осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. При образовании новой связи уходящая частица электрофуг … Википедия
Реакции радикального присоединения — (англ. addition radical reaction) реакции присоединения, в которых атаку осуществляют свободные радикалы частицы, содержащие один или несколько неспаренных электронов. При этом радикалы могут атаковать как другие радикалы, так и… … Википедия
Реакции замещения — (англ. substitution reaction) химические реакции, в которых одни функциональные группы, входящие в состав химического соединения, меняются на другие группы. Реакции замещения обозначают английской буквой «S». Общий вид реакций… … Википедия
Реакции присоединения — (англ. addition reaction) в органической химии так называются химические реакции, в которых одни химические соединения присоединяются к кратным (двойным или тройным) связям другого химического соединения. Присоединение может… … Википедия
Реакции электрофильного присоединения — (англ. addition electrophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет электрофил частица, заряженная положительно или имеющая дефицит электронов. На конечной стадии образующийся… … Википедия
Реакции нуклеофильного присоединения — (англ. addition nucleophilic reaction) реакции присоединения, в которых атаку на начальной стадии осуществляет нуклеофил частица, заряженная отрицательно или имеющая свободную электронную пару. На конечной стадии образующийся… … Википедия
Реакции синхронного присоединения — реакции присоединения, в которых атака на оба атома кратной связи осуществляется одновременно. Другое название реакций этого типа реакции циклоприсоединения, так как конечным продуктом таких реакций являются циклические субстраты. Существует две… … Википедия
Реакции элиминирования — Элиминирование (от лат. elimino изгоняю) это отщепление от молекулы органического соединения атомов или атомных групп без замены их другими. Реакция элиминирования может проходит в одну стадию (по механизму E2), либо в две стадии … Википедия
Замещения реакции — химические превращения, характеризующиеся тем, что «атакующая», частица вытесняет какой либо атом или группу атомов из др. реагента: Х + Y S → X S + Y. В зависимости от характера Х З. р. подразделяют на нуклеофильные (sn … Большая советская энциклопедия
Химия, Биология, подготовка к ГИА и ЕГЭ
Ионный и радикальный механизмы
химических реакций органической химии
Ионный механизм химической реакции
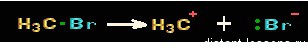
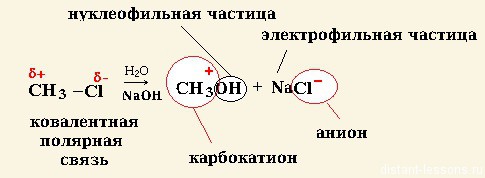
Судя по названию, ионный механизм реакции — это механизм, приводящий к образованию ионов. Соответственно, образуются органические катионы и анионы — карбокатионы или карбоанионы.
Такие ионы образуются при разрыве полярных ковалентных связей в органическом веществе.
Гетеролитический разрыв связей:
Пример ионного механизма химической органической реакции:
Нуклеофильные частицы:
Электрофильные частицы:
Электрофильные и нуклеофильные реакции
Нуклеофильные реакции — органическое вещество реагирует с нуклеофильным реагентом.
S N — substitution nucleophile
Ad N — addition nucleophile
нуклеофильное замещение протекает в тяжелых условиях ( t,p),
но если в бензольном кольце будут электроноакцепторные
заместители, то реакции пойдут намного легче,
электронодонорные — наоборот — затрудняют реакцию
Электрофильные реакции — органическое вещество реагирует с электрофильным реагентом
S E Ar — substitution electrophilic reaction
Ad E — addition electrophilic reaction
( образуется промежуточная частица NO 2 + )
В органической химии чаще всего атакующей электрофильной частицей является протон H +
бромирование кратной связи
гидратация двойной связи
присоединение аминов или NH3
Присоединение по правилу Марковникова — типичный пример ионного типа механизма химической реакции:
водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
В основном, это реакции присоединения к кратным связям или обменные реакции.
Присоединение против правила Марковникова:
Ионные реакции проводят:
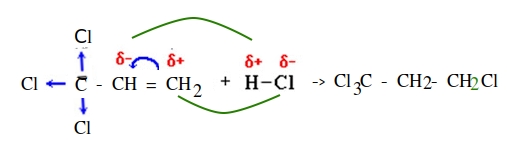
Радикальный механизм химической реакции
— механизм, приводящий к образованию радикалов.
Соответственно, образуются органические частицы — радикалы — имеющие неспаренный электрон.
Такие частицы образуются при разрыве неполярных \ слабо полярных ковалентных связей в органическом веществе.
Гомолитический разрыв связей:
Образовавшиеся радикалы могут взаимодействовать друг с другом.
Классическая реакция, идущая по радикальному механизму — хлорирование метана (обязательно на свету):
Радикальные реакции проводят: