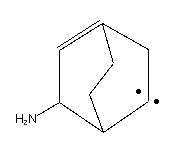
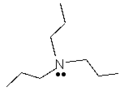
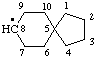Что такое радикалы химия
Радикал (химия)
Углеводоро́дный радика́л (от лат. radix — корень; также — углеводородный остаток) в химии — группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его «неизменностью» нужно быть осторожным; например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, ещё одну карбоксильную группу. Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с таким понятием как свободный радикал. Некоторые углеводородные радикалы могут также являться функциональными группами, например фенил (−C6H5), винил (−C2H3) и пр. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.
Содержание
Номенклатура
Моновалентные углеводородные радикалы
Поливалентные углеводородные радикалы
l-соглашение
Примеры
Обозначение в формулах
Если не принципиально, какой углеводородный радикал находится в молекуле, то часто его обозначают просто буквой R (например, общая формула гомологического ряда спиртов — R−OH). Иногда вместо R используют символ Org. Если соединение содержит несколько разных радикалов, их обозначают R, R’, R», R 4 и т. д.
Иногда необходимо разделить ароматические, гетероциклические и алкильные радикалы. Для этого вместо символа R используют:
В органической химии нередко применяют сокращенные обозначения:
Иногда между обозначением характера радикала (t, i и др.) и остальной частью названия ставят чёрточку: t-Bu.
Структурные формулы некоторых примеров изображены здесь:
Применение
Тривиальные, не номенклатурные названия многих органических соединений состоят из названия углеводородного радикала и названия атомов или групп атомов, замещающих водород, например: СН3Сl — хлористый метил, C2H5Br — бромистый этил и т. д.
Первичные, вторичные, третичные и четверичные атомы углерода
Примечания
См. также
Полезное
Смотреть что такое «Радикал (химия)» в других словарях:
Химия — У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Радикал в химии — (химич. radical, radicale) слово, впервые введенное в научную химическую литературу, по видимому, Гитоном де Морво. В докладе французской Академии наук [ M émoire sur le Développement des Principes de la Nomenclature Mé thodique (18 апр. 1787).… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Радикал, в химии — (химич. radical, radicale) слово, впервые введенное в научную химическую литературу, по видимому, Гитоном де Морво. В докладе французской Академии наук [ Mémoire sur le Développement des Principes de la Nomenclature Méthodique (18 апр. 1787).… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ХИМИЯ ОРГАНИЧЕСКАЯ. НОМЕНКЛАТУРА СОЕДИНЕНИЙ — Для наименования органических соединений используется несколько систем, но ни одна из них не подходит для всех соединений. Сохранились многие тривиальные названия, которые либо применялись еще в начальный период органической химии и отражают… … Энциклопедия Кольера
ОРГАНИЧЕСНАЯ ХИМИЯ — первоначально составляла часть химии вообще и не имела особого названия; позже под О. х. стали разуметь химию веществ, встречающихся только в животном и растительном организме. Берцелиус (Berzelius) определил в 1827 г. О. х. как химию… … Большая медицинская энциклопедия
Углеводородный радикал — (от лат. radix «корень»; также углеводородный остаток) в химии группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но… … Википедия
Органическая химия — В Викисловаре есть статья «органическая химия» Органическая химия раздел химии, изучающий со … Википедия
ОРГАНИЧЕСКАЯ ХИМИЯ — наука, изучающая соединения углерода с др. элементами (органические соединения), а также законы их превращений. Назв. О. х. возникло на ранней стадии развития науки, когда предмет изучения ограничивался соед. углерода растит, и животного… … Химическая энциклопедия
Винил (радикал) — У этого термина существуют и другие значения, см. Винил (значения). Химическая структура винила Винил (от лат. vinum (vini) вино) одновалентный радикал этилена, СН=СН2. С … Википедия
Радиационная химия — область химии, охватывающая химические процессы, вызываемые действием ионизирующих излучений (См. Ионизирующие излучения) на вещество. Ионизирующей способностью обладают как электромагнитные излучения (рентгеновские лучи, γ лучи,… … Большая советская энциклопедия
В химия, а радикальный является атом, молекула, или же ион который имеет неспаренный валентный электрон. [1] [2] За некоторыми исключениями, эти неспаренные электроны делают радикалы очень сильными. химически реактивный. Многие радикалы спонтанно димеризовать. Большинство органических радикалов имеют короткое время жизни.
Ярким примером радикала является гидроксильный радикал (HO •), молекула, имеющая один неспаренный электрон на атоме кислорода. Два других примера: триплетный кислород и триплетный карбен (: CH
2 ) с двумя неспаренными электронами.
Радикалы могут быть получены разными способами, но типичные методы включают: окислительно-восстановительные реакции. Ионизирующего излучения, тепло, электрические разряды и электролиз как известно, производят радикалы. Радикалы являются промежуточными звеньями во многих химических реакциях, в большей степени, чем это видно из сбалансированных уравнений.
Радикалы важны в горение, химия атмосферы, полимеризация, плазма химия, биохимия, и многие другие химические процессы. Большинство натуральных продуктов производится ферментами, генерирующими радикалы. В живых организмах радикалы супероксид и оксид азота и продукты их реакции регулируют многие процессы, такие как контроль сосудистого тонуса и, следовательно, артериального давления. Они также играют ключевую роль в промежуточном метаболизме различных биологических соединений. Такие радикалы могут даже быть посланниками в процессе, получившем название редокс-сигнализация. Радикал может оказаться в ловушке клетка для растворителя или быть связанным иным образом.
Содержание
Стабильность и формирование
Устойчивость органических радикалов
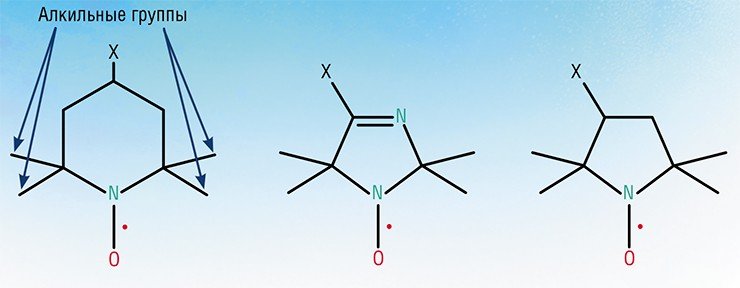
Хотя органические радикалы обычно временны, некоторые из них довольно долгоживущие. Обычно органические радикалы стабилизируются одним или всеми из этих факторов: присутствием электронодонорных групп, делокализацией и стерической защитой. [3] Состав 2,2,6,6-тетраметилпиперидинилоксил иллюстрирует сочетание всех трех факторов. Это коммерчески доступное твердое вещество, которое, помимо того, что является магнитным, ведет себя как обычное органическое соединение.
Легкие доноры H-атома
Устойчивость неорганических радикалов
Бирадикалы
Бирадикалы представляют собой молекулы, содержащие два радикальных центра. Диоксид (O2) является главным примером стабильного бирадикала. Синглетный кислород, нерадикальное состояние дикислорода с наименьшей энергией, менее стабильно, чем бирадикал из-за Правило максимальной множественности Хунда. Относительная стабильность кислородного бирадикала в первую очередь связана с запрещено вращать природа триплет-синглетного перехода, необходимого для захвата электронов, т. е. «окислить ». Бирадикальное состояние кислорода также приводит к его парамагнитному характеру, что демонстрируется его притяжением к внешнему магниту. [6] Бирадикалы также могут встречаться в металлооксокомплексы, занимаясь изучением спин запрещенные реакции в переходный металл химия. [7] Карбены в их триплетном состоянии могут рассматриваться как бирадикалы с центром на одном атоме, хотя обычно они обладают высокой реакционной способностью. стойкие карбены известны, причем наиболее распространенным примером являются N-гетероциклические карбены.
Триплет карбены и нитрены бирадикалы. Их химические свойства отличаются от свойств синглетных аналогов.
Появление радикалов
Горение
Горение состоит из различных цепных радикальных реакций, которые может инициировать синглетный радикал. В воспламеняемость данного материала сильно зависит от концентрации радикалов, которые должны быть получены до того, как реакции инициирования и распространения преобладают, приводя к горение материала. После того, как горючий материал израсходован, снова преобладают реакции обрыва, и пламя гаснет. Как указано, стимулирование реакций распространения или прекращения приводит к изменению воспламеняемости. Например, потому что сам свинец дезактивирует радикалы в бензиновоздушной смеси, тетраэтилсвинец когда-то обычно добавлялся в бензин. Это предотвращает начало горения неконтролируемым образом или в несгоревших остатках (стук двигателя) или преждевременное зажигание (предварительное зажигание).
При сжигании углеводорода задействовано большое количество различных кислородных радикалов. Первоначально, гидропероксильный радикал (HOO ·) сформированы. Затем они реагируют дальше, чтобы дать органические гидропероксиды которые распадаются на гидроксильные радикалы (НО ·).
Полимеризация
Новые методы радикальной полимеризации известны как живая радикальная полимеризация. Варианты включают обратимый перенос цепи присоединения-фрагментации (РАФТ) и радикальной полимеризации с переносом атома (ATRP).
Будучи распространенным радикалом, O2 реагирует со многими органическими соединениями с образованием радикалов вместе с гидропероксид радикальный. Олифы и алкидные краски затвердевают из-за радикального сшивания, инициированного кислородом из атмосферы.
Атмосферные радикалы
В верхних слоях атмосферы фотодиссоциация обычно нереактивных хлорфторуглероды (ХФУ) солнечной ультрафиолетовая радиация является важным источником радикалов (см. уравнение 1 ниже). Эти реакции дают хлор радикал Cl •, катализирующий превращение озон тоже2, тем самым облегчая истощение озонового слоя (экв. 2. 2–экв. 2. 4 ниже).
Такие реакции вызывают истощение озоновый слойособенно потому, что радикал хлора может свободно участвовать в другой цепочке реакций; следовательно, использование хлорфторуглеродов в качестве хладагенты был ограничен.
В биологии
Радикалы играют важную роль в биологии. Многие из них необходимы для жизни, например, внутриклеточное уничтожение бактерий фагоцитарными клетками, такими как гранулоциты и макрофаги. Радикалы участвуют в клеточная сигнализация процессы, [9] известный как редокс-сигнализация. Например, радикальная атака линолевой кислоты вызывает ряд 13-гидроксиоктадекадиеновые кислоты и 9-гидроксиоктадекадиеновые кислоты, которые могут регулировать локализованные воспалительные и / или заживляющие реакции в тканях, восприятие боли и разрастание злокачественных клеток. Радикальные атаки на арахидоновую кислоту и докозагексаеновую кислоту производят аналогичный, но более широкий набор сигнальных продуктов. [10]
Радикалы также могут быть вовлечены в болезнь Паркинсона, старческий и лекарственный глухота, шизофрения, и Болезнь Альцгеймера. [11] Классический свободнорадикальный синдром, болезнь накопления железа. гемохроматоз, обычно ассоциируется с целым рядом симптомов, связанных со свободными радикалами, включая двигательное расстройство, психоз, пигментацию кожи. меланин аномалии, глухота, артрит и сахарный диабет. В свободнорадикальная теория старения предполагает, что радикалы лежат в основе процесс старения сам. Точно так же и процесс митогормезис предполагает, что повторное воздействие радикалов может продлить жизнь.
Поскольку радикалы необходимы для жизни, в организме есть ряд механизмов для минимизации повреждений, вызванных радикалами, и восстановления возникающих повреждений, таких как ферменты супероксиддисмутаза, каталаза, глутатионпероксидаза и глутатионредуктаза. К тому же, антиоксиданты играют ключевую роль в этих защитных механизмах. Часто это три витамина, витамин А, Витамин С и витамин Е и полифенольные антиоксиданты. Кроме того, есть убедительные доказательства того, что билирубин и мочевая кислота могут действовать как антиоксиданты, помогая нейтрализовать определенные радикалы. Билирубин возникает из-за распада красные кровяные тельца’содержимого, в то время как мочевая кислота является продуктом распада пурины. Однако слишком много билирубина может привести к желтуха, что в конечном итоге может повредить центральную нервную систему, а слишком большое количество мочевой кислоты вызывает подагра. [12]
Активные формы кислорода
Оксибензон Было обнаружено, что в солнечном свете они образуют радикалы и, следовательно, также могут быть связаны с повреждением клеток. Это происходило только в сочетании с другими ингредиентами, обычно присутствующими в солнцезащитных кремах, такими как оксид титана и октилметоксициннамат. [16]
ROS атакуют полиненасыщенная жирная кислота, линолевая кислота, чтобы сформировать серию 13-гидроксиоктадекадиеновая кислота и 9-гидроксиоктадекадиеновая кислота продукты, которые служат сигнальными молекулами, которые могут запускать реакции, противодействующие повреждению тканей, вызвавшему их образование. АФК атакует другие полиненасыщенные жирные кислоты, например арахидоновая кислота и докозагексаеновая кислота, чтобы произвести аналогичную серию сигнальных продуктов. [17]
История и номенклатура
Вплоть до конца 20 века слово «радикал» использовалось в химии для обозначения любой связанной группы атомов, такой как метильная группа или карбоксил, будь то часть более крупной молекулы или молекула сама по себе. Квалификатор «свободный» был необходим для указания несвязанного случая. После недавних изменений номенклатуры часть более крупной молекулы теперь называется функциональная группа или заместитель, а «радикальный» теперь означает «свободный». Однако старая номенклатура все еще может появляться в некоторых книгах.
Термин радикальный уже использовался, когда ныне устаревшее радикальная теория был развит. Луи-Бернар Гайтон де Морво ввел фразу «радикальный» в 1785 году, и эта фраза была использована Антуан Лавуазье в 1789 г. в его Traité Élémentaire de Chimie. Затем радикал был идентифицирован как корневая основа некоторых кислот (латинское слово «radix» означает «корень»). Исторически термин радикальный в радикальная теория также использовался для связанных частей молекулы, особенно когда они остаются неизменными в реакциях. Теперь они называются функциональные группы. Например, метиловый спирт был описан как состоящий из метильного «радикала» и гидроксильного «радикала». Не являются и радикалы в современном химическом смысле, поскольку они постоянно связаны друг с другом и не имеют неспаренных реактивных электронов; однако они могут наблюдаться как радикалы в масс-спектрометрии при разрушении путем облучения энергичными электронами.
В современном контексте первая органический (углеродсодержащий) радикал идентифицирован трифенилметильный радикал, (C6ЧАС5)3C •. Этот вид был открыт Моисей Гомберг в 1900 г. В 1933 г. Моррис С. Хараш и Фрэнк Мэйо предположил, что свободные радикалы несут ответственность за антимарковниковское дополнение из бромистый водород к аллилбромид. [18] [19]
В большинстве областей химии историческое определение радикалов утверждает, что молекулы имеют ненулевой электронный спин. Однако в таких областях, как спектроскопия, химическая реакция, и астрохимия, определение немного другое. Герхард Херцберг, получивший Нобелевскую премию за исследования электронной структуры и геометрии радикалов, предложил более свободное определение свободных радикалов: «любые временные (химически нестабильные) частицы (атом, молекула или ион)». [20] Суть его предположения состоит в том, что существует много химически нестабильных молекул с нулевым спином, например C2, С3, CH2 и так далее. Это определение более удобно для обсуждения переходных химических процессов и астрохимии; поэтому исследователи в этих областях предпочитают использовать это расплывчатое определение. [21]
Диагностика
Присутствие радикалов также можно обнаружить или сделать вывод с помощью химические реагенты, улавливающие (т.е. соединить с) радикалами. Часто эти ловушки сами по себе являются радикалами, например ТЕМП.
Изображение в химических реакциях
В химических уравнениях радикалы часто обозначаются точкой, помещенной непосредственно справа от символа атома или молекулярной формулы, как показано ниже:
Радикальный механизмы реакции используйте односторонние стрелки, чтобы изобразить движение отдельных электронов:
В гомолитический разрыв разрывающейся связи изображен стрелкой «рыболовный крючок», чтобы отличить от обычного движения двух электронов, изображенного стандартной фигурной стрелкой. Второй электрон разрывающейся связи также движется, чтобы спариться с атакующим радикальным электроном; в данном случае это не указывается явно.
Радикалы также принимают участие в радикальное добавление и радикальное замещение так как реактивные промежуточные продукты. Цепные реакции с участием радикалов обычно можно разделить на три различных процесса. Эти инициация, распространение, и прекращение.
Такие разные радикалы
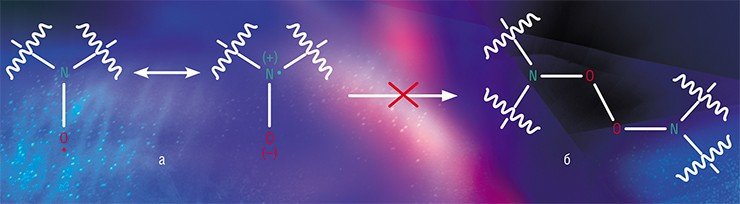
«Радикалом» (от radix – корень) в обыденном русском языке чаще всего называют сторонника крайних и решительных мер. В органической химии этот термин вначале использовался для обозначения «коренной» части молекулы, не изменяющейся в химических реакциях. Однако позже «свободным радикалом» стали называть молекулу с «оборванной» химической связью, обладающей, напротив, высокой реакционной способностью и вследствие этого крайне неустойчивой. Однако имеются радикалы особого «сорта» – так называемые стабильные радикалы, которые могут существовать сколь угодно продолжительное время, и не только в эфемерных концентрациях, но даже как индивидуальные вещества!
Вторая половина XX в. характеризуется фантастическим всплеском интереса научной общественности к стабильным нитроксильным радикалам – органическим молекулам, в состав которой входит нитроксильная группа N–O, на которой и локализован неспаренный электрон. Синтез новых НР и изучение их химических свойств не является самоцелью: эти соединения используются при решении различные задачи с применением спектроскопии электронного парамагнитного резонанса (ЭПР). Метод спиновых меток и зондов сегодня широко применяется в самых разных областях химии, биологии и медицины, являясь поистине универсальным исследовательским инструментом
There are more things in heaven and earth, Horatio,
Than are dreamt of in your philosophy
W. Shakespeare, Hamlet
Термином «радикал» (от латинского radix – корень) в обыденном русском языке чаще всего называют человека, сторонника крайних и решительных мер. В органической химии этот термин вначале использовался для обозначения «коренной» части молекулы, не изменяющейся в химических реакциях, т. е. как символ чего-то консервативного и незыблемого. В той же химии затем появился термин «свободный радикал», указывающий, напротив, на склонность частицы вступать в различные химические взаимодействия, характеризуя его крайнюю неустойчивость.
Какую же сущность скрывает в себе еще более удивительное грамматическое сочетание – стабильный радикал?
Что представляет собой частица вещества (молекула, атом), которую называют радикалом? Обычно у молекул все электроны, которые образуют межатомные связи, равно как и собственные электроны каждого атома существуют парами (поскольку это наиболее энергетически выгодное состояние молекулы). Но если по каким-то причинам получилась частица с нечетным числом электронов, то один из электронов в ней неспаренный – и она является радикалом. Бывают и молекулы-бирадикалы с четным числом неспаренных электронов, которые находятся на разных молекулярных орбиталях.
Однако есть радикалы и несколько иного сорта, которые, несмотря на наличие неспаренного электрона, могут существовать сколь угодно продолжительное время, причем не только в эфемерных концентрациях, но даже как индивидуальные вещества! В-общем, речь пойдет о так называемых стабильных радикалах.
«Ничейный» электрон
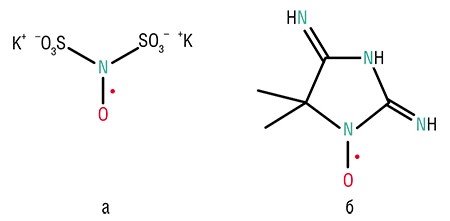
Первым известным человеку стабильным радикалом стала так называемая соль Фреми, открытая в середине XIX в. Но в то время даже мысль о том, что эта молекула является свободным радикалом, возникнуть не могла. В современном смысле этот термин стали использовать только после открытия американского химика-органика М. Гомберга (1900 г.). Он пытался синтезировать молекулу углеводорода – гексафенилэтана, но получил неизвестное соединение, структура которого была установлена лишь спустя 68 лет.
Синтезированное Гомбергом вещество обладало странными свойствами: будучи бесцветным, образовывало растворы желтого цвета и при этом очень легко реагировало с кислородом воздуха. При испарении растворителя без доступа воздуха вновь образовывался исходный бесцветный углеводород. Гомберг справедливо предположил, что полученное им соединение в растворе обратимо диссоциирует – распадается на два трифенилметильных радикала. Это было очень смелое предположение для того времени, и хотя трифенилметильный радикал мог существовать только в растворе и при отсутствии кислорода, он стал первым стабильным радикалом *.
Примерно в то же время был получен другой стабильный органический радикал порфироксид, содержащий нитроксильную группу NO (Пилоти и Шверин, 1901). Он был настолько стабильным, что, в ряде реакций с участием других своих функциональных групп, его радикальный центр оставался без изменений. Неудивительно, что даже сами создатели порфироксида не могли предположить, что имеют дело с первым стабильным нитроксильным радикалом (НР). Несколько позже синтезом подобных «азот-окисных» стабильных радикалов занимался Нобелевский лауреат Г. Виланд.
Вторая половина XX в. характеризуется фантастическим всплеском интереса научной общественности к нитроксильным радикалам. Начало «новой эры» было положено советскими химиками О. Л. Лебедевым и С. Н. Казарновским, наблюдавшими очень стабильный радикал, который мог существовать в растворе сколь угодно долго без всяких предосторожностей. Однако их статью, опубликованную в 1959 г. в малоизвестном региональном журнале, международная общественность просто не заметила.
Бурное развитие химии НР в нашей стране и во всем мире началось благодаря работам московского химика Э. Г. Розанцева и его коллег, удостоенных Государственной премии СССР в 1977 г. Они не только смогли выделить ряд суперстабильных радикалов, но и научились получать их в больших количествах. Было установлено, что протекание многих химических реакций с подобными радикалами без участия радикального центра (неспаренного электрона) – явление достаточно общее. В последующие годы в нашей и других странах сформировались мощные научные школы химиков-органиков, разрабатывающие методы синтеза стабильных радикалов этого типа.
Чем же так интересны оказались эти экзотические соединения? Ведь необычность или красота молекулярной структуры сама по себе вовсе не повод для многих сотен публикаций, которые продолжают выходить ежегодно на протяжении многих десятилетий.
Дело в том, что НР оказались в прямом смысле слова счастливой находкой.
Счастливая находка
Значимость нитроксильных радикалов во многом определяется тем, что они оказались исключительно полезным инструментом для научных исследований в целом ряде областей научного знания.
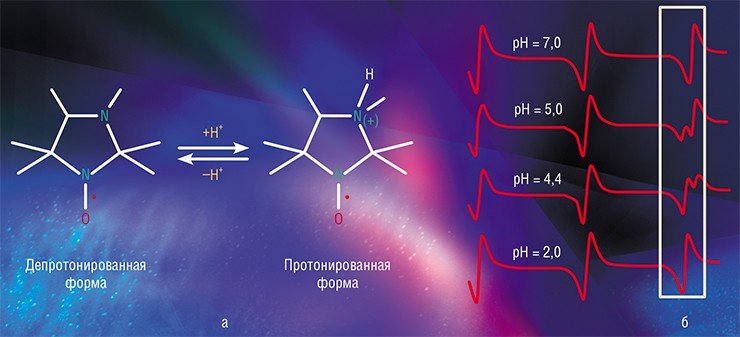
Как известно, помимо заряда электрон имеет еще и магнитную характеристику – спин. Поэтому отличительной особенностью НР является парамагнетизм – способность намагничиваться в направлении, совпадающем с направлением внешнего магнитного поля.
В магнитном поле спиновые состояния электрона в молекуле НР оказываются энергетически неэквивалентными – эта разница в энергетических состояниях и будет определять величину энергии, которое парамагнитное вещество будет поглощать в определенных условиях. Фиксируя интенсивность поглощения энергии в зависимости от мощности поля, мы получаем спектр электронного парамагнитного резонанса (ЭПР).
Вид спектра ЭПР зависит от того, на каких магнитоактивных ядрах происходит локализация спиновой плотности, то есть где расположен неспаренный электрон. В нитроксильной группе таким свойством обладает ядро атома азота 14 N, в этом случае типичный спектр представляет собой триплет (три линии на равном расстоянии друг от друга, называемом константой сверхтонкого взаимодействия).
Чувствительность ЭПР позволяет обнаруживать радикалы в растворе даже в очень малой (порядка 10 –10 моль/л) концентрации. Но какую информацию может получить исследователь из такого спектра, кроме факта наличия самих радикалов? Оказывается, очень значимую, поскольку ближайшее окружение нитроксильной группы (причем не только в молекуле НР, но и в соседних молекулах) оказывает существенное влияние на сверхтонкую структуру спектра. Именно эта особенность стабильных НР позволяет исследователю получать разнообразные характеристики изучаемых объектов.
В связи с вышесказанным, синтез новых НР и изучение их химических свойств сегодня не является самоцелью: создаваемые новые структуры НР призваны решать различные задачи с применением спектроскопии ЭПР. Такой подход получил название метода спиновых меток и зондов. Сегодня этот метод широко применяется в самых разных областях химии, биологии и медицины, являясь поистине универсальным исследовательским инструментом.
Универсальный инструмент
Метод спиновых меток оказался очень удобным для изучения структуры активного центра ферментов. Как известно, организм борется с поступающими в него из окружающей среды токсическими веществами, окисляя их и переводя в водорастворимую форму для последующего выведения. Для этих целей используются, в частности, ферменты группы Р-450. Для их исследования были специально синтезированы молекулы НР, которые фермент способен распознавать как ксенобиотик и избирательно захватывать его для «переработки». В результате молекулы НР адресно доставляются в активный центр фермента, после чего спектроскопическое изучение позволяет судить о геометрии и топологии последнего в динамике.
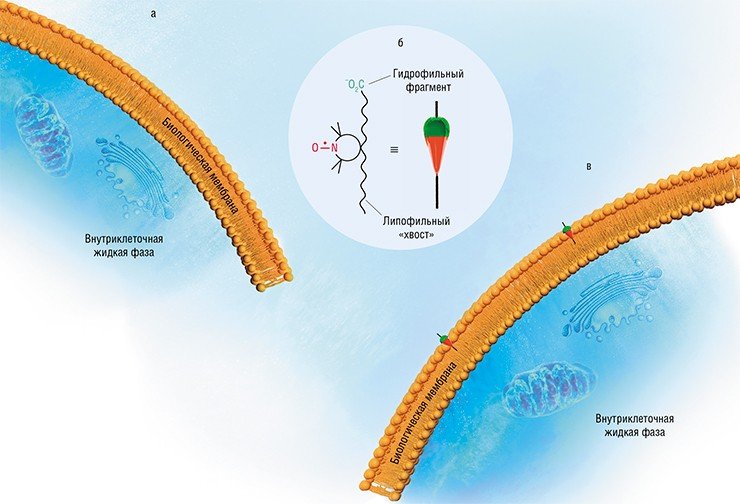
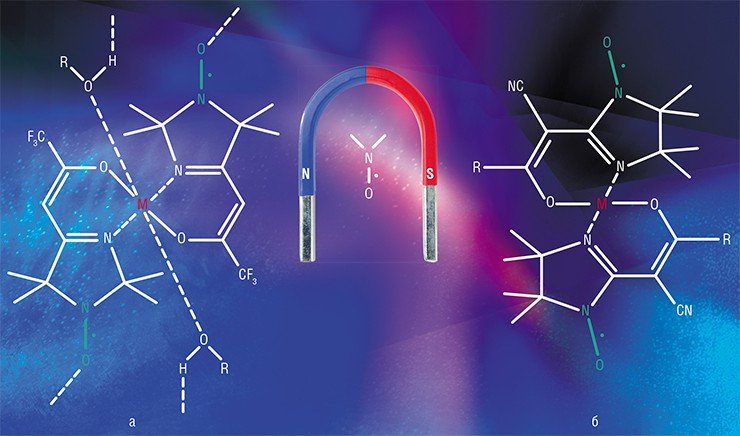
Применяя серосодержащие НР, можно измерить суммарную концентрацию в крови аминокислот и пептидов, содержащих тиольную группу, отклонения которой от нормы зачастую свидетельствуют о развитии в организме ряда патологий. Радикал количественно вступает в необратимую реакцию обмена с образованием другого радикала, поэтому величина парамагнитного сигнала от продукта реакции определяет искомую концентрацию. Аналогичным методом в растворе измеряют концентрации ионов металлов, образующих с НР комплексные соединения.
Кстати сказать, использование НР в качестве парамагнитных лигандов комплексных солей привело к еще одному очень важному результату: были синтезированы координационные соединения с ионами металлов, обладающие макромолекулярным магнетизмом. Эти соединения являются диэлектриками (по причине отсутствия свободных электронов), однако способны намагничиваться подобно металлам группы железа. Такие материалы получили название молекулярные магнетики.
На использовании НР базируется и один из наиболее чувствительных методов обнаружения супероксид анион-радикала O2 – – одной из самых активных форм кислорода, циркулирующих в нашем организме. Эта частица обладает очень высокой реакционной способностью, вследствие чего и время ее жизни, и ее стационарная концентрация очень малы. Для ее исследования в объект вводят не сам нитроксильный радикал, а его предшественник, который исключительно быстро и легко взаимодействует с супероксид анион-радикалом с образованием стабильного радикала, концентрацию которого опять же легко измерить с применением спектроскопии ЭПР.
Реакционно дееспособен!
В молекуле стабильного НР парамагнитный центр (нитроксильная группа) во многих реакциях сохраняется неизменным. Тем не менее, он обладает реакционной способностью, просто при разработке стратегии синтеза НР этот факт учитывается. Однако придуманы и такие сценарии использования радикалов, в которых запланирована «гибель» нитроксильной группы, приводящая к полезным результатам.
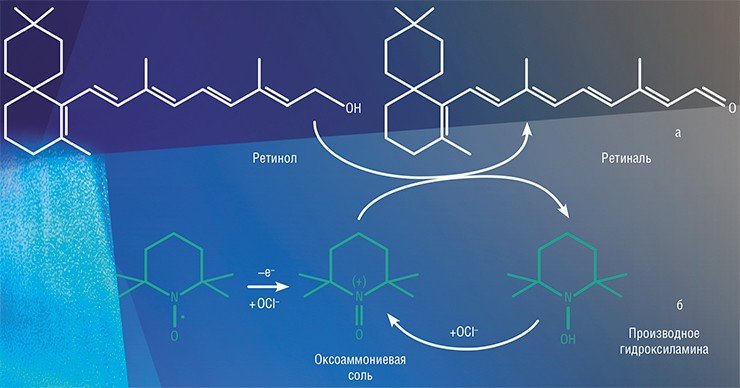
В таком качестве НР используют в тонком органическом синтезе. Например, альдегиды могут быть получены окислением спиртов. Однако образующийся альдегид подвержен дальнейшему окислению, и остановить реакцию на стадии его образовании не всегда удается. И здесь на помощь приходят нитроксильные радикалы. Так, для реакции окисления ретинола в ретиналь (всем известный витамин А) разработана схема, в которой продукт окисления НР выступает в роли катализатора, тем самым «смягчая» действие окислителя. Ряд подобных процессов в настоящее время уже внедрен в промышленную практику.
Нитроксильная группа легко взаимодействует с активными радикалами, например алкильными, с образованием неактивных молекул. Это позволяет использовать НР в качестве стабилизаторов, препятствующих протеканию свободно-радикальных цепных процессов. Таким образом нитроксильные радикалы можно заставить бороться с упомянутыми выше «не в меру активными» собратьями.
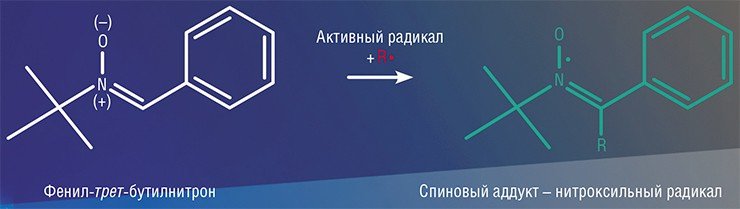
В русле реакционной способности радикального центра лежат и так называемые спиновые ловушки. Этот метод подразумевает использование веществ, которые при взаимодействии с активными радикалами образуют так называемые спиновые аддукты – продукты присоединения, обладающие значительно меньшей активностью. Поскольку большая часть нежелательных свободно-радикальных процессов протекает исключительно по цепному механизму, спиновая ловушка обрывает эти цепи, т.е. выступает в роли ингибитора процесса. С другой стороны, спиновые ловушки позволяют изучать кинетику образования и гибели активных радикалов, а в некоторых случаях даже их строение методами спектроскопии ЭПР.
Возникает законный вопрос: а что мешает непосредственному спектроскопическому изучению самих активных радикалов? Причина в еще одном атрибуте активных радикалов – очень короткое время жизни. Из-за этого концентрация таких радикалов в обычных условиях оказывается настолько мала, что их образование не удается зарегистрировать даже высокочувствительными методами ЭПР.
В этом отношении очень полезными оказались химические вещества, именуемые нитронами, которые достаточно легко взаимодействуют с активными радикалами с образованием спиновых аддуктов, являющихся, по сути, нитроксильными радикалами. Такие спиновые аддукты не всегда являются стабильными, но это и не важно: их активность, а значит, и время жизни несопоставимо больше, чем у исходных радикалов, и они легко могут быть обнаружены методами ЭПР.
В рамках сравнительно небольшой статьи практически невозможно рассмотреть все аспекты применения стабильных нитроксильных радикалов. Ведь возможности их применения практически безграничны – от изучения активных центров катализаторов до. интенсификации процесса нефтедобычи.
Известно, что нефть из скважины течет сама не всегда, очень часто приходится бурить дополнительные скважины и нагнетать туда воду. Вода поднимает давление в нефтеносном пласте – и нефть выходит наружу. А если вода вдруг начнет под землей смешиваться с нефтью, то нагнетательную скважину следует перекрыть и пробурить новую. Но если таких нагнетающих скважин несколько, как узнать, которую следует перекрыть?
Один из способов – «пометить» нагнетаемую воду. Сами нитроксильные радикалы для этой цели непригодны – недостаточно устойчивы. Но есть простые и устойчивые их предшественники – амины, которые и закачивают с водой под землю. Окисление аминогруппы в нитроксильную можно проводить непосредственно перед анализом в ампуле спектрометра ЭПР. Уже в конце 1980 гг., когда эта технология разрабатывалась, существовали простые и недорогие настольные спектрометры ЭПР, способные работать в полевых условиях. А амины тогда стоили существенно дешевле флуоресцентных красителей, которые используются для этой же цели.
Вторая причина, по которой невозможно «объять» все многообразие применения стабильных НР, проста: эти возможности на сегодня далеко не исчерпаны. Химики постоянно синтезируют новые НР, максимально приспособленные под решение конкретных задач. При этом часто оказывается, что возможности новых структур намного превосходят исходное «техзадание». Так возникают новые области применения, и конца этому процессу пока не видно.
Нужно заметить, что некогда в научной среде СССР обсуждались два принципиально разных подхода к решению научных задач. Первый формулировался как системный, и смысл его заключался в том, что исследователь ставил перед собой совершенно конкретную цель. Например, повысить «фуражность крупного рогатого скота» или «яйценоскость кур-несушек». Соответственно, все результаты, не ведущие к достижению этой цели, отбрасывались, как не имеющие ценности.
Второй подход мягко называли романтическим: исследователь в этом случае не имел четко сформулированной цели. Любой полученный результат заслуживал внимания, и в зависимости от своих научных пристрастий исследователь либо отбрасывал его, либо, напротив, тратил все силы на его понимание и дальнейшее изучение.
Сторонники первого подхода говорили, что их оппоненты «занимаются удовлетворением собственного любопытства за счет государства», а апологеты второго подхода утверждали, что самый интересный результат (не применительно к решению первоначально определенной задачи, а с гносеологической точки зрения) запланировать невозможно. Более того, кто может решить – является ли поставленная цель столь уж значимой, чтобы тратить ресурсы на ее достижение?
Кто из них был прав – этот вопрос сейчас, в эпоху «инновационного пути развития общества» кажется бессмысленным. Но все же история исследования стабильных нитроксильных радикалов свидетельствует, что без определенной доли романтичности, когда не исследователь ведет исследование, а «исследование – исследователя», многие научные результаты, определяющие стратегию развития целых научных направлений, возникнуть просто не могли.
Nitroxides: Applications in Chemistry, Biomedicine, and Materials Science / Edition 1 by Gertz Likhtenshtein, Jun Yamauchi, Shin’ichi Nakatsuji, Alex I. Smirnov, Rui Tamura. Wiley, John & Sons, Inc., 2008. 438 p.
Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds / Ed. R. Hicks. Wiley, John & Sons, Inc., 2010. 606 p.
* Подробнее о тритильных радикалах – в статье В. М. Тормышева на с. 26—33.