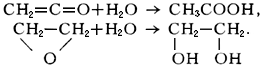Что такое реакция гидратации в химии
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ
ГИДРАТАЦИЯ. ГИДРАТЫ. ГИДРОЛИЗ. Гидратация (греч. «хюдор» – вода) – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называются гидратами. Гидролиз (греч. «лисис» – разложение, растворение) – химическая реакция разложения вещества водой.
В течение многих лет химики считали растворение веществ в воде чисто физическим процессом. И сейчас в школьных учебниках к таковым относят, например, растворение в воде сахара. Действительно, при испарении воды из раствора сахара при пониженном давлении легко получить исходное вещество в неизменном виде.
В то же время накапливались данные о том, что процесс растворения нельзя считать чисто механическим смешением компонентов, как, например, гексана и гептана. Так, растворы хлорида натрия и многих других соединений обладают электропроводностью, а сам процесс растворения нередко сопровождается значительными тепловыми эффектами (см. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ). Более того, некоторые соединения при растворении изменяют даже цвет. Например, сульфат меди бесцветный, а его разбавленный раствор – голубой, хлорид кобальта(II) голубой, а его водные растворы розовые. Все эти факты показывают, что растворение в воде – физико-химический процесс, вызванный гидратацией, то есть взаимодействием вещества с водой.
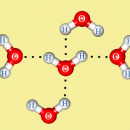
В ходе гидратации в ряде случаев происходит обратимое присоединение воды к ионам, атомам или молекулам растворяемого вещества с образованием гидратов. Так, при растворении в воде кристаллических ионных соединений (солей, щелочей, а также некоторых кислот, например, лимонной и щавелевой), молекулярных соединений (хлороводорода, серной кислоты, спирта, глюкозы и др.) происходит гидратация катионов и анионов, из которых состоит растворяемое вещество, либо гидратация ионов, образующихся в процессе растворения. При этом молекулы воды сохраняются как целое.
| Ион | Энергия гидратации, кДж/моль | Ион | Энергия гидратации, кДж/моль |
| H + | 1076 | Sr 2+ | 1477 |
| H3O + | 460 | Ba 2+ | 1339 |
| Li + | 502 | Zn 2+ | 2130 |
| Na + | 410 | Al 3+ | 4548 |
| K + | 329 | F – | 473 |
| NH4 + | 330 | Cl – | 330 |
| Rb + | 314 | Br – | 296 |
| Cs + | 264 | I – | 264 |
| Mg 2+ | 1887 | OH – | 339 |
| Ca 2+ | 1569 | MnO4 – | 247 |
Алгебраическая сумма энергии кристаллической решетки (или энергии разрыва связей) растворяемого вещества и энергии гидратации ионов определяет суммарный тепловой эффект растворения. В случае ионных соединений процесс может быть существенно экзотермическим (растворение в воде серной кислоты, гидроксидов натрия и калия может вызвать даже вскипание раствора), существенно эндотермическим (стакан с водой, в котором быстро растворяют нитрат аммония, примерзает к влажной подставке) или термонейтральным (растворение бромида натрия практически не сопровождается изменением температуры).
При кристаллизации многих солей из их водных растворов молекулы воды входят в состав кристаллической решетки с образованием кристаллогидратов различного состава, например, LiCl·H2O, CuCl2·2H2O, Ba(ClO4)2·3H2O, CdBr2·4H2O, Na2S2O3·5H2O, AlCl3·6H2O, FeSO4·7H2O, MgI2·8H2O, Fe(NO3)3·9H2O, Na2SO4·10H2O, Na2HPO4·12H2O, Al2(SO4)3·18H2O и др. При нагревании, а также при хранении на воздухе (особенно при низкой влажности) многие кристаллогидраты выветриваются, теряя частично или полностью молекулы воды.
Гидратация молекулярных соединений происходит обычно за счет водородных связей и, как правило, не сопровождается существенным тепловым эффектом. Примером может служить растворение сахара. Молекулы воды легко образуют водородные связи с гидроксильными группами, поэтому даже вещества с большими молекулами хорошо растворяются в воде, если содержат много гидроксильных групп (сахароза, поливиниловый спирт). Соединения с небольшими полярными молекулами также легко гидратируются полярными молекулами воды, поэтому такие соединения обычно хорошо растворяются в воде. Примером может служить ацетонитрил СН3CN, который смешивается с водой в любых отношениях.
Необычные гидраты с некоторыми соединениями образует вода, находящаяся в твердом состоянии. В этих гидратах атомы, молекулы ряда веществ включаются в пустоты кристаллической решетки льда. Эти пустоты могут заполняться небольшими молекулами, такими как О2, N2, H2S, СН4, атомами благородных газов. Такие соединения «без химической связи» называют газовыми гидратами. Другие их название – клатраты (соединения включения). Отсутствие химических связей приводит к самым необычным соотношениям молекул воды и включенного вещества. Например, при низких температурах устойчивы соединения, содержащие на 46 молекул Н2О восемь атомов аргона, криптона, ксенона или радона. А вот маленькие атомы гелия и неона таких клатратов не образуют, так как они «ускользают» из слишком больших для них пустот. Клатрат состава Сl2·8H2O получил еще Дэви в 1811 из насыщенного при 0° С водного раствора хлора.
Клатраты, образованные водой и метаном, а также другими газами, часто называют газовыми гидратами. Внешне они похожи на снег или рыхлый лет, но под давлением могут существовать и при плюсовых температурах. Поэтому газовые гидраты могут закупорить газопровод и привести к аварии. Гидраты метана широко распространены в природе, в особенности на шельфе океанов; запасы природного газа в виде газовых гидратов значительно превышают его запасы в свободном состоянии.
Гидратация как химическое взаимодействие с водой может сопровождаться разрушением молекул воды, в этом случае происходит необратимая химическая реакция, которую обычно называют гидролизом – разложением водой. Реакции гидролиза известны как в неорганической, так и в органической химии. Примерами гидролиза неорганических соединений могут служить следующие процессы:
Гидролиз солей, образованных сильным основанием (щелочью) и слабой кислотой или слабым основанием и сильной кислотой сопровождается изменением кислотности среды: Na2S + H2O ® NaHS + NaOH, AlCl3 + H2O ® Al(OH)Cl2 + HCl. В случае таких солей как Al2S3 (их можно получить только сухим путем) гидролиз идет до конца с выделением гидроксида металла и слабой кислоты.
В органической химии реакции гидролиза сопровождаются либо разрушением органической молекулы (гидролиз сложных эфиров, белков): CH3COOC2H5 + H2O ® CH3COOH + C2H2OH, либо заменой в молекуле какой-либо группы на остаток молекулы воды, обычно гидроксил (гидролиз алкилгалогенидов): C2H5Br + H2O ® C2H5OH + HBr. В обоих случаях гидролизу способствует присутствие щелочи, которая связывает выделяющуюся кислоту. В случае белков и других биологически активных молекул реакцию гидролиза направляют в нужном направлении специальные ферменты – гидролазы. Например, фермент амилаза способствует гидролизу крахмала; фермент трипсин направленно гидролизует в белках пептидные связи, образованные аминокислотами аргинином и лизином.
Примерами реакции гидратации в органической химии может служить каталитическая гидратация алкенов с образованием спиртов:
Реакции гидратации широко используются в промышленном органическом синтезе. Например, каталитической гидратацией из этилена получают этиловый спирт, из пропилена – пропиловый спирт, из ацетилена – уксусный альдегид, из метилацетилена – ацетон. Реакция гидратации с образованием гидратов является ключевой при формовании изделий из гипса, при «схватывании» цемента. Образование газовых гидратов используют для разделения многокомпонентных газовых смесей. Наличие запасов гидратов метана в недрах Земли перспективно для будущей добычи природного газа. Реакции гидролиза широко используются в лабораторной практике и в промышленности. Гидролизом целлюлозы получают называемый гидролизный этиловый спирт, гидролизом сахарозы – глюкозу и фруктозу, гидролизом жиров – глицерин и соли карбоновых кислот – мыла. Ферментативный гидролиз органических соединений широко применяется в пищевой, текстильной и фармацевтической промышленности.
Гидратация
Гидрат а ция (от греч. hydor — вода), процессы связывания воды химическими веществами. Различают несколько видов гидратации.
Гидратация окислов приводит к гидроокисям, представляющим собой щёлочи, кислоты или амфотерные соединения. Так, присоединение воды к окиси кальция даёт гидроокись кальция (в технике этот процесс называется «гашение извести»):
При гидратации трёхокиси мышьяка образуется слабая мышьяковистая кислота, имеющая амфотерные свойства:
Гидратация органических соединений происходит по кратным связям; в случае циклических соединений гидратация приводит к раскрытию циклов. Обычно эти реакции происходят в присутствии щелочей, кислот или гетерогенных катализаторов (каталитическая гидратация). Гидратация этого типа играет огромную роль в препаративной органической химии и промышленности органического синтеза. Так, в результате прямой гидратации олефинов получают спирты, например этиловый спирт из этилена:
В перечисленных примерах вода реагирует таким образом, что происходит разрыв связи между атомом водорода и группой OH.
Многие неорганические и некоторые органические вещества образуют с водой твёрдые кристаллогидраты, постоянного состава, которые ведут себя как индивидуальные химические соединения. Так, безводный сульфат меди CuSO4 бесцветен; из его водных растворов кристаллизуется ярко-синий гидрат CuSO4·5H2O — медный купорос, при нагревании которого образуется сначала голубой CuSO4·3H2O, затем CuSO4·H2O белого цвета; при 258°С соль полностью обезвоживается. К этому же типу относится гидратация молекул в растворах с образованием гидратов различного состава, находящихся в равновесии друг с другом и водой; например, при растворении спирта образуются гидраты с 3,4 и 8 молекулами H2O. При растворении электролитов происходит гидратация ионов, затрудняющая ассоциацию последних. Энергия гидратации в значительной степени компенсирует энергию диссоциации электролита; т. о., гидратация ионов является одной из главных причин электролитической диссоциации в водных растворах. Образование кристаллогидратов и гидратация молекул и ионов в растворах являются частными случаями сольватации, т. е. присоединения молекул растворителя. К гидратации относят также процессы, приводящие к связыванию воды за счёт адсорбционных сил (см. Адсорбция). См. также Вода.
В биологических системах при гидратации происходит присоединение (связывание) воды различными субстратами организма. Вода, входящая в образующиеся при гидратации гидратные оболочки, составляет основное количество т. н. связанной воды протоплазмы клетки. С гидратацией связаны многие биологические процессы. Так, гидратация ионов влияет на их проникновение в клетку, а гидратация белков изменяет некоторые их свойства — в частности ферментативную активность.
Процесс, обратный гидратации, т. е. потеря связанной веществами воды, называется дегидратацией. Гидратация и дегидратация постоянно происходят в процессах обмена веществ, в частности обмена воды, в организмах.
ГИДРАТАЦИЯ
(от греч. hydor-вода), присоединение воды к молекулам, атомам или ионам. Может осуществляться без разрушения или с разрушением молекул воды. Г. без разрушения молекул воды приводит к гидратам. Обусловлена электростатич. и ван-дер-ваальсовым взаимодействиями, координационными и иногда водородными связями. Г. в растворе-частный случай сольватации.
Г. молекул в р-рах изучена недостаточно. Энтальпии Г. молекул, отсчитанные, как и для ионов, от их стандартных состояний в вакууме, содержат вклад, обусловленный влиянием молекул растворенного в-ва на водородные связи между молекулами воды, и обычно не превышают неск. десятков кДж/моль.
Г.-важный фактор, обусловливающий р-римость в-в в воде, электролитич. диссоциацию, распределение в-в между фазами в многокомпонентных системах, содержащих воду, кинетику и равновесие р-ций в водных р-рах, образование кристаллогидратов (см. также Растворы неэлектролитов, Растворы электролитов, Гидраты):
Г.с разрушением молекул воды широко распространена в неорг. и орг. химии. Г. оксидов элементов приводит в зависимости от их природы к образованию щелочей, к-т или амфотерных гидроксидов. Эта р-ция-основа мн. пром. процессов, напр. получения серной и азотной к-т, твердения вяжущих материалов (при этом происходит также образование кристаллогидратов). С .И. Дракин.
Г. непредельных углеводородов-важнейшая стадия во мн. процессах переработки нефтяного сырья, попутных и прир. газов. Г. используется в пром-сти для получения, напр., этанола из этилена, изопропанола из пропилена, ацетальдегида и ацетона из ацетилена, этиленгликоля из этиленоксида, уксусной к-ты и ее ангидрида из кетена. Г.-одна из стадий синтеза карбоновых к-т из олефинов. См. также Дегидратация.
Лит.: Креетов Г. А., Термодинамика ионных процессов в растворах, 2 изд., Л., 1984.
Смотреть что такое ГИДРАТАЦИЯ в других словарях:
ГИДРАТАЦИЯ
общее название, прилагаемое обыкновенно ко всем тем хим. реакциям, при которых происходит присоединение воды. Реакции эти чрезвычайно многочисленны и р. смотреть
ГИДРАТАЦИЯ
(от греч. hydor — вода) процессы связывания воды химическими веществами. Различают несколько видов Г. Г. окислов приводит к гидроокисям. смотреть
ГИДРАТАЦИЯ
гидратация ж. Физико-химический процесс взаимодействия растворенных веществ с водой.
ГИДРАТАЦИЯ
ГИДРАТАЦИЯ
ГИДРАТАЦИЯ
Гидратация — общее название, прилагаемое обыкновенно ко всем тем химическим реакциям, при которых происходит присоединение воды. Реакции эти чрезвычайно многочисленны и разнообразны, совершаются повсюду в природе и беспрестанно применяются как в лабораторной практике, так и в различных производствах. При всем их разнообразии можно ясно различить три типа реакций Г.: 1) прямые реакции соединения с водой; 2) реакции соединения, совершающиеся при участии хим. деятелей, и 3) гидролиз или разложения (образование двух или более веществ из одного + вода), производимые водой через ее присоединение, большей частью также требующие воздействия третьего тела. Прямо соединяются с водой: кислотные и основные (щелочные и щелочноземельные) ангидриды, образуя соответствующие гидраты; безводные соли, а также многие из вышеупомянутых гидратов, образуя кристаллогидраты; простые эфиры многоатомных спиртов, образуя соответствующие спирты. Все эти реакции за немногими исключениями (напр. переход метафосфорной кислоты в ортофосфорную, Г. окиси этилена и некотор. др.) идут более или менее легко и быстро либо при простом соприкосновении с водой, либо при растворении в ней, и сопровождаются отделением тепла, часто весьма значительным [Некоторые случаи Г. ангидридов соединены с распадением сложной частицы на 2 простейшие, напр. уксусный анг., соединяясь с водой, распадается с образованием 2 частиц уксусной кислоты: Тем не менее, эта и др., подобные ей, реакции по всему своему характеру принадлежат к 1-ой группе реакций Г. точно так же, как образование хлористого водорода из хлора и водорода (Н 2 + Cl2 = 2НCl) есть реакция соединения. Реакции разложения водой хлорангидридов кислот, в сущности, представляют также реакции Г., сходные с Г. смешанных кислотных ангидридов.]. Вторая группа реакций Г. обнимает собой сравнительно немногие случаи присоединения воды к непредельным соединениям, как то: Г. этиленных углеводородов в одноатомные предельные спирты и непредельных одноатомных спиртов в гликоли при нагревании их с разведенными кислотами, присоединение воды к ацетилену, пропаргиловому спирту и т. п. в присутствии бромной ртути и Г. некоторых терпенов под влиянием кислот. Несравненно более разнообразны реакции гидролиза. Сюда относятся: омыление (см.) сложных эфиров водой и основаниями, при чем происходит распадение эфиров на спирт и кислоту C2H3 O.С 2H5 O (уксусноэтиловый эфир) + Н 2O = C2H4O2 (уксусн. эт. спирт) + C 2H6O; гидролиз при кипячении с разведенными кислотами или под влиянием неорганизованных ферментов (диастаза, растворимого фермента дрожжей и друг.), глюкозидов [напр.: С 13 Н 18 О 7 (салицин) + Н 2O = C6 Н 12O6 (глюкоза) + C7H8O2 (салигенин)] и углеводов (напр. превращение крахмала при действии диастаза солода в мальтозу: (C6H10O5)n + (Н 2O)n = nC6H12O6, и инверсия сахара (C12H22O11 (сахар) + H 2O = C6H12O6 (глюкоза) + C 6H12O6 (фруктоза); Г. нитрилов, илидов, амидов и аминовых кислот, распадающихся при действии водных минеральных кислот или оснований на кислоты и аммиак (напр. С 2O2(NH2)2 (оксамид) + 2Н 2O = C2H2O4 (щавел. к.) + 2NH 3 или CNOH (циановая кисл.) + Н 2 O = СО 2 (углек.) + NH 3; Г. с помощью кислот альдоксимов, кетоксимов и гидроксамовых кислот, гидразонов и озазонов, которые разлагаются при этом на альдегиды, кетоны, кислоты, глюкозы и оксиглюкозы, с одной стороны, и гидроксиламин и фенилгидразин, с другой, и, наконец, реакции Г. амидоксимов, изонитрилов, ортоэфиров, имидоэфиров, ангидримидокислот и амидинов и некотор. др. Более сложные относящиеся сюда случаи Г. представляют белковые вещества. Таковы процессы пептонизации белков (см. Пептоны) под влиянием, напр., неорганизованного фермента желудочного сока, пепсина, в присутствии слабой соляной кислоты и процессы гниения их [Здесь Г. соединена с окислением.] под влиянием жизнедеятельности особых бактерий, сопровождающиеся постепенным распадом белковых тел с образованием сперва пептонов, лейцина и тирозина и далее аммиака, сероводорода, угольной, серной и органических (жирных и ароматических) кислот, фенолов, индола, скатола и др. тел. Вода, щелочи и кислоты также способны при нагревании различным образом гидратировать белки, расщепляя их на тела отчасти такие же, отчасти подобные тем, которые происходят при гниении. Реакции Г. 2 и 3 группы протекают по большей части медленно, не обнаруживая значительных тепловых явлений. Что касается роли третьего вещества при них, то она может быть троякой. Гидратирующее вещество реагирует с одним из продуктов Г., вступая с ним в соединение, напр., щелочь с кислотой, образующейся при омылении эфиров, или минеральная кислота с аммиаком при распадении амидов. Гидратирующее вещество, само оставаясь в конце превращения неизмененным, тем не менее принимает непосредственное участие в реакции, как, напр., серная кислота при Г. этилена, выражающейся след. 2 уравнениями: CH2.CH2 + H(HSO4) = CH3.CH2(HSO4) и СН 3.СН 2 (НSО 4) + Н 2 O = СН 3.СН 2 (НО) + H(HSO 4). Наконец, оно может действовать контактом (см). Таково, по-видимому, действие диастаза и слабых кислот на глюкозиды и углеводы и пепсина на белки. П. П. Рубцов. Δ.
ГИДРАТАЦИЯ
— 1. Процесс связывания частиц растворимого в воде вещества с молекулами воды. Г. является частным случаем сольватации — присоединения к веществам какого-либо растворителя. Г. электролитов в растворах является главной причиной их диссоциации на ионы, обусловливает устойчивость ионов в растворах и препятствует обратному соединению ионов в молекулы. Реакции гидратации б. ч. обратимы; обратная реакция называется дегидратацией. Получаемые при этом соединения называются гидратами, а входящая в них вода — гидратной. Иногда гидратная вода так прочно связана с частицами растворенного вещества, что при выделении его из раствора входит в состав образующихся к-лов, называемых кристаллогидратами, а содержащаяся в них вода называется кристаллизационной. Особенно легко образуются кристаллогидраты разл. солей, причем на единицу разл. солей приходится от 1 до 12 молекул воды. В формулах ее пишут отдельно, напр., гипс — СаSО4·2Н2О, мирабилит — Na2SO4·10H2О и др. 2. Гидратация окислов заключается в разложении воды и окислов и построении новых соединений — гидроокисей. Н и О, входившие в состав воды, занимают в структуре новых соединений разл. самостоятельные позиции. Напр., брусит — Mg(OH)2, гидраргиллит — Аl(ОН)3 и др. Такая вода называется конституционной.3. Г. называют также поглощение воды коллоидами — адсорбция поверхностью частиц и поглощение цеолитной воды — в каналах кристаллической решетки (см. Вода в минералах). Г. характерна для процессов выветривания и регрессивного метаморфизма.
Тепловые эффекты растворения и гидратации



Класс Химия
21.04.2020
в классной работе законспектировать кратко материал урока
Тема «Процесс растворения – физико-химический процесс. Гидратация. Понятие о кристаллогидратах. Тепловые явления при растворении веществ»
Рассмотрим процесс растворения веществ.
Например, если мы добавляем в чай сахар, то можем наблюдать, как количество твердого вещества постепенно уменьшается. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро. Попадая в воду, молекулы сахара, которые находятся на поверхности кристаллов сахарного песка, образуют связи с молекулами воды. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя. Молекулы сахара, которые перешли из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря диффузии. Если раствор нагреть или перемешивать, то диффузия происходит интенсивнее и растворения сахара проходит быстрее. Молекулы сахара распределяются равномерно, и раствор становится одинаково сладким по всему объему.
Вещества при растворении не меняются, после выпаривания растворов мы можем получить растворенное вещество в твердом состоянии. При растворении разрушается кристаллическая решетка растворенного вещества и ее частицы перемещаются в растворе, следовательно, растворение это физический процесс. Для осуществления такого процесса необходимо потратить энергию.
Приведенные факты говорят о том, что растворение следует считать физико-химическим процессом.
Гидраты и сольваты
При растворении многих веществ их молекулы или ионы связываются с молекулами растворителя, образуя соединения, называемые сольватами (от латинского solvere – растворять). Этот процесс называется сольватацией.
В частном случае, когда растворителем является вода, эти соединения называются гидратами, а самый процесс их образования – гидратацией.
В зависимости от природы растворённого вещества, сольваты могут образовываться разными путями.
1. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения. В этом случае говорят о ион-дипольном взаимодействии.
2. Может иметь место донорно-акцепторное взаимодействие. Здесь ионы растворённого вещества обычно выступают в качестве акцепторов, а молекулы растворителя – в качестве доноров электронных пар. В таком взаимодействии могут участвовать растворители, молекулы которых обладают неподеленными электронными парами (например, вода, аммиак).
3. При растворении веществ с молекулярной структурой сольваты образуются вследствие диполь-дипольного взаимодействия. Диполи растворённого вщества могут быть при этом постоянными (у веществ с полярными молекулами) или наведёнными (у веществ с неполярными молекулами).
Кристаллогидраты
Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат.
Свойства гидратов
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов.
Но иногда гидраты настолько прочны, что при выделении растворённого вещества из раствора вода входит в состав его кристаллов.
Прочность связи между веществом и кристаллизационной водой в кристаллогидратах различна. Многие из них теряют кристаллизационную воду уже при комнатной температуре.
Так, прозрачные кристаллы «бельевой» соды (Na2СO3 · 10H2O), если оставить их лежать на воздухе, очень легко «выветриваются», т.е., теряя воду, становятся тусклыми и постепенно рассыпаются в порошок. Для обезвоживания других кристаллогидратов требуется довольно сильное нагревание.
Тепловые эффекты растворения и гидратации
Растворение
Количество теплоты, поглощающейся (или выделяющейся) при растворении одной грам-молекулы вещества, называется теплотой растворения этого вещества.
Тепловые эффекты различных химических реакций выражаются количеством теплоты, выделяемой или поглощаемой при образовании 1 моля продукта.
Теплота растворения имеет отрицательное значение, если при растворении теплота поглощается, и положительное – при выделении теплоты. Например, теплота растворения нитрата аммония равна –6,32 ккал/моль, гидрооксида калия +13,3 ккал/моль.
Процесс растворения сопровождается значительным возрастанием энтропии системы, так как в результате равномерного распределения частиц одного вещества в другом резко возрастает число микросостояний системы. Поэтому, несмотря на эндотермичность растворения большинства кристаллов, изменение изобарного потенциала системы отрицательно и растворение протекает самопроизвольно.
При растворении кристаллов происходит их разрушение и распределение молекул (или ионов) по всей массе растворителя, что требует затраты энергии. Поэтому растворение должно сопровождаться поглощением теплоты. Если же наблюдается обратный эффект, то это показывает, что одновременно с растворением идёт другой процесс.
Гидратация
Гидрата́ция (от др.-греч. ὕδωρ «вода») — присоединение молекул воды к молекулам или ионам. Гидратацияявляется частным случаем сольватации — присоединения к молекулам или ионам веществ молекул органического растворителя.
Процесс образования гидратов протекает с выделением теплоты. При растворении вещества, подвергающегося гидратации, общий тепловой эффект складывается их теплового эффекта собственно растворения и теплового эффекта гидратации.
Поскольку первый из этих процессов эндотермичен, а второй экзотермичен, то общий тепловой эффект процесса растворения, равный алгебраической сумме отдельных процессов, может быть, как положительным, так и отрицательным.