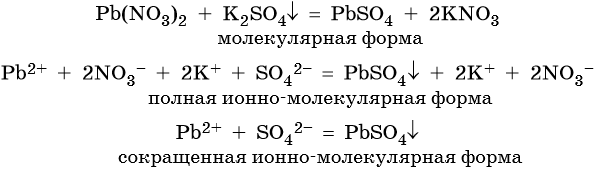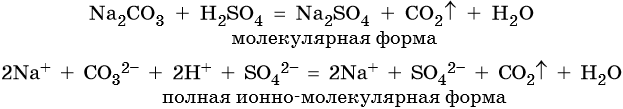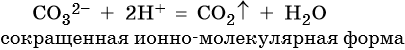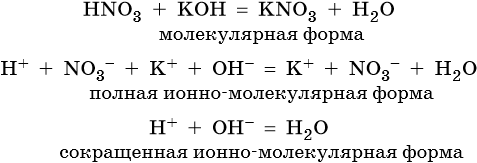Что такое реакция обмена
Обменные реакции
Реакциями ионного обмена называют химические реакции, которые протекают между ионами без изменения степеней окисления элементов и приводят к обмену составных частей реагентов.
Уравнения обменных реакций записывают в молекулярной форме (с указанием формул всех реагирующих веществ со стехиометрическими коэффициентами); в полной ионной форме (с указанием всех существующих в растворе ионов) и в сокращенной ионной форме (с указанием только тех ионов, которые непосредственно взаимодействуют между собой).
При написании уравнений реакций в ионной форме формулы малодиссоциирующих веществ (слабых электролитов) записывают в молекулярной форме.
Уравнения реакций обмена в водных растворах электролитов составляют так.
Реакции ионного обмена в растворах электролитов протекают практически необратимо и до конца, если в качестве продуктов образуются осадки (малорастворимые вещества), газы (легколетучие вещества), слабые электролиты (малодиссоциирующие соединения) и комплексные ионы.
Если при взаимодействии растворов электролитов не образуется ни одно из указанных видов соединений, химическое взаимодействие практически не происходит.
Уравнения обменных реакций можно записать в молекулярной форме, полной ионной форме, с указанием всех существующих в растворе ионов и в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов. Следует отметить, что при написании уравнений реакций в ионной форме малодиссоциирующие вещества (слабые электролиты) записывают в молекулярной форме.
Пример 1. Реакция между нитратом свинца и сульфатом калия. В результате этой реакции образуется нерастворимый сульфат свинца и выделяется растворимый нитрат калия:
Пример 2. Взаимодействие карбоната натрия с серной кислотой. При этом выделяется углекислый газ и вода, а в растворе остаются катионы натрия и сульфат-ионы:
Пример 3. Реакция между азотной кислотой и едким кали. В результате данной реакции образуется малодиссоциированное соединение — вода, и в растворе остаются катионы калия и нитрат-ионы:
Иногда в ходе обменных реакций образуются вещества, для которых в таблице растворимости приведены символы «–» (в водной среде разлагается или не существует) или «?» — нет достоверных сведений о существовании соединения. Это означает, что данное соединение водой разлагается на кислоту и основание.
Так, например, сульфид алюминия разлагается водой на Al(OH)3 и H2S, карбонат хрома (III) Cr2(CO3)3 разлагается на Cr(OH)3 и CO2 и т.д.
Пример 4. Реакция между водными растворами сульфата алюминия и карбоната натрия:
Теоретически в результате этой реакции должны образоваться сульфат натрия и карбонат алюминия. Однако последний в водном растворе не существует, а разлагается на Al(OH)3 и CO2. Следовательно, реакция пройдет следующим образом:
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Реакции обмена
Урок 31. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Реакции обмена»
Реакции обмена – это реакции, в результате которых, два сложных вещества обмениваются своими составными частями.
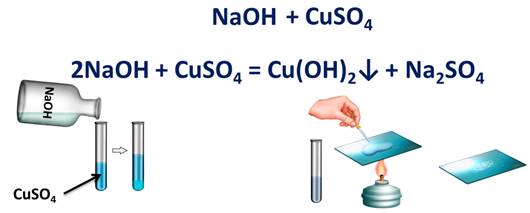
Запишем реакцию взаимодействия двух сложных веществ: гидроксида натрия и сульфата меди (II). Они должны обменяться своими составными частями, т.е. у натрия вместо гидроксид-иона будет сульфат-ион, а у меди вместо сульфат-иона будет гидроксид-ион. Осталось правильно составить формулы продуктов реакции согласно зарядам. Т.е. образуется сульфат натрия – Na2SO4 и гидроксид меди (II) – Cu(OH)2.
Запишем правило: щелочь + соль = основание + соль
Признаком этой реакции является образование осадка голубого цвета. Этот осадок – гидроксид меди (II), поэтому мы ставим после него стрелку, направленную вниз. Еще образуется соль – сульфат натрия. В этом легко убедится, если отфильтровать садок, а на предметное стекло поместить несколько капель раствора и выпарить. После чего на стекле появятся белые кристаллы соли.
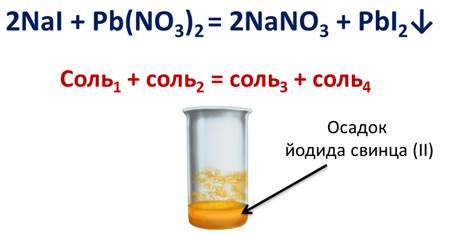
Аналогично обмениваются ионами йодид натрия с нитратом свинца (II). В результате реакции выпадает осадок йодида свинца (II).
Проведем эксперимент. Для этого в пробирку с раствором щелочи добавим несколько капель фенолфталеина. Раствор окрасится в малиновый цвет. Если же к содержимому пробирки добавить кислоты, то малиновая окраска исчезает. Выпарим содержимое полученного раствора. На предметном стекле появляются кристаллы соли. В реакцию у нас вступает щелочь – гидроксид натрия и серная кислота. У гидроксида натрия – гидроксид-ионы, у серной кислоты – сульфат-ионы. Обменяем их ионами, у натрия теперь будут сульфат-ионы, у водорода – гидроксид-ионы. В результате образуется соль – сульфат натрия и вода.
Запишем правило: щелочь + кислота = соль + вода
В каждом из этих растворов была своя седа: у щелочи – щелочная, у кислоты – кислая, а стала нейтральная. Поэтому реакцию обмена между щелочью и кислотой называют реакцией нейтрализации.
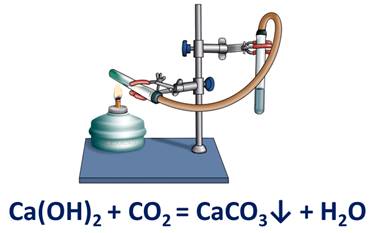
Реакция обмена наблюдается и при взаимодействии известковой воды и углекислого газа. При этом наблюдается помутнение известковой воды вследствие образования осадка – карбоната кальция.
Если в пробирку с карбонатом натрия прилить соляной кислоты, то начинается «вскипание» раствора, вследствие образования углекислого газа. Откуда же углекислый газ, ведь по правилам должна образоваться угольная кислота. Но так как это соединение непрочное, то она распадается на углекислый газ и воду.
Правило: соль + кислота = новая соль + новая кислота
Реакции обмена идут до конца, если в результате их образуется осадок, газ или вода.
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Урок+презентация «Реакции обмена» 8 класс
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Выбранный для просмотра документ Презентация.pptx
Описание презентации по отдельным слайдам:
Какая реакция лишняя? 2Cu+O2=2CuO Zn(OH)2=ZnO+H2O Mg+H2SO4=MgSO4+H2 FeS+2HCl=FeCl2+H2S
Художественные образы реакций Реакция разложения Реакция соединения
Лекарь + П Пекарь + Л Реакция замещения
Тема: Реакции обмена Цель: выяснить какие реакции называются реакциями обмена, дать определение, научиться составлять уравнения химических реакций, определить условия их протекания.
Какие из реакций обмена будут протекать до конца? Почему? BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl Cu(NO3)2 + 2NaCl → CuCl2 + 2NaNO3 2НNO3 + К2S → Н2S↑ + 2KNO3 Mg(ОН)2 + Н2SO4 → MgSO4 + 2H2O 2HNO3 + ZnSO4 → H2SO4 + Zn(NO3)2
Выбранный для просмотра документ Технологическая карта открытого урока по химии в 8 классе.docx
Технологическая карта открытого урока по химии в 8 классе
Педагогическая цель : сформировать интерес к изучению нового курса: создать условия для формирования научного мировоззрения у обучающихся о науке химии; продолжить формирование знаний о типах химических реакции, познакомить с реакциями обмена.
Тип, вид урока: урок постановки учебной задачи
— предметные: обучающийся научиться классифицировать химические реакции по числу и составу исходных веществ и продуктов реакции; использовать таблицы растворимости для определения возможности протекания реакции обмена; наблюдать и описывать признаки и условия течения химических реакции; будет знать определения понятий: «реакция обмена», «реакции нейтрализации».
— личностные: формирование умения управлять своей познавательной деятельностью; понимание значимости естественно-научных и математических знаний для решения практических задач; формирование умения грамотного обращения с веществами в химической лаборатории и в быту.
— универсальные учебные действия: Познавательные – использовать знаково-символические средства для раскрытия сущности процессов; создавать обобщения, устанавливать аналогии, осуществлять классификацию, делать выводы, проводить наблюдение; составлять на основе текста таблицы, схемы, опорный конспект, в том числе с применением средств ИКТ; получать информацию из различных источников и интерпретировать её.
Регулятивные – формулировать цель урока и ставить задачи, необходимые для её достижения; планировать свою деятельность и прогнозировать её результаты; работать по плану, сверять свои действия с целью и, при необходимости, корректировать ошибки самостоятельно.
Формы и методы обучения:
Организационная структура урока
Проверка готовности обучающихся к уроку; эмоциональный настрой на урок.
Учитель приветствует обучающихся, просит их проверить готовность к уроку.
Актуализация опорных знаний урока
Активизирует знания, необходимые обучающимся для изучения нового материала. Осуществляет фронтальный контроль:
Учитель: Все, что нас окружает, состоит из веществ. Взаимодействуя друг с другом они изменяют свои свойства и состав. И начать урок я хочу с загадки.
Эти явления знаете вы
В жизни нашей встречаются они,
А отличают эти явления – взаимные превращения,
И образуются всегда – новые вещества.
Что же это за явления? (химические реакции)
Учитель: Кто ответит, что такое химическая реакция?
Учитель: С какими тремя типами хим. Реакций мы уже познакомились?
Учитель: Хорошо, теперь я предлагаю вам немного поиграть. На слайде 4 типа реакций, 3 вам уже знакомы, а одна является лишней т.е. не изученной нами. Вам необходимо определить тип химических реакций, записать уравнения и расставить коэффициенты.
(Один человек работает у доски)
(1 – соединения, 2 – разложения, 3 – замещения)
Мотивация к изучению нового материала. Формулирование темы и целей урока.
Мотивирует обучающихся к определению темы и к постановке познавательной цели урока.
Учитель: Итак, очевидно, что сегодня на уроке мы с вами познакомимся с новым типом химических реакций. (Учитель подходит к ученику и просит у него ручку, а ему отдает карандаш). Вопрос: Что мы сделали? Как выдумаете
к какому типу относится последняя химическая реакция?(ответы учеников)
Это – наша новая тема, то есть эта реакция является реакцией обмена, о которой мы сегодня поговорим. Записываем тему в тетрадь. Давайте попробуем определить цель нашего урока. (ответы учеников)
Наша задача – выяснить что такое реакции обмена, дать определение, выявить их отличие от других типов химических реакций, научиться составлять уравнения реакций обмена. Должны будем понять какие условия или факторы обязательны для выполнения.
Усвоение новых знаний и способов действий.
Учитель: Ребята давайте вернемся к нашей первой реакции обмена, с которой мы сегодня познакомились, посмотрим на нее и попробуем самостоятельно вывести определение реакции обмена. Запись в тетрадь (Реакции обмена – это реакции, протекающие между двумя сложными веществами, результате чего они обмениваются своими составными частями).
Создание проблемной ситуации: французский химик Клод Луи Бертолле сформулировал правило, согласно которому протекают реакции обмена между растворами сложных веществ. «Реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ) или малодиссоциирующее соединение (очень слабый электролит в т.ч. вода). Как вы думаете верно ли это утверждение?
Для того чтобы доказать или опровергнуть это утверждение мы должны провести химический эксперимент.
Лабораторный опыт №1. Взаимодействие гидроксида натрия с сульфатом меди ( II )
Для того чтобы определить продукты реакции составим уравнение химической реакции
Какое вещество выпало в осадок? Чтобы ответить на этот вопрос необходимо узнать какое вещество растворяется, а какое нет. Обратимся к таблице растворимости. Вещество Cu ( OH ) 2 – нерастворимо, а следоватеьно выпало в осадок. (гидроксид меди – новое сложное вещество)
Вывод: выпадение осадка одно из условий того, что реакция идет до конца.
Лабораторный опыт №2. Взаимодействие раствора щелочи с раствором кислоты.
Инструкция: В пробирку нальем раствор щелочи и добавим несколько капель ф/ф. Что наблюдаем? (Ф/ф в растворе щелочи приобретает малиновый цвет, это говорит о щелочной реакции среды). К раствору щелочи приливаем раствор соляной кислоты. Что наблюдаем (Восстановление цвета индикатора, что является признаком химической реакции)
Составим уравнение химической реакции
NaOH +ф/ф+ HCl = NaCl + H 2 O
окраска малиновая раствор обесцветился
Вывод: Если в результате реакции образуется вода, то такие реакции
протекают до конца
В результате реакции обмена между растворами щелочи и кислоты образовался раствор с нейтральной средой – такая реакция называется реакцией нейтрализации.
Лабораторный опыт №3. Взаимодействие раствора карбоната натрия с раствором азотной кислоты.
Составим уравнение химической реакции
В таком виде записанное уравнение реакции не показывает образование газа. Угольная кислота в свободном виде не существует, т.к. является нестойкой и легко разлагается на воду и соответствующий оксид. (степень окисления углерода в кислоте и оксиде одинаковая + 4).
Вывод: Если в результате реакции образуется газ, следовательно реакция идет до конца (т.е. практически возможна).
Учитель: Мы с вами выяснили, что химические реакции обмена идут до конца в нескольких случаях. Назовите их. ( ребята отвечают)
Проверка понимания изученного, закрепление знаний
Какие из реакций обмена будут протекать до конца? Почему?
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl
Cu(NO3)2 + 2NaCl → CuCl2 + 2NaNO3
2НNO3 + К2S → Н2S↑ + 2KNO3
Mg( ОН )2 + Н 2SO4 → MgSO4 + 2H2O
2HNO3 + ZnSO4 → H2SO4 + Zn(NO3)2
2. Реакция обмена протекает между сложными веществами, которые обмениваются своими составными частями.
3. Реакция обмена идет до конца, только когда образуется вода.
4. Реакция обмена идет до конца, когда образуется газ, осадок или вода.
5. Реакция обмена идет до конца, только когда образуется газ.
6. Реакция между кислотой и основанием называется реакцией нейтрализации.
7.Любая реакция обмена является реакцией нейтрализации.
3. Самостоятельная работа:
Закончите уравнения химических реакций и расставьте коэффициенты:
Подведение уроков. Рефлексия
Вернемся к теме сегодняшнего урока.
Какую цель мы поставили в начале урока?
К какому выводу мы пришли?
— Что нового вы узнали на уроке?
— Какие затруднения у вас возникли при работе на уроке?
— Что до сих пор остаётся непонятным?
ДЛЯ УЧЕНИКОВ
Закончите уравнения химических реакций и расставьте коэффициенты:
Закончите уравнения химических реакций и расставьте коэффициенты:
Закончите уравнения химических реакций и расставьте коэффициенты:
Закончите уравнения химических реакций и расставьте коэффициенты:
Закончите уравнения химических реакций и расставьте коэффициенты: