Что такое репликация в медицине
Репликация вирусов
Репликация вирусов
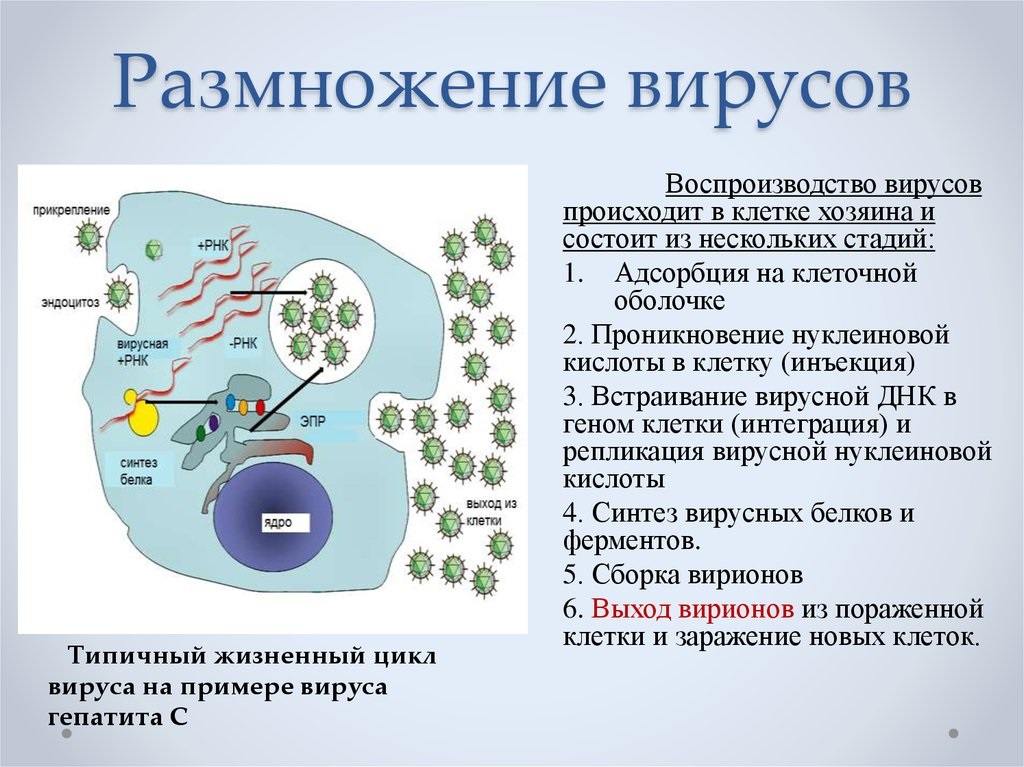
Размножение вируса, или репликация, является весьма характерным процессом, свойственным только обитателям этого особого мира природы. Как известно, рост организмов растительного и животного мира природы невозможен без деления клеток. Вирус же вообще не увеличивается в размерах. Вирусные частицы появляются сразу «взрослыми» в результате своеобразного процесса, названного репликацией. Но самое поразительное — то, что в продуцировании новых вирусных частиц участвует только одна нить: одинарная цепочка нуклеиновой кислоты.
Проследим за нуклеиновой кислотой бактериофага, проникшей в клетку бактерии. Первым делом ДНК выключает жизненно важные для клетки хозяина процессы. Затем начинают образовываться специфические вещества ферменты, идущие на строительство молекул ДНК, точно таких же, какие были и у бактериофага. Примерно через 8 мин образование ферментов замедляется и начинают образовываться белки капсидов. На строительство цепочек нуклеиновых кислот потомства кроме ферментов идет часть родительской ДНК бактериофага и разбитая ДНК хозяина. Капсиды новых бактериофагов строятся из вновь образованных белков; сюда же идет часть белков разрушенной клетки и старого бактериофага.
Примерно через 15 мин после инфицирования в клетке бактерий образуется столько вирусных частиц, что им становится тесно. Они разрывают оболочку хозяина и вырываются наружу, заражают новые клетки бактерий и т. д.
Репликация вирусов как сборочный конвейер
Часто процесс репликации вирусов сравнивают с заводским сборочным конвейером, действующим по заранее разработанному технологическому процессу. Сначала под руководством ДНК идет изготовление строго определенных элементов деталей. Далее ДНК вырабатывает белки своей сферы и ядрышко, вокруг которого белки под влиянием электростатических сил собираются в сферу. Ядрышко уничтожается, после того как образовалась головка-сфера. Один из ответственейших моментов сборки — заполнение сферы цепочкой ДНК. К этому моменту из отдельных участков «цеха сборки» к «главному конвейеру» подаются недостающие детали бактериофага: стержень, сократительные кольца, пластинки, нити. Эти детали друг за другом прикрепляются к сфере.
Интересно, что «рабочие» операции по сборке вирусов сходны с процессами зарождения и развития более сложных организмов. Не заимствованы ли эти приемы из мира вирусов?
Кстати, технические приемы репликации различных видов вирусов не только состоят из общих операций, но имеют и некоторые особенные черты. Так, вирусы оспы размножаются в цитоплазме, а вирусы группы герпеса и аденовирусы — в ядре. В процессе построения нуклеиновых кислот участвуют разрушенные системы клетки хозяина. Следовательно, вирусам оспы и аденовирусам придется использовать различный строительный материал. Эти вирусы относятся к группе крупных вирусов. Например, в молекуле ДНК вируса осповакцины закодировано около 500 белков. Цикл размножения длится более 20 ч. Можно представить, как сложно контролировать процесс репликации вируса! И если системы, отвечающие за последовательность сборки, хоть раз ошибутся, вирусу не удастся «самособраться». Запомните это уязвимое место в процессе репликации.
РЕПЛИКАЦИЯ
Репликация (позднелат. replicatio повторение; син. редупликация) — процесс биосинтеза молекул дезоксирибонуклеиновых кислот, в результате к-рого из одной молекулы образуются две дочерние, полностью идентичные материнской. Репликация дезоксирибонуклеиновых кислот (см.) обеспечивает передачу полного комплекса наследственной генетической информации от поколения к поколению (см. Наследственность). Свойство молекул ДНК редуплицироваться проявляется и в репродукции хромосом (см.) высших организмов.
Согласно модели, предложенной Дж. Уотсоном и Ф. Криком, молекула ДНК представляет собой двойную спираль, построенную из комплементарных друг другу цепей дезоксирибонуклеотидов. В процессе Репликации водородные связи между парами нуклеотидов разрываются и к ним присоединяются новые, комплементарные соответствующим дезоксирибонуклеотидам дезоксинуклеозидтрифосфаты. Процесс соединения нуклеотидов в полинуклеотидную цепь происходит с отщеплением пирофосфата. Репликация ДНК носит характер полуконсервативного процесса, т. е. каждая дочерняя двойная спираль включает в себя одну материнскую и одну вновь синтезированную полинуклеотидную цепь.
Образованию вилки репликации предшествует взаимодействие с молекулой ДНК особого белка (ДНК-раскручивающего белка), устраняющего суперспиральные витки и локально раскручивающего двойную спираль ДНК. Предполагают, что ДНК-раскручнвающий белок встраивается в дезоксирибозофосфатную цепь. Эта реакция обратима: после высвобождения ДНК-раскручивающего белка спиральная структура ДНК восстанавливается. Локальное расхождение комплементарных цепей ДНК обеспечивают белки-дестабилизаторы двойной спирали ДНК. Присоединяясь к ДНК, белки-дестабилизаторы снижают термостабильность ее молекулы, к-рая приобретает способность плавиться при температуре на 40° ниже обычной температуры плавления.
Рост новой цепи ДНК в вилке репликации катализируется ферментом ДНК-полимеразой (см. Полимеразы). В клетках высших организмов и бактерий обнаружено несколько форм ДНК-полимераз, но Р. генома у эукариотов осуществляется только под действием ДНК-полимеразы а, а у бактерий — ДНК-полимеразы III. Комплементарные цепи двойной спирали ДНК антипараллельны по ориентации углеродных атомов дезоксирибозы (см.). Следовательно, при движении вилки репликации одна дочерняя цепь должна нарастать в направлении 5′ —> 3′, а другая — в направлении 3′ —> 5′. Вместе с тем все ДНК-полимеразы способны присоединять новые нуклеотиды только к З’-гидроксильной группе дезоксирибозы растущей цепи ДНК, тем самым обеспечивая синтез только в направлении 5′ —> 3′, т. е. первым образуется 5′-конец новой цепи. Сама ДНК-полимераза к тому же не способна инициировать синтез новых цепей на одноцепочечной ДНК-матрице. Было установлено, что обе эти трудности преодолеваются путем синтеза на одной цепи коротких полинуклеотидных фрагментов с полярностью 5′ —> 3′ в направлении, противоположном движению вилки репликации (рис. 2). При этом инициацию Р. каждого нового фрагмента ДНК осуществляет фермент РНК-полимераза (так наз. примаза), при участии к-рого на ДНК-матрице синтезируется инициатор (затравка) — короткий участок РНК (так наз. РНК-праймер), к 3′-гидроксильной группе рибозы к-рого ДНК-полимераза начинает присоединять дезоксирибонуклеотиды. Впоследствии РНК-праймер удаляется экзонуклеазой (см. Нуклеазы), а образовавшаяся брешь закрывается ДНК-полимеразой. У Escherichia coli 5′ —> З’-экзонуклеазной активностью обладает ДНК-полимераза I.
Отдельные полинуклеотидные фрагменты сшиваются между собой ферментом ДНК-лигазой (КФ 6.5.1.1; 6.5.1.2). При этом одна из двух цепей ДНК растет непрерывно (ведущая нить), а другая — прерывисто (запаздывающая нить). Фрагменты прерывистого синтеза ДНК называют фрагментами Окадзаки (Оказаки) по имени открывшего их японского ученого Окадзаки (R. Okazaki). У бактерий фрагменты Окадзаки имеют длину ок. 1000 нуклеотидных пар, а их РНК-праймер — 50—200 нуклеотидных пар. У высших организмов фрагменты Окадзаки состоят приблизительно из 150—200 нуклеотидных пар, а их РНК-праймер — из 10—20 пар.
Присоединив очередной нуклеотид к растущей цепи ДНК, ДНК-полимераза «сверяет» его с партнером на цепи-матрице, и в случае несоответствия паре (А — Т или Г — Ц) та же полимераза проявляет 3′ —> 5′-экзонуклеазную активность, удаляя ошибочно присоединенный нуклеотид. Т. о. осуществляется коррекция, обеспечивающая высокую точность процесса Р. молекул ДНК, что определяет сохранность наследственной информации в ряду поколений клеток и организмов.
В клетках, размножающихся путем митоза (см.), и у бактерий репликация ДНК происходит между актами деления клеток; в мейозе (см.) ДНК редуплицируется один раз перед двумя следующими друг за другом делениями, что приводит к редукции (уменьшению) вдвое количества ДНК (как и числа хромосом) на клетку. Этот отрезок интерфазы называют периодом синтеза ДНК или S-периодом.
Репликацияначинается (инициируется) в определенных участках молекулы ДНК (по терминологии Ф. Жакоба — репликаторах), первичная структура к-рых характеризуется высоким содержанием пар А — Т и наличием так наз. обратных повторов (палиндромов). От точки инициации движутся либо одна, либо две вилки репликации (в последнем случае они движутся в противоположные стороны), обеспечивая элонгацию (удлинение) вновь синтезирующихся участков молекулы ДНК. Терминация (окончание) Р. происходит либо при слиянии двух вилок репликации, двигающихся навстречу друг другу, либо в специальных точках терминации Р.
Отрезок молекулы ДНК, реплицирующийся в результате одного акта инициации, называют единицей репликации или реплпконом. В геноме бактерий, как правило, имеется всего один участок инициации Р., связанный с клеточной мембраной. Кольцевая молекула ДНК генома бактерии реплицируется как один репликон. В геноме эукариотов Р. осуществляется полирепликонно, т. е. инициация Р. происходит одновременно во многих точках по длине молекул ДНК. Установлено, что на молекулах ДНК генома эукариотов имеется большое число потенциальных точек инициации Р., расположенных на расстоянии 1—4 мкм друг от друга. В зависимости от того, сколько потенциальных точек инициации вовлечены в Р., может меняться размер репликона. Напр., при репликации ДНК в дробящихся яйцах дрозофилы, где деления клеток следует очень быстро одно за другим, в Р. включается каждая вторая или третья потенциальная точка Р. и размер репликации равен 9—12 мкм; при удвоении ДНК соматических клеток эукариотов в Р. участвует в среднем 1 из 10 или даже из 100 потенциальных точек инициации Р. и размер репликонов увеличивается до 30—300 мкм.
Репликация ДНК вирусов в основном сходна с репликацией ДНК высших животных и бактерий; она осуществляется ферментами клетки хориона. В нек-рых случаях (вирусы герпеса) РНК-затравка обнаруживается в составе вирионной ДНК. У онкогенных ДНК-содержащих вирусов (паповавирусы) ДНК может интегрировать в геном клетки, после чего репликация вирусной ДНК происходит вместе с ДНК клетки.
Репликация большинства РНК-содержащих вирусов осуществляется вирусспецифическими ферментами — РНК-зависимыми РНК-полимеразамн (репликазы), к-рые достраивают комплементарную нить на вирионной РНК-матрице, образуя так наз. репликативные формы РНК.
У онкогенных РНК-содержащих вирусов (см. Ретровирусы) Р. осуществляется ферментом РНК-зависимой ДНК-полимеразой (обратная транскриптаза, ревертаза), к-рый синтезирует ДНК-копию вирусного генома, способного встраиваться в геном клетки (см. Вирусы).
У бактерий и эукариотов, как правило, в каждом цикле деления клеток должна реплицироваться вся ДНК и при этом только один раз. Это значит, что должны существовать регуляторные системы, контролирующие инициацию Р. и отличающие родительские и дочерние молекулы. Механизм такой регуляции пока не ясен.
В определенных случаях (в норме и при патологии) может происходить многократная Репликация всего генома без последующего деления клетки (это приводит к возникновению полиплоидных ядер ) или Р. отдельных частей генома без Р. всего генома, так наз. экстрарепликация (напр., амплификация ДНК рибосомного гена в оогенезе нек-рых животных). Описаны случаи недорепликации части ДНК генома в клетках эукариотов. Это касается только ДНК гетерохроматина, в к-ром нет генов, необходимых для жизнеобеспечения клетки.
Сходство ферментов Репликации и основных процессов, происходящих в вилке репликации, у прокариотов и эукариотов свидетельствует о высокой эволюционной стабильности и жестком генетическом контроле процесса репликации ДНК. Нарушения нормального процесса Репликации влияют на деление и могут привести к гибели клеток.
Библиография: Бостон К. и Самнер Э. Хромосома эукариотической клетки, пер. с англ., с. 248, М., 1981; Корнберг А. Синтез ДНК, пер. с англ., М., 1977; Уотсон Д ж. Молекулярная биология гена, пер. с англ., М., 1978; DNA synthesis, ed. by J. Molineux a. M. Kohiyama, N. Y.— L., 1978; Jacob F., Brenner S. a. Сuzin F. On the regulation of DNA replication in bacteria, Cold Spr. Harb. Symp. quant. Biol., v. 28, p. 329, 1963.
Вирусные гепатиты
Вирусный гепатит А
Гепатит А (ГА, hepatitis A) — острая энтеровирусная инфекция. Возбудитель — вирус гепатита А (ВГА, HAV) — энтеровирус типа 72. Геном вируса представлен однонитчатой РНК. Вирус гепатита А содержит единственный антиген (HA-Ag). Удельный вес гепатита А в суммарной заболеваемости вирусными гепатитами составляет 70–80 %. В структуре заболеваемости гепатитом А дети составляют до 80%, причем основная масса — дошкольники и школьники начальных классов.
Антитела IgM к вирусу гепатита А
Антитела IgM к вирусу гепатита А в сыворотке в норме отсутствуют. Достоверное подтверждение диагноза ГА достигается серологическими методами — обнаружением нарастания уровня специфических антител (анти-HAV), принадлежащих к иммуноглобулинам класса М (анти-HAV IgM). При гепатите А нарастание уровня антител, относящихся к IgM, начинается еще в инкубационном периоде, за 5–10 дней до появления первых симптомов болезни, и быстро прогрессирует. К моменту первичного обращения больного к врачу, уровень анти-HAV IgM успевает достичь высоких показателей, чтобы быть выявленным методом ИФА. Общепринято, что анти-HAV IgM у больных обнаруживаются в начале клинических проявлений заболевания и сохраняются до 6 мес после перенесенной инфекции.
Определение анти-HAV IgM
В настоящее время выделяют следующие формы вирусных гепатитов: гепатит А, гепатит В, гепатит С, гепатит D и гепатит Е. Для диагностики каждой из перечисленных форм вирусных гепатитов используют определенный перечень маркеров.
Определение анти-HAV IgG
Основной тест специфической диагностики гепатита А. Нарастание анти-HAV IgG происходит в более поздние сроки — в фазу реконвалесценции — и поэтому не может служить критерием ранней диагностики гепатита А. Выявление анти-HAV IgG у здоровых людей (возможно у 30–60% здорового населения) свидетельствует о предыдущей инфекции и иммунитете (ретроспективная диагностика).
Антиген гепатита А — HA-Ag
Появляется в сыворотке крови в конце преджелтушного периода. У большинства больных сохраняется в сыворотке крови на протяжение 1–2 недель заболевания. Из-за кратковременности пребывания в сыворотке крови больного для диагностических целей не используется.
Вирусный гепатит В
Гепатит В — вирусная антропонозная инфекция. Возбудитель — вирус гепатита В (ВГВ, HBV) — относится к семейству гепаднавирусов, ДНК-содержащих вирусов, поражающих клетки печени. Вирионы ВГВ имеют наружную липопротеидную оболочку и нуклеокапсид, содержащий двунитчатую циркулярную ДНК и ДНК-зависимую ДНК-полимеразу.
Поверхностный антиген (HBsAg) гепатита В в сыворотке
Поверхностный антиген гепатита В в сыворотке в норме отсутствует. Обнаружение поверхностного антигена (HBsAg) гепатита В в сыворотке подтверждает острое или хроническое инфицирование вирусом гепатита В (HBV).
При остром заболевании HBsAg выявляется в сыворотке крови в последние 1–2 недели инкубационного периода и в первые 2–3 недели клинического периода. Циркуляция HBsAg в крови может ограничиваться несколькими днями, поэтому следует стремиться к раннему первичному обследованию больных. Частота выявления HBsAg зависит от чувствительности используемого метода исследования. Метод ИФА позволяет выявить HBsAg более чем у 90% больных. Почти у 5% больных самые чувствительные методы исследования не обнаруживают HBsAg, в таких случаях этиология вирусного гепатита В подтверждается наличием анти-HBcAg IgM. Концентрация HBsAg в сыворотке крови при всех формах тяжести гепатита В в разгар заболевания имеет значительный диапазон колебаний, вместе с тем имеется определенная закономерность: в остром периоде существует обратная связь между концентрацией HBsAg в сыворотке и тяжестью болезни.
Высокая концентрация HBsAg чаще наблюдается при легких и средне-тяжелых формах болезни. При тяжелых и злокачественных формах, концентрация HBsAg в крови чаще низкая, причем у 20% больных с тяжелой формой и 30% со злокачественной антиген в крови может вообще не обнаруживаться. Появление на этом фоне у больных антител к HBsAg расценивается как неблагоприятный прогностический признак; он определяется при злокачественных формах (фульминантных) гепатита В.
При остром течении гепатита В, концентрация HBsAg в крови постепенно снижается, вплоть до полного исчезновения этого антигена. HBsAg исчезает у большинства больных в течение 3 мес от начала острой инфекции. Снижение концентрации HBsAg более чем на 50 % к концу 3-й недели острого периода, как правило, свидетельствует о близком завершении инфекционного процесса. Обычно у больных с высокой концентрацией HBsAg в разгар болезни он обнаруживается в крови в течение нескольких месяцев. У больных с низкой концентрацией HBsAg исчезает значительно раньше (иногда через несколько дней после начала заболевания). В целом, срок обнаружения HBsAg колеблется от нескольких дней до 4–5 мес. Максимальный срок обнаружения HBsAg при гладком течении острого гепатита В не превышает 6 мес от начала заболевания.
HBsAg может быть выявлен у практически здоровых людей, как правило, при профилактических или случайных исследованиях. В таких случаях исследуют другие маркеры вирусного гепатита В — анти-HBcAg IgM, анти-НВс IgG, анти-HBeAg и изучают функцию печени. При отрицательных результатах необходимы повторные исследования на HBsAg. Если повторные исследования крови в течение более 3 месяцев выявляют HBsAg, такого человека относят к хроническим носителям поверхностного антигена. Носительство HBsAg — довольно распространенное явление. В мире насчитывается более 300 млн носителей; у нас в стране — около 10 млн.
Исследование крови на наличие HBsAg применяют в следующих целях:
Антитела к поверхностному антигену гепатита В
Анти-HBsAg обнаруживаются в конце острого периода вирусного гепатита В или, чаще всего, через 3 мес от начала инфекции, изредка позже (до года) и сохраняются долго, в среднем 5 лет (Хазанов А.И., 1981). Анти-HBsAg обнаруживаются не сразу после исчезновения HBsAg. Продолжительность фазы «окна» варьирует от нескольких недель до нескольких месяцев. Антитела к поверхностному антигену гепатита В нейтрализуют вирус и рассматриваются как признак иммунитета. Они относятся к классу IgG.
Определение анти-HBsAg имеет важное значение для оценки течения гепатита В и его исходов, так как характеризует иммунный ответ конкретного больного. Это надежный критерий развития постинфекционного иммунитета и выздоровления. Выявление анти-HBsAg может служить критерием ретроспективной диагностики гепатита ранее не уточненной этиологии.
Анти-HBsAg свидетельствуют о ранее перенесенной инфекции. Выявление антител к HBsAg играет важную роль в определении контингента для вакцинации против гепатита В. Согласно рекомендациям ВОЗ, если уровень анти-HBsAg составляет менее 10 мМЕ/л, таким лицам показана вакцинация против гепатита В, при уровне 10–100 мМЕ/л вакцинация должна быть отложена на один год, при уровне более 100 мМЕ/л вакцинация показана через 5–7 лет.
Общие антитела к ядерному антигену гепатита В состоят из иммуноглобулинов класса М и G. Определение общих антител к ядерному антигену гепатита В может использоваться только для ретроспективной диагностики гепатита В, так как у 5–10 % больных исследования на HBsAg дают отрицательный результат. Для того чтобы установить, в какой стадии развития находится гепатит В, необходимо дополнительное определение антител IgM. Антитела класса IgM — маркер активной репликации вируса, т.е. острой инфекции, а антитела класса IgG — перенесенной инфекции.
Антитела IgM к ядерному антигену гепатита В (анти-HBcAg IgM) в сыворотке
Анти-HBcAg IgM в сыворотке в норме отсутствуют. Анти-HBcAg IgM обнаруживаются уже в начале острой фазы болезни, еще до появления или в первые дни желтухи, иногда даже в конце инкубации. Выявление анти-HBcAg IgM расценивают как убедительный критерий диагностики гепатита В, особенно при отрицательных результатах исследования на HBsAg. Анти-HBcAg IgM циркулируют в крови больных в течение нескольких месяцев (2–5 месяца) до периода реконвалесценции, а затем исчезают, что рассматривается как признак очищения организма от вируса гепатита В.
Установлено, что высокие концентрации HBeAg соответствуют высокой ДНК-полимеразной активности и характеризуют активную репликацию вируса. Наличие HBeAg в крови свидетельствует о высокой ее инфекциозности, т.е. присутствии в организме обследуемого активной инфекции гепатита В и обнаруживается только в случае присутствия в крови HBs-антигена. У больных хроническим активным гепатитом противовирусные препараты применяют только при обнаружении в крови HBeAg.
Наличие НВе-антигена свидетельствует о продолжающейся репликации вируса и инфекциозности больного. HBeAg-антиген — маркер острой фазы и репликации вируса гепатита В.
Анти-HBeAg в сыворотке в норме отсутствуют. Появление АHTH-HBeAg-антител указывает обычно на интенсивное выведение из организма вируса гепатита В и незначительное инфицирование больного. Эти антитела появляются в острый период и сохраняются до 5 лет после перенесенной инфекции. При хроническом персистирующем гепатите, анти-HBeAg обнаруживаются в крови больного вместе с HBsAg. Сероконверсия, т.е. переход HBeAg в анти-HBeAg при хроническом активном гепатите, чаще прогностически благоприятна, но такая же сероконверсия при выраженной цирротической трансформации печени прогноза не улучшает.
Гепатит С (ГС, hepatitis С) — вирусное заболевание, наиболее часто протекающее в виде посттрансфузионного гепатита с преобладанием безжелтушных и легких форм и склонное к хронизации процесса. Возбудитель — вирус гепатита С (ВГС) — имеет сходство с флавови-русами, содержит РНК.
Примерно 90% всех случаев посттрансфузионных гепатитов связаны с ВГС. Среди доноров антитела к вирусу гепатита С (анти-ВГС) обнаруживают в 0,2–5% случаев. У 40–75% пациентов регистрируется бессимптомная форма болезни, у 50–75% больных острым ВГС формируется хронический гепатит, у 20% из них развивается цирроз печени. Важная роль ВГС отводится и в этиологии гепатоклеточной карциномы.
Антитела к вирусу гепатита С в сыворотке
Антитела к вирусу гепатита С в сыворотке в норме отсутствуют. Диагностика гепатита С основана на обнаружении суммарных антител к ВГС методом ИФА, которые появляются в первые 2 нед заболевания и свидетельствуют о возможной инфицированности вирусом или перенесенной инфекции. Анти-ВГС-антитела могут сохраняться в крови реконвалесцентов на протяжении 8–10 лет с постепенным снижением их концентрации. Возможно позднее обнаружение антител спустя год и более после инфицирования.
При хроническом гепатите С, антитела определяются постоянно и в более высоких титрах. Существующие в настоящее время тест-системы для диагностики ВГС основаны на определении антител класса IgG, поэтому разрабатываются тест-системы нового поколения, которые позволят верифицировать активную инфекцию (определять антитела класса IgM). Антитела класса IgM могут выявляться не только при остром ВГС, но и при хроническом гепатите С. Снижение их уровня в процессе лечения больных хроническим гепатитом С может свидетельствовать об эффективности лекарственной терапии. Обнаружение антител к ВГС методом ИФА требует подтверждения способом иммуноблотинга для исключения ложно-положительного результата исследования.
Определение антител к вирусу гепатита С используют для диагностики острого и хронического гепатита С, персистирующего хронического гепатита. Вирус гепатита С может быть причиной развития цирроза и рака печени, поэтому данное исследование показано при этих заболеваниях.
Иммуноблотинг на антитела к белкам вируса гепатита С в сыворотке
Антитела к вирусу гепатита С в норме отсутствуют. Метод иммуноферментного анализа, применяемый для определения антител к ВГС, является скрининговым. В случае получения положительного результата для подтверждения его специфичности используют метод иммуноблотинга Western-blot — встречную преципитацию в геле антител в сыворотке крови больного с различными вирусными белками, подвергнутыми разделению по молекулярной массе с помощью электрофореза и нанесенными на нитроцеллюлозу. Исследование считается положительным, если выявляются антитела к белкам интенсивностью +1 к 2 или более антителам ВГС. Специфичными для ВГС являются антитела к белкам — Core, NS3-1, NS3-2, NS1, NS5.
Иммуноблотинг на вирус гепатита С служит подтверждающим тестом специфичности метода ИФА.
Вирусный гепатит D
Гепатит D — вирусная инфекция, протекающая вследствие биологических особенностей вируса исключительно в виде ко-или суперинфекции при гепатите В, характеризующаяся тяжелым течением часто с неблагоприятным исходом.
Возбудитель — вирус гепатита D (BГD) — по своим биологическим свойствам приближается к вироидам — обнаженным молекулам нуклеиновых кислот. Печень человека — единственное место репликации BГD. Известно существование двух вариантов инфекции: коинфекция (одновременное заражение ВГВ и BГD) и суперинфекция (заражение HBsAg-позитивных пациентов). Сочетание ВГВ и BГD сопровождается развитием более тяжелых форм патологического процесса, что определяется главным образом действием BГD. Летальность при суперинфекции достигает 5–20 %. Инфицирование дельта-вирусом может вызывать острое заболевание, заканчивающееся выздоровлением, или формировать хроническое носительство BГD.
При гепатите D могут отсутствовать в крови маркеры гепатита В — анти-НВс и HBs-антиген — и наблюдается угнетение ДНК-полимеразной активности, так как BГD ингибирует репликацию вируса гепатита В.
Антитела lgM к вирусу гепатита D в сыворотке
Антитела IgM к вирусу гепатита D в сыворотке в норме отсутствуют. Антитела BГD IgM (анти-BГD IgM) появляются в острый период «дельта-инфекции». По мере выздоровления при BГD происходит элиминация вируса из печени и исчезновение анти-BГD IgM. При хронизации процесса наблюдается персистирование BГD в ткани печени и анти-BГD IgM в высокой концентрации в крови. Антитела BГD IgM говорят об активной репликации вируса.
Антитела IgG к вирусу гепатита D в сыворотке
Антитела IgG к вирусу гепатита D в сыворотке в норме отсутствуют. Антитела BГD IgG (анти-BГD IgG) появляются в период реконвалесценции, и их концентрация постепенно снижается в течение нескольких месяцев. Определение антител BГD IgG может служить критерием ретроспективной диагностики гепатита ранее не уточненной этиологии.
Возбудителем вирусного гепатита Е (ВГЕ) является РНК-вирус. Для заболевания характерен фекально-оральный путь передачи, преимущественно водный. Инкубационный период болезни — около 35 сут. Клиническое течение острого ВГЕ сходно с ВГА. Существенно тяжелее заболевание протекает у беременных, особенно в III триместре.
Для специфической диагностики ВГЕ используются методы ИФА, основанные на выявлении антител класса IgM. Обнаружение в крови повышенного уровня анти-ВГЕ IgM служит лабораторным подтверждением диагноза.
ПЕРИОДЫ ОБНАРУЖЕНИЯ В КРОВИ МАРКЕРОВ ВИРУСНОГО ГЕПАТИТА В ПРИ ОСТРОМ ПРОЦЕССЕ:
1) поверхностный HBs-антиген — с инкубационного периода до периода ранней реконвалесценции (5,5–6 мес);
2) антиген НЬе обнаруживается в инкубационный и продромальный периоды (до 3,5 мес); его выявление свидетельствует о репликации вируса;
3) антитела к Hbe-антигену появляются в острый период заболевания (3–4-й месяц) и сохраняются до нескольких лет;
4) антитела класса IgM к ядерному антигену (анти-HBc-IgM) обнаруживаются в продромальном периоде и сохраняются до периода реконвалесценции (со 2-го по 6-й месяц заболевания);
5) антитела класса IgG к ядерному антигену (анти-HBc-IgG) возникают в продромальном периоде и сохраняются на протяжении всей жизни (ведущий маркер вирусного гепатита В);
6) антитела к поверхностному Hbs-антигену (анти-HBs) появляются в стадии поздней реконвалесценции (6-й месяц) и сохраняются до 5 лет.