Что такое респираторный индекс
Соотношение SpO2 / FiO2 при поступлении в больницу является показателем раннего развития острого респираторного дистресс-синдрома у пациентов из группы риска
Индекс оксигенации (oxygenation index, OI; PF ratio – PF соотношение; респираторный индекс, PaO2 / FiO2 ) — это параметр, используемый в анестезиологии-реаниматологии и интенсивной терапии для оценки функции обмена кислорода в легких. Расчет индекса оксигенации производят по формуле, как соотношение PaO2 / FiO2 (отношение парциального напряжения кислорода в артериальной крови к фракции кислорода на вдохе). Данный критерий относится к международным шкалам, которые ежедневно используются в рутинной практике анестезиолога. Однако не всегда есть возможность исследования артериальной крови, в данной статье описывается возможность оценки соотношения насыщения кислородом к фракции вдыхаемого кислорода (SpO (2) / FiO (2)) как прогностического маркера в плане развития острого респираторного дистресс-синдрома (ОРДС)
ЦЕЛЬ: Отношение насыщения кислородом к фракции вдыхаемого кислорода (SpO (2) / FiO (2) ) было подтверждено в качестве суррогатного маркера парциального давления кислорода к доле вдыхаемого кислорода у механически вентилируемых пациентов с острым респираторным дистресс-синдромом (ОРДС). Достоверность измерений SpO (2) / FiO (2) при прогнозировании ОРДС не изучалась. Недавно был разработан показатель прогнозирования травм легких (LIPS- Lung Injury Prediction Score), чтобы помочь идентифицировать пациентов с риском развития ОРДС.
МЕТОДЫ: Это был вторичный анализ когорты LIPS-1. Многофакторная логистическая регрессия включала все установленные переменные для LIPS, оценки острой физиологии и хронического здоровья, возраста и сопутствующих состояний, которые могут влиять на SpO (2) / FiO ). Первичным результатом было развитие ОРДС в стационаре. Вторичные исходы включали в себя смертность в больнице, больничный день развития ОРДС и больничный день смерти.
Информативность индекса оксигенации при диагностике острого респираторного дистресс-синдрома
Полный текст:
Аннотация
Об авторах
Список литературы
2. Кассиль В. Л., Золотокрылина Е. С.Острый респираторный дистресс-синдром. М.: Медицина; 2003.
3. Мороз В. В., Власенко А. В., Закс И. О.Прошлое и будущее определений понятий острого повреждения легких и респираторного дистресс-синдрома и их лечение. Новости науки и техники. Серия Медицина. Выпуск Реаниматология и интенсивная терапия. Анестезиология. ВИНИТИ РАН НИИ ОР РАМН. 2000; 3: 2—1
4. Неговский В. А., Гурвич А. М., Золотокрылина Е. С.Постреанимационная болезнь. М.: Медицина; 1979.
5. Рябов Г. А.Гипоксия критических состояний. М.: Медицина; 1988.
6. Шанин Ю. Н, Костюченко А. Л.Реанимационная терапия острых дыхательных расстройств. Реаниматология. Л.; 1975. 39—195.
7. Ashbaugh D. G, Bigelow D. B., Petty T. L., Levine B. E.Acute respiratory distress in adults. Lancet 1967; 2 (7511): 319—323.
8. Cooper A. B., Ferguson N. D., Hanly P. J. et al.Long-term follow-up survivors of acute lung injury: Lack of effect of ventilation strategy to prevent barotraumas. Crit. Care Med. 1999; 27 (12): 2616—2621.
9. Goss C. H, Brower R. G., Hudson L. D., Rubenfeld G. D.Incidence of acute lung injury in the United States. Crit. Care Med. 2003; 31 (6): 1607—1611.
10. Webster N. R., Cohen A. T., NunnJ. F.Adult respiratory distress syndrome — how many cases in the UK? Anaesthesia 1988; 43 (11): 923—926.
11. Gattinoni L., Pelosi P., Suter P. M. et al.Acute respiratory distress-syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? Am. J. Respir. Crit. Care Med. 1998; 158 (1): 3—11.
12. Calister M. E., Evans T. W.Pulmonary versus extrapulmonary acute respiratory distress-syndrome: different diseases ore just useful concept? Curr. Opin. Crit. Care. 2002; 8 (1): 5—21.
13. Murray J. F., Matthay M. A., Luce J. M., Flick M. R.An expanded difini-tion of the adult respiratory distress syndrome. Am. Rev. Respir. Dis. 1988; 138 (3): 720—723.
14. Pelosi P., D’Onofrio D., ChiumelloD. et al.Pulmonary and extrapul-monary acute respiratory distress-syndrome are different. Eur. Respir. J. Suppl. 2003; 42: 48—56.
15. Ware L. B., Matthay M. A.Alveolar fluid clearance is impaired in the majority of patients with acute lung injury and acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med. 2001; 163 (6): 1376—1383.
Для цитирования:
For citation:
Значение исследования глубокой картины кислородного статуса в неонатальном отделении реанимации и интенсивной терапии
Кушнерик Л. А., Паршин Е. В., Блинов С. А.
(ЛОГУЗ «ДКБ» г. Санкт-Петербург, главный врач к. м. н. Окунев А. Ю., Санкт-Петербургская Педиатрическая Медицинская академия кафедра анестезиологии-реаниматологии ФПК и ПП, зав. кафедрой д. м. н., профессор Александрович Ю. С.)
Исследование состояния поглощения кислорода легкими, его транспорта кровью, а также доставки тканям и потребления имеет огромное значение в терапии критических состояний. Ведь именно дисбаланс в системе «доставка — потребление кислорода» ведет к тканевой гипоксии. Тканевая гипоксия тесно связана с острой декомпенсированной циркуляторной недостаточностью, или шоком. По мнению Гордеева В. И. и Лебединского К. М., шок — это собирательное название различных видов острой циркуляторной недостаточности, в основе которых всегда лежит синдром малого сердечного выброса с тотальной тканевой ишемией [1]. Термин «циркуляторная» означает то, что именно гемодинамические расстройства являются ведущими в нарушении кислородного обеспечения организма. По мнению многих авторов, термин «ишемия» — это абсолютная или относительная недостаточность объемного кровотока в тканях, ведущая к гипоксии различной степени выраженности. Гипоксия приводит к смене аэробного окисления глюкозы на анаэробное, следствием чего является накопление в тканях значительного количества лактата и некоторых других кислых продуктов обмена. В результате повышается проницаемость капилляров, и значительная часть циркулирующей плазмы выходит за пределы сосудистого русла, обеспечивая уменьшение объема циркулирующей крови, или гиповолемию. Ведущей задачей терапии критических состояний является обеспечение такой доставки кислорода тканям, которая бы удовлетворяла потребность тканей в кислороде в условиях гиперкатаболизма [3].
Ошибочной является тактика по нормализации оксигенации, предусматривающая только изменение параметров искусственной вентиляции легких и повышение FiO2. Это часто не только не приводит к желаемому клиническому результату, но и усугубляет нарушения вентиляционно-перфузионных отношений, а также приводит к острому повреждению легких вентилятором [4]. Неэффективным, а порой и наносящим вред организму больного ребенка является априорное назначение инотропных препаратов, вазопрессоров, вазодилататоров, а также введение натрия гидрокарбоната с целью «улучшения состояния периферического кровотока».
Анализ состояния поглощения кислорода легкими, его транспорта, доставки и потребления тканями позволяет не только оценить глубину нарушений гомеостаза при критических состояниях, но и сфокусировать терапевтические усилия по устранению тканевой гипоксии.
Одной из ключевых задач в исследовании глубокой картины кислородного статуса организма является получение пробы цельной артериальной крови пациента. При необходимости систематического забора проб артериальной крови и непрерывного контроля за артериальным давлением у новорожденного ребенка рекомендуют катетеризировать пупочную артерию с первых часов жизни [5]. Однако, сама процедура катетеризации пупочной артерии, нахождение катетера в ней и взятие проб крови из этого сосуда связано с большим числом осложнений, достигающим, по мнению различных авторов от 15 [6] до 46% [7]. Низкая масса тела при рождении и тяжесть состояния существенно увеличивают процент осложнений, связанных с катетеризацией пупочной артерии [8]. В настоящее время описаны и другие грозные осложнения, например снижение церебрального кровотока у детей с экстремально низкой массой тела при рождении, наступающее во время забора пробы крови из пупочной артерии [9]. Несущественно меньшей является частота осложнений при использовании периферических артериальных линий у новорожденных детей, колеблющаяся по данным различных авторов от 8 до 55% [10, 11, 12]. При этом нельзя не учитывать, что это данные крупнейших клиник развитых стран, в меньшей степени, чем российские клиники сталкивающихся с проблемами квалификации медицинского персонала, эпидемиологической безопасности пациентов, кадрового и аппаратурного дефицита. В решении вопроса о методе выбора получения пробы артериальной крови имеет значение также и то, что забор пробы крови из артериальной линии связан с высоким риском ошибки разведения [13, 14].
Определенной альтернативой катетеризации артерии для получения пробы артериальной крови у новорожденных детей в критическом состоянии является артериальная пункция с использованием местного анестезирующего крема EMLA [15, 16, 17]. Наиболее удобной для пункции с целью взятия проб артериальной крови у новорожденных детей является лучевая артерия [18, 19]. Критерии выбора именно этого сосуда — это доступность для пункции (поверхностное расположение), размер артерии, наименьший риск осложнений во время и после пункции (наименьшая вероятность инфицирования при повторных пункциях), коллатеральное кровообращение, мягкие ткани в области проекции артерии в наименьшей степени подвержены избыточному накоплению внеклеточной жидкости. Место взятия пробы крови обязательно тщательно осматривается перед пункцией на предмет наличия локальных воспалительных изменений, высыпаний и гематом. Выявление изменений в области предполагаемой пункции артерии является противопоказанием для проведения процедуры. Наличие венозной линии, заведенной через одну из подкожных вен локтевого сгиба руки, не является противопоказанием для пункции лучевой артерии на этой руке. Для поверхностной анестезии интактной кожи перед пункцией лучевой артерии крем EMLA 5% наносится на кожу соответствующей области слоем приблизительно 2—3 мм толщиной под марлевую повязку, фиксирующуюся лейкопластырем. Доза препарата не должна превышать 0,5 г крема на 5 см 2 поверхности кожи. Время аппликации 20 минут является достаточным для обеспечения поверхностной анестезии у новорожденных перед пункцией артерии.
Чрезвычайно важным условием для исследования глубокой картины кислородного статуса организма является стабильность состояния пациента в течение как минимум 20 минут до забора пробы артериальной крови. Проба забирается через 20 минут после санации трахеобронхиального дерева, взвешивания, выполнения рентгенологического исследования и других инвазивных диагностических или лечебных процедур при условии сохранения в течение этого периода времени стабильного состояния больного. Одним из обязательных условий для пункции артерии с целью получения пробы крови является устранение артериальной гипотензии.
Перед пункцией лучевой артерии обязательна проверка коллатерального кровоснабжения кисти с помощью модифицированного теста Аллена. Модифицированный тест Аллена выполняется следующим образом: запястье ребенка осторожно сдавливается двумя руками на несколько секунд для прекращения кровотока по лучевой и локтевой артерии. Свидетельством прекращения кровотока в кисти является побледнение кожи кисти. Когда кисть бледнеет, надавливание прекращают и оценивают цвет кожи ладони и пальцев. Если кожа кисти розовеет в течение 3—5 секунд, это значит, что имеется хороший кровоток по локтевой артерии и можно выполнять пункцию лучевой артерии. Если цвет кожи кисти и пальцев не восстанавливается в течение более чем 10 секунд, это означает, что кровоток локтевой артерии недостаточный. В последнем случае пункция лучевой артерии противопоказана.
По литературным данным у 1,6% пациентов нет достаточного эффективного кровотока по локтевой артерии, что является противопоказанием для пункции лучевой артерии [13]. Однако нами за период 10 лет было выполнено более 1200 пункций лучевой артерии новорожденным детям, при этом явления недостаточно эффективного кровотока по локтевой артерии были выявлены только в 8 случаях.
Наиболее оптимальным на наш взгляд для пункционного взятия артериальной крови у новорожденных является использование самонаполняющегося шприца PICO 70 с присоединенной острой тонкостенной иглой с коротким срезом. Использование шприцов PICO 70 легко позволяет забирать малые объемы крови (до 0,5 мл). Легкое движение поршня данного шприца создает идеальные условия для полного поступления пробы крови после пункции артерии (аспирация) и при введении пробы крови в анализатор. Гепариновый диск в шприце существенно облегчает перемешивание пробы. Из шприца легко удаляются пузырьки воздуха, всегда образующиеся при аспирации крови из пунктированной артерии. Перед процедурой заранее подготавливается все необходимое оборудование. Пункция лучевой артерии у новорожденного ребенка проводится в стерильных условиях. Все действия осуществляются в перчатках. Перед выполнением пункции артерии поршень шприца PICO устанавливается на требуемый для исследования объем крови. Удаляются остатки крема EMLA. Кожа в области пункции обрабатывается антисептиком. Пальпаторно локализуется лучевая артерия. Рука ребенка удерживается выпрямленной в локте на ровной горизонтальной поверхности (матрац кувеза или кроватки) с разогнутой кистью. Пункция осуществляется строго по оси расположения артерии, в направлении против тока крови, под углом примерно 45º к поверхности кожи срезом иглы вверх. Когда игла входит в просвет артерии, шприц быстро наполняется кровью. При этом необходимо держать шприц и иглу неподвижно, не позволяя игле повредить стенку артерии. Когда шприц наполнится до заданного объема крови, игла извлекается из артерии. При извлечении иглы марлевый шарик держится рядом с иглой. В момент извлечения иглы из артерии марлевый шарик плотно прикладывается к месту пункции и удерживается с небольшим давлением в течение 5 минут. Это позволяет избежать кровотечения из места пункции и образования гематомы. После этого на область пункции накладывается марлевая повязка.
Затем игла шприца PICO 70 вставляется в специальную, прилагаемую в комплекте с шприцом, пробку. Удерживая павильон иглы пинцетом, игла отсоединяется от шприца. Удерживая шприц вертикально, постукивая по шприцу, используя марлевую салфетку, из шприца удаляются пузырьки воздуха. После удаления пузырьков воздуха шприц закрывается специальным колпачком, также прилагаемым в комплекте со шприцом PICO 70. Затем проба перемешивается, переворачивая шприц несколько раз и вращая его между ладонями. Исследование пробы артериальной крови для анализа показателей глубокой картины кислородного статуса проводится не позднее 5 минут после ее забора. Перед вводом пробы крови в анализатор удаляется несколько капель на марлевую салфетку.
Исследование показателей кислотно-основного состояния крови и кислородного статуса организма новорожденных детей в критическом состоянии проводится на анализаторе ABL800 FLEX (Radiometer, Дания). В отделении реанимации и интенсивной терапии областной детской клинической больницы шаги аналитического процесса осуществляют врачи.
Исследование кислородного статуса новорожденного ребенка, находящегося в критическом состоянии, означает комплексный анализ показателей, отражающих поглощение кислорода легкими, транспорт кислорода кровью, отдачу кислорода тканям и состояние кисло-родозависимого метаболизма в тканях.
Показатели кислородного статуса, отражающие поглощение кислорода легкими
Анализ расчетных индексов позволяет врачу сделать заключение о том, какой «ценой» достигнуто данное значение напряжения кислорода в артериальной крови, отражая степень нарушения диффузионной способности легких.
Показатели оценки транспорта кислорода кровью
Показатель, отражающий отдачу кислорода тканям
Дополнительные показатели оценки кислородного статуса
Анализ состояния кислородозависимого метаболизма в тканях оценивался по уровню лактата в крови ребенка. Определение лактата крови является важным показателем, отражающим тяжесть состояния больного, является методом мониторинга, оценки проводимой терапии и прогностического показателя исхода заболевания. Высокое содержание лактата всегда указывает на критическое состояние пациента и является прогностически неблагоприятным [20, 21, 22].
Алгоритм анализа кислородного статуса в отделении реанимации и интенсивной терапии областной детской клинической больницы строится следующим образом: при поступлении ребенка в отделение берется проба капиллярной крови с включением в бланк исследования определение лактата. Выявление концентрации лактата в пробе капиллярной крови выше 3 ммоль/л является показанием для анализа глубокой картины кислородного статуса с забором пробы цельной артериальной крови у новорожденного ребенка.
Практическая значимость анализа кислородного статуса у новорожденных детей, находящихся в критическом состоянии демонстрируется фрагментом следующего клинического наблюдения.
Новорожденный мальчик П. Дата и время рождения: 28.10.2005 в 11:39. Мальчик родился от второй беременности, протекавшей на фоне анемии, рубца на матке, вегето-сосудистой дистонии по гипертоническому типу у матери. Роды вторые, путем кесарева сечения при сроке гестации 38 недель. Ребенок был извлечен на 5-й минуте за головку. Масса тела при рождении 3490 г., длина тела 52 см., окружность головы 35 см. Оценка по шкале Апгар — 6/8 баллов. С рождения отмечалась кислородная зависимость. Через 27 часов 30 минут от рождения стали нарастать явления дыхательной недостаточности (одышка 84 в минуту, цианоз, выраженное беспокойство). Через 28 часов от рождения была произведена эндотрахеальная интубация, осуществлен перевод на ИВЛ аппаратом «Babylog 2000». Потребовались следующие параметры ИВЛ для стабилизации состояния ребенка: PIP 45 см Н2О, PEEP до 5 см Н2О, Tin 0,45 c., f — 48 в мин. Через 30 часов после рождения отмечались артериальная гипотензия, сниженный темп диуреза (менее 0,5 мл/кг/час), нарастание отеков. В терапию были включены инотропные и вазопрессорные препараты, дозировки которых увеличивались неонатологами родильного дома Дозы дофамина и добутрекса составили 10 мкг/кг/мин. Вследствие тяжести состояния ребенка перевод в отделение реанимации и интенсивной терапии Областной детской клинической больницы г. Санкт-Петербурга (ОРИТ ОДКБ) был осуществлен только на 6е сутки жизни. В ОРИТ ОДКБ ребенок был доставлен выездной неонатальной реанимационной бригадой 02.11.2005 в 2050. Диагноз родильного дома при переводе: «Внутриутробная пневмония. Персистирующая легочная гипертензия. ДН III степени. НК III степени. Отечный синдром». Масса тела при поступлении в ОРИТ ЛОДКБ 4042 г. (+552 г. с рождения).
При поступлении: ИВЛ в режиме CMV с параметрами: FiO2 — 1,0; PIP — 45 см Н2О; PEEP — 4 см Н2О; ЧД — 60 в мин; Tin — 0,48 c; MAP 22 см Н2О. Данные графического респираторного мониторинга C (комплайнс) — 0,8 мл/см Н2О (при норме > 4 мл/см Н2О). Дозировки дофамина и добутрекса по 10мкг/кг/мин. Показатели гемодинамики: ЧСС — 118 в мин, АД — 70/31 мм. рт. ст., SpO2 — 94%. Анасарка, почасовой диурез 0,6 мл/кг/час. Данные клинического анализа крови: гемоглобин — 145 г/л; эритроциты — 4,5×1012/л; ЦП — 0,95; тромбоциты — 180×109/л; лейкоциты — 13,8×109/л. Данные биохимического анализа крови: общий белок — 39 г/л; натрий — 136 ммоль/л; калий — 3,4 ммоль/л; хлор — 89 ммоль/л; кальций — 2,1 ммоль/л.

Диагноз при поступлении «Внутриутробная инфекция. Внутриутробная пневмония неустановленной этиологии. ДН III степени. Отечный синдром. Церебральная ишемия II.».
При исследовании кислотно-основного состояния в пробе капиллярной крови (ABL800 FLEX, Radiometer) уровень лактата составил 7,9 ммоль/л. Поставлены показания для исследования глубокой картины кислородного статуса. Проба цельной артериальной крови получена путем пункции с предшествующей местной анестезией кремом EMLA 5% правой лучевой артерии специальной иглой с присоединенным шприцом PICO 70. Исследование пробы артериальной крови на анализаторе ABL800 FLEX через 2,5 минуты после забора крови.
Результаты исследования глубокой картины кислородного статуса при поступлении
Параметры с температурной поправкой
рН — 7,581
рCO2 — 59,2 мм. рт. ст.
рO2 — 42,5 мм. рт. ст.
Оксиметрия
ctHb — 145 г/л
Hct — 40%
FO2Hb — 92,7%
FCOHb — 1,9%
FHHb — 3,7%
FMetHb — 0,7%
Что такое FiO2?
У пациентов в критическом состоянии FiO2 используется для оценки способности легких к газообмену с применением соотношения PaO2/FiO2 (индекс оксигенации). При этом степень острого респираторного дистресс-синдрома классифицируется как легкая (PaO2/FiO2 от 201 до 300 мм рт. ст.), средняя (PaO2/FiO2 от 101 до 200 мм рт. ст.) и тяжелая (
FiO2 влияет на корреляцию между SpO2 и PaO2
Для понимания важности FiO2 следует рассмотреть зависимость SpO2 от PaO2.
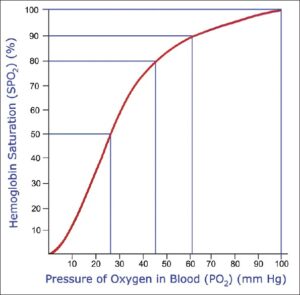
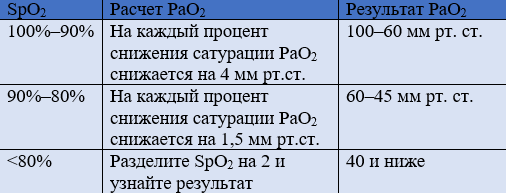
Данный расчет PaO2 может иметь подводные камни, например при определенных гемоглобинопатиях, а также при отравлении цианидом. Эта формула, которая не является математически точной, может быть очень полезной в работе реаниматолога. Например, если монитор показывает SpO2 70%, мы приблизительно можем рассчитать, что значение PaO2 составляет около 35 мм рт. ст., и принять соответствующие меры…
Скорость потока кислорода и FiO2
Существует приблизительная корреляция между скоростью потока кислорода и FiO2, в зависимости от способа подачи (назальная канюля, назофарингеальный катетер, лицевая маска или лицевая маска с резервуаром).
Индекс оксигенации
Индекс оксигенации (oxygenation index, OI; PF ratio – PF соотношение; респираторный индекс, PaO2 / FiO2 ) — это параметр, используемый в анестезиологии-реаниматологии и интенсивной терапии для оценки функции обмена кислорода в легких. Расчет индекса оксигенации производят по формуле, как соотношение PaO2 / FiO2 (отношение парциального напряжения кислорода в артериальной крови к фракции кислорода на вдохе). Данный критерий относится к международным шкалам, которые ежедневно используются в рутинной практике анестезиолога. Индекс оксигенации является одним из важных прогностических критериев при ИВЛ у больных новой коронавирусной инфекцией (COVID-19).
Рекомендуем: Интубация трахеи; Трудные дыхательные пути; Алгоритм VORTEX; Рекомендации ASA; Протокол DAS; Рекомендации SOBA; Шкала Маллампати; Шкала Кормака-Лехана, Шкала MACOCHA
FiO2 (fraction of inspired oxygen) — фракция кислорода во вдыхаемой газовой смеси. FiO2 влияет на корреляцию между SpO2 и PaO2, подробнее здесь
Калькулятор индекса оксигенации № 1
PaO2 – парциальное напряжение кислорода; FiO2 – концентрация кислорода на вдохе
Интерпретация индекса оксигенации в анестезиологии
Индекс оксигенации (респираторный индекс) является качественным признаком для определения степени острой дыхательной недостаточности. В норме индекс оксигенации равен примерно 500 ( PaO2 : FiO2 = 100 mmHg/0,21 = 476). Известно, что снижение индекса оксигенации (PaO2 / FiO2) считается одним из главных критериев острого респираторного дистресс-синдрома (ОРДС). При этом степень нарушения оксигенирующей функции легких является и дифференциально-диагностическим критерием для острого повреждения легких (ОПЛ) и его наиболее тяжелой стадии — ОРДС:
индекс оксигенации (РаО2 / FiО2)
Существует и другая формула индекса оксигенации, где для расчета используется не только соотношение PaO2/FiO2, но и среднее давление в дыхательных путях.
Калькулятор индекса оксигенации № 2
ФОРМУЛА
OI = (FiO2 x Pmean) / PaO2
OI – Oxygenation Index, индекс оксигенации
FiO2 – концентрация кислорода во вдыхаемой смеси
Pmean – среднее давление в дыхательных путях
PaO2 – парциальное давление кислорода в артериальной крови
Интерпретация результата
Источники
1. Marshall JC, Cook DJ, Christou NV, et. al. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome. Crit Care Med. 1995 Oct;23(10):1638-52. Review. PMID: 7587228 
2. Ortiz RM, Cilley RE, Bartlett RH. Extracorporeal membrane oxygenation in pediatric respiratory failure. Pediatr Clin North Am. 1987 Feb;34(1):39-46.
3. Власенко А.В., Мороз В.В., Яковлев В.Н., Алексеев В.Г. Информативность индекса оксигенации при диагностике острого респираторного дистресс-синдрома. Общая Реаниматология, 2009; 5 (5), 54–62.
4. Karbing DS, Kjaergaard S, Smith BW, Espersen K, Allerød C, Andreassen S, Rees SE. Variation in the PaO2/FiO2 ratio with FiO2: mathematical and experimental description, and clinical relevance. Crit Care. 2007;11(6):R118.
5. Whiteley JP, Gavaghan DJ, Hahn CE. Variation of venous admixture, SF6 shunt, PaO2, and the PaO2/FIO2 ratio with FIO2. Br J Anaesth. 2002 Jun;88(6):771-8. 
6. Bilan N., Dastranji A., Ghalehgolab Behbahani A. Comparison of the spo2/fio2 ratio and the pao2/fio2 ratio in patients with acute lung injury or acute respiratory distress syndrome. J Cardiovasc Thorac Res. 2015; 7(1):28-31. 
7. Hsu-Ching Kao, Ting-Yu Lai, Heui-Ling Hung. Sequential Oxygenation Index and Organ Dysfunction Assessment within the First 3 Days of Mechanical Ventilation Predict the Outcome of Adult Patients with Severe Acute Respiratory Failure. ScientificWorldJournal, 2013