Что такое ретикулярные клетки
РЕТИКУЛЯРНАЯ ТКАНЬ
Ретикулярная ткань (textus connectivus reticularis (LNH); лат. reticulum сетка; син. сетчатая ткань) — разновидность соединительной ткани, состоящей из ретикулярных клеток и ретикулярных волокон, заключенных в основное межклеточное вещество и образующих рыхлую трехмерную сеть, являющуюся основой кроветворных и лимфоидных органов.
Представления о Ретикулярной ткани формировались в течение многих десятилетий, но лишь в последние 10—15 лет, благодаря использованию достижений цитогенетики, радиобиологии, иммунологии, трансплантологии, были получены принципиально новые данные о ее дифференцировке, структуре и функции.
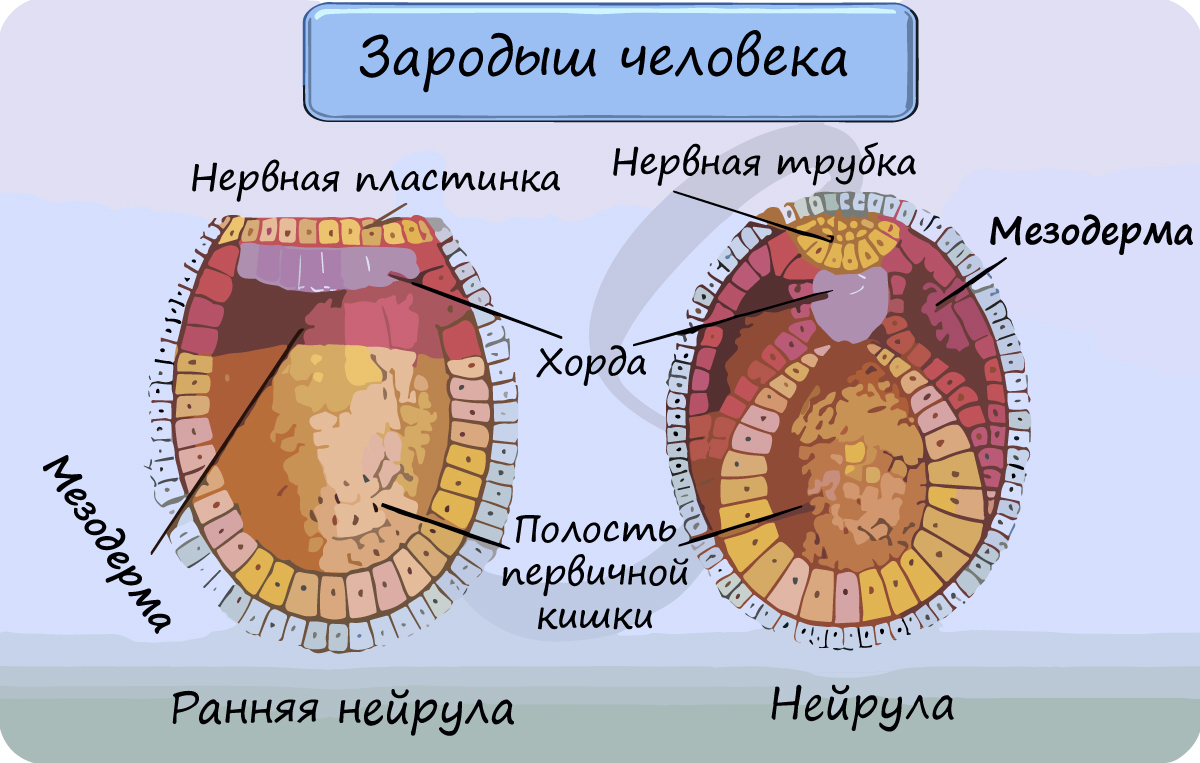
В эмбриогенезе Ретикулярной ткани дифференцируется из мезенхимы (см.) и в раннем постнатальном периоде постепенно приобретает строение зрелой ткани.
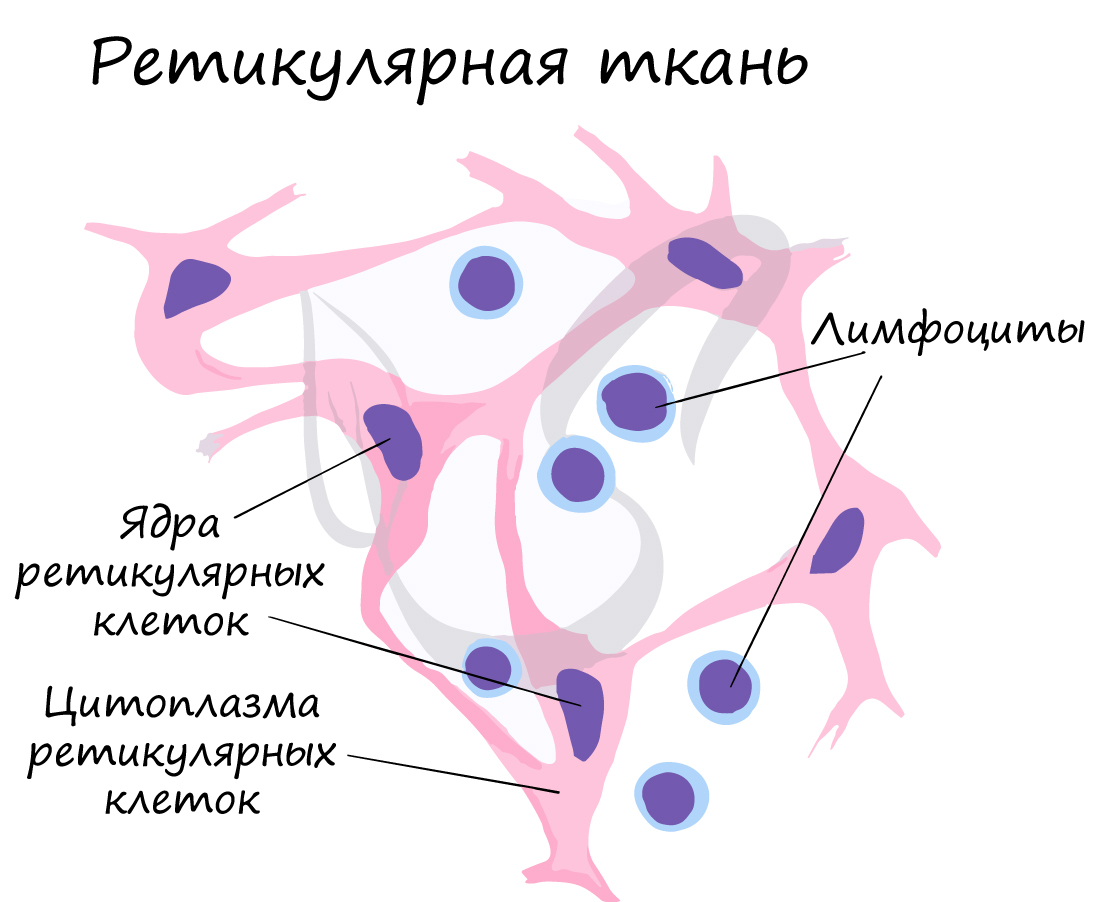
Ретикулярные клетки (cellulae reticulares) относят к клеткам фибробластического типа, наряду с фибробластами, хондробластами и остеобластами, объединяемыми под названием «механоциты». Ретикулярные клетки (рис. 1) имеют уплощенную, веретеновидную или звездчатую форму с гладкой поверхностью; ядро — угловатое или вытянутое. Степень развития органелл, в частности зернистой эндоплазматической сети и комплекса Гольджи (см. Гольджи комплекс), вариабельна и зависит от функционального состояния ретикулярной клетки. Соседние ретикулярные клетки или отростки одних и тех же клеток контактируют друг с другом посредством соединений типа промежуточных или десмосом (см.).
Ввиду того, что ретикулярные клетки часто трудно различить среди массы кроветворных клеток, их идентификация возможна только при использовании электронной микроскопии (см.), гистохимических методов исследования (см.) и методов иммуногистохимии (см. Иммуноморфология) или комбинации этих методов, позволяющих с высокой степенью достоверности выявлять ретикулярные клетки, а также идентифицировать их от внешне сходных с ними клеток системы мононуклеарных фагоцитов (см.).
Гистохимические свойства ретикулярных клеток определяются органными, а также видовыми особенностями. У человека ретикулярные клетки белой пульпы селезенки (см.) отличаются от макрофагов (см.) более низкой активностью эстеразы (см.) и кислой фосфатазы (см.), а от интердигитирующих клеток (разновидности мононуклеарных фагоцитов) — отсутствием активности АТФ-азы. В ретикулярных клетках лимфоцитарной короны лимф, фолликулов селезенки выявляется отчетливая активность 5′-нуклеотидазы (табл.).
Активность 5′-нуклеотидазы определяется также в ретикулярных клетках белой пульпы селезенки крыс и морских свинок, но отсутствует у кроликов. Ретикулярные клетки костного мозга мышей и крыс характеризуются активностью щелочной фосфатазы, локализующейся на их плазматической мембране. Этим признаком они отличаются от макрофагов, в к-рых выявляется активность кислой фосфатазы, локализующейся в лизосомах (см.). Такой морфол. тип ретикулярных клеток часто называют фибробластическим.
В светлых (герминативных) центрах лимфатических фолликулов селезенки и лимфатических узлов (см.) описан особый тип ретикулярных клеток — дендритные ретикулярные клетки. Их отличают крупные размеры, ядро неправильной формы с выраженным ядрышком, многочисленные гладкие пузырьки в цитоплазме. Характерным признаком дендритных ретикулярных клеток являются длинные ветвящиеся отростки с многочисленными складками, глубоко проникающие между окружающими лимфоидными клетками (рис. 2). Отростки дендритных ретикулярных клеток вместе с цитоплазматическими выпячиваниями иммунобластов (В-лимфоцитов) формируют сложную сеть в виде лабиринта. В межклеточном пространстве среди отростков локализуются микровезикулярные структуры и глобулярные плотные частицы диаметром 20—70 нм. В области контакта отростков дендритных ретикулярных клеток видны структуры типа десмосом (см.). В отличие от макрофагов с окрашивающимися включениями и других мононуклеарных фагоцитов дендритные ретикулярные клетки имеют более низкую активность эстеразы и кислой фосфатазы, но высокую активность 5′-нуклеотидазы. По ряду гистохимических признаков они могут быть сходны с мононуклеарными фагоцитами: макрофагами красной пульпы селезенки, металлофильными (аргирофильными) клетками краевой зоны лимф, фолликулов, макрофагами с окрашивающимися включениями. Решающим критерием для идентификации дендритных ретикулярных клеток является способность этих клеток связывать (но не фагоцитировать) иммунные комплексы на своей поверхности.
Ретикулярные волокна (fibrae reticulares), входящие в состав Р. т., состоят из фибрилл различного диаметра, заключенных в гомогенное, плотное основное межклеточное вещество. Фибриллы диаметром 20—50 нм имеют осевую исчерченность, характерную для зрелого коллагена. Тонкие фибриллы диаметром 10 нм локализуются по периферии ретикулярных волокон. Ретикулярные волокна всегда окутаны цитоплазмой ретикулярных клеток в виде чехла (инвагинированы в цитолемму), просвет к-рого всегда сообщается с межклеточным пространством. В лимфоидных органах сеть ретикулярных волокон развита сильнее, чем в костном мозге, причем в тимус-зависимых зонах лимфатических узлов она более рыхлая, чем в корковом и мозговом веществе.
По данным биохимического и иммунохимического анализов, ретикулярные волокна состоят из коллагена III типа (см. Коллаген) и неколлагенового компонента в виде аморфного межфибриллярного вещества с выраженными иммуногенными свойствами. В составе неколлагенового компонента идентифицированы белки (90%), углеводы (4%) и липиды (4%). Для выявления ретикулярных волокон широко используют различные варианты импрегнации серебром. В повседневную практику начинают входить иммуногистохимические и иммунофлюоресцентные методы выявления ретикулярных волокон (см. Иммуноморфология, Иммунофлюоресценция), в основе к-рых лежит использование специфических антисывороток к коллагенам разных типов.
Р. т. образует строму и является носителем специфических органных функций костного мозга и периферических лимфоидных органов (селезенки, лимф, узлов, солитарных и групповых лимф, фолликулов жел.-киш. тракта). После того как было экспериментально доказано, что ретикулярные клетки гистогенетически независимы от кроветворных, их стали относить к категории стромальных элементов, ответственных за создание специфического микроокружения, обеспечивающего миграцию, сортировку, репликацию и дифференцировку кроветворных и лимфоидных клеток. Ретикулярные клетки способны восстанавливать исходное микроокружение при повреждении органов, содержащих Р. т., или переносить его при эктопической трансплантации. Во всех случаях сначала восстанавливается ретикулярная строма, а затем она репопулируется (заселяется) кроветворными или лимфоидными клетками (см. Лимфоидная ткань). В костном мозге ретикулярные клетки формируют также адвентициальный слой синусоидных капилляров и в условиях нормального кроветворения покрывают до 60% их поверхности. Длинные ветвящиеся отростки ретикулярных клеток вступают в специфическое взаимодействие с кроветворными клетками гранулоцитарно-го ряда дифференцировки (см. Кроветворные органы). Концентрация ретикулярных клеток повышена вблизи эндоста.
Экспериментальные данные свидетельствуют о сохранении в пост-натальном онтогенезе гистогенети-ческой близости между разными типами механоцитов (фибробластами, хрящевыми, костными, ретикулярными клетками). Так, при культивировании костного мозга in vitro возникают колонии-клоны фибробластов; нек-рые из этих колоний при обратной трансплантации в организм формируют костномозговой орган (участок костной ткани, окружающей костный мозг), заселяемый кроветворными клетками. Эти данные показывают, что среди ретикулярных клеток костного мозга имеются элементы, способные трансформироваться в истинные фибробласты (судя по их способности синтезировать коллаген I и III типов), и в то же время, проявляющие остеогенные свойства. В другой экспериментальной модели костномозговой орган возникает в результате последовательных морфогенетических процессов под влиянием индуктора — деминерализованного костного матрикса, имплантированного в подкожную соединительную ткань. По мнению Редди, Гея, Гея, Миллера (А. N. Beddi, В. Gay, S. Gay. E. J. Miller, 1977), в этом случае под влиянием индуктора происходит последовательная трансформация фибробластов в хрящевые, костные, а затем ретикулярные (стромальные) клетки. По-видимому, ретикулярные клетки костного мозга способны также трансформироваться в жировые клетки, участвующие в создании кроветворного микроокружения (в красном костном мозге). В норме ретикулярные клетки отличает высокая радиорезистентность, и они практически не делятся.
Существует мнение, что на поверхности дендритных ретикулярных клеток имеются мембранные рецепторы для иммуноглобулинов (см.), с к-рыми связываются иммунные комплексы антигенов с антителами. Согласно другому мнению, антигены (см.) просто медленно фильтруются через лабиринт, создаваемый отростками дендритных ретикулярных клеток. Связывание антигена происходит быстрее у предварительно иммунизированных животных (через 0,5—2 часа), чем у неиммунизированных (через 4—24 часа). Параллельно изменяется и ультраструктура дендритных ретикулярных клеток. В опытах на кроликах показано, что в процессе формирования светлых центров дендритные ретикулярные клетки трансформируются из фибробластических ретикулярных клеток прилежащей лимфоцитарной короны. При этом ретикулярные клетки теряют активность щелочной фосфатазы (и, по-видимому, способность к волокнообразованию).
С возрастом в Ретикулярной ткани увеличивается количество волокнистых структур. Для костного мозга характерно необратимое замещение ретикулярной стромы жировой тканью и прекращение кроветворения. С возрастными и патологическими изменениями Р. т. тесно связано нарушение функции кроветворных и лимфоидных органов. При воздействии высоких доз ионизирующего излучения на организм Р. т. не регенерирует, а замещается фиброзной. Миелофиброз характеризуется интенсивной пролиферацией фиброгенных клеток и последующим массивным отложением коллагена I, III и IV типов. Показано участие ретикулярных клеток в синтезе фибриллярных белков амилоида (см. Амилоидоз). Поражение собственно ретикулярной стромы, сопровождающееся нарушением кроветворения, не всегда можно выявить морфологически. Поэтому важная роль отводится методам клонирования стромальных клеток in vitro, изучению их взаимодействия с кроветворными и лимфоидными клетками в жидкостных и агаровых культурах.
Таблица. Сравнительная характеристика активности ферментов в ретикулярных клетках и мононуклеарных фагоцитах (макрофагах) белой пульпы селезенки человека По данным Мюллер-Хермелинка (H. К. Muller-Hermelink) и др. (1974)
Активность ферментов в различных клетках лимфатического фолликула селезенки
Ретикулярные клетки лимфоцитарной короны
Дендритные ретикулярные клетки светлых центров
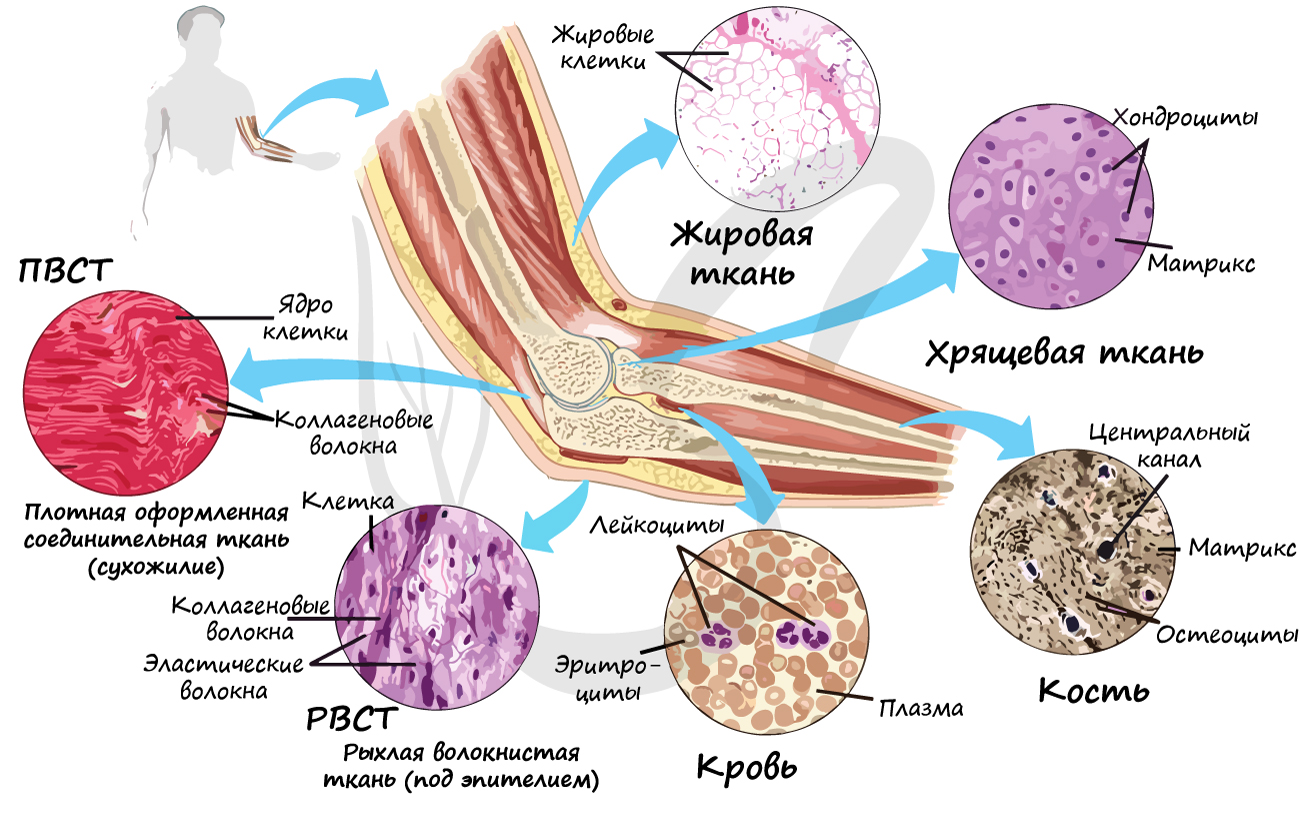
Соединительные ткани
Группа соединительных тканей объединяет собственно соединительные ткани (РВСТ и ПВСТ), соединительные ткани со специальными свойствами (ретикулярная, жировая, слизистая, пигментная), скелетные соединительные ткани (хрящевая и костная). В рамках школьного курса к соединительным тканям относят жидкую подвижную кровь, строение которой мы изучим в разделе «Кровеносная система».
Что же общего между жидкой подвижной кровью и плотной неподвижной костью? Общим оказываются три основополагающих признака соединительных тканей:
Межклеточное вещество соединительных тканей состоит из волокон и основного аморфного вещества (неволокнистый компонент). Волокна могут быть коллагеновыми, эластическими и ретикулярными.
Очевидно, что соединительная ткань образована тремя компонентами: клетки, волокна, основное аморфное вещество.
Собственно соединительные ткани
Собственно соединительные ткани объединяет то, что они содержат коллагеновые волокна (одни или вместе с эластическими), не отличаются высоким содержанием минеральных соединений.
Рыхлая волокнистая соединительная ткань (РВСТ) содержит клетки разной формы: фибробласты (юные), фиброциты (зрелые). РВСТ содержится во всех внутренних органах (образует строму большинства органов), она располагается по ходу прохождения кровеносных, лимфатических сосудов и нервов, образует соединительнотканные прослойки, сосочковый слой дермы.
Особенности рыхлой волокнистой соединительной ткани: преобладает основное аморфное вещество (отсюда «рыхлая», не плотная), коллагеновые и эластические волокна лежат произвольно, не ориентированы в одном направлении.
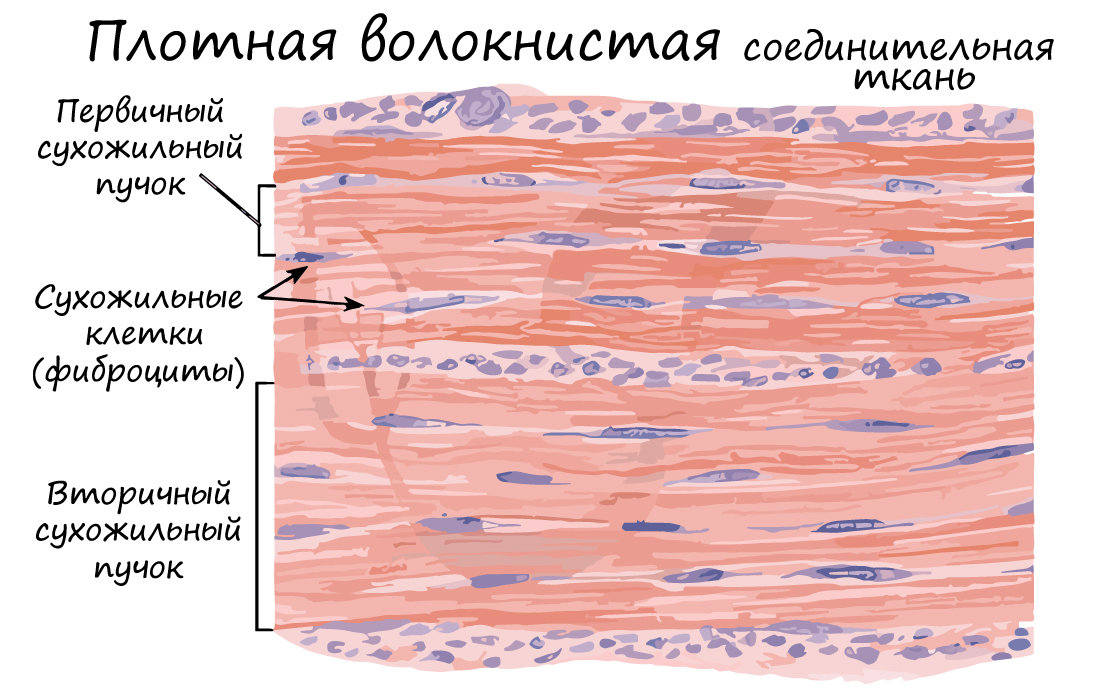
Волокна могут быть ориентированы в одном направлении (оформленная ПВСТ) или нет (неоформленная ПВСТ).
Неоформленной ПВСТ образован сетчатый (глубокий) слой дермы. Оформленной ПВСТ образованы связки, сухожилия, фасции мышц, капсулы внутренних органов.
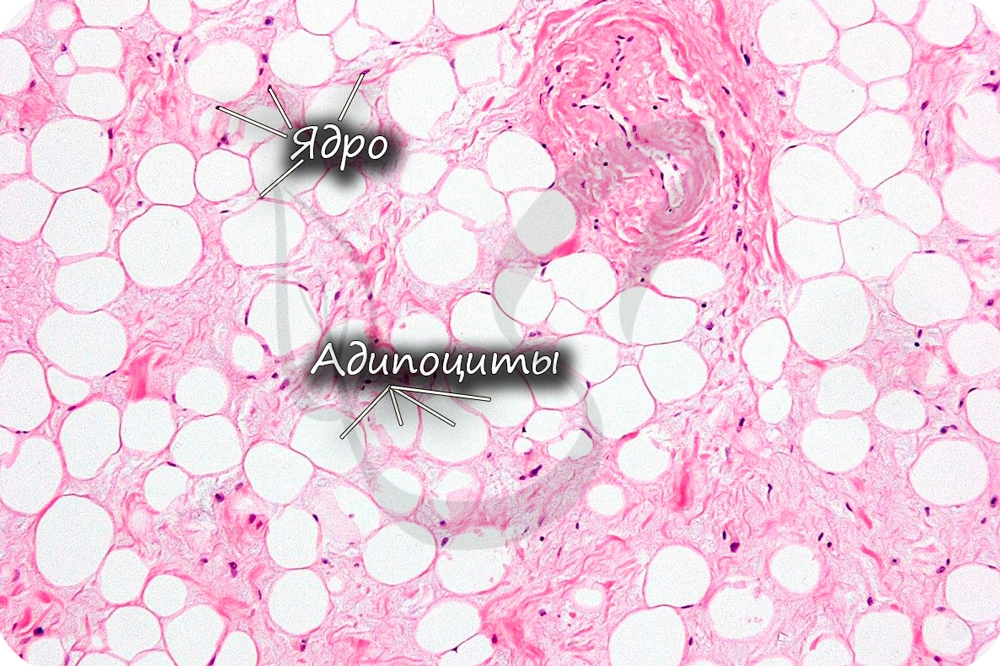
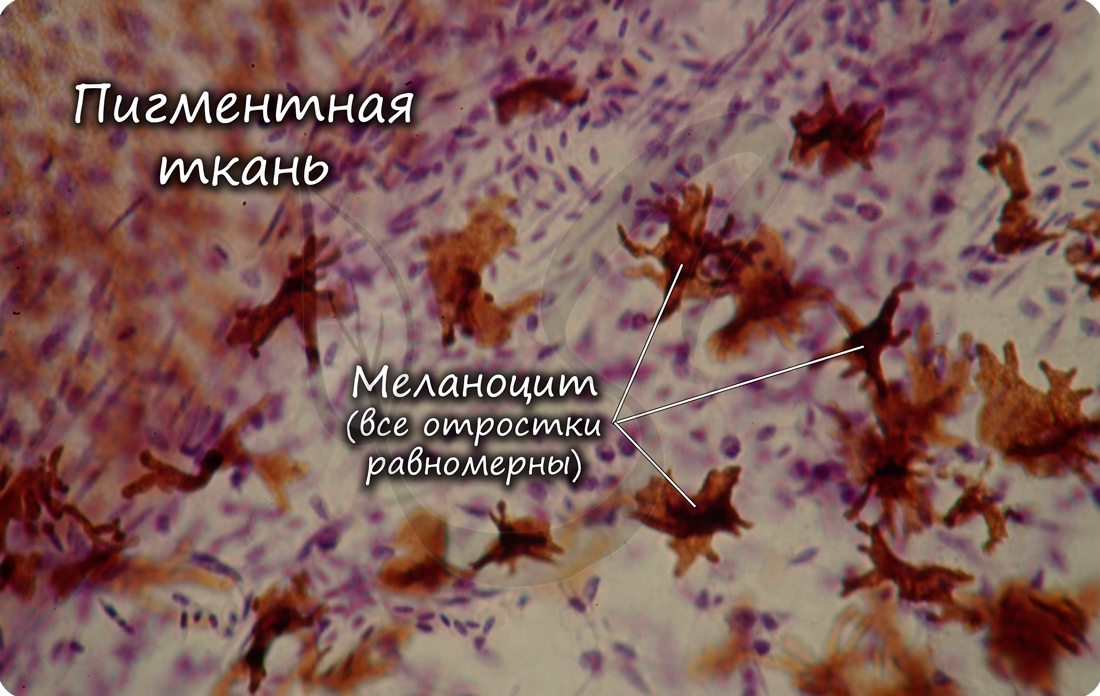
Соединительные ткани со специальными свойствами
Функции жировой ткани:
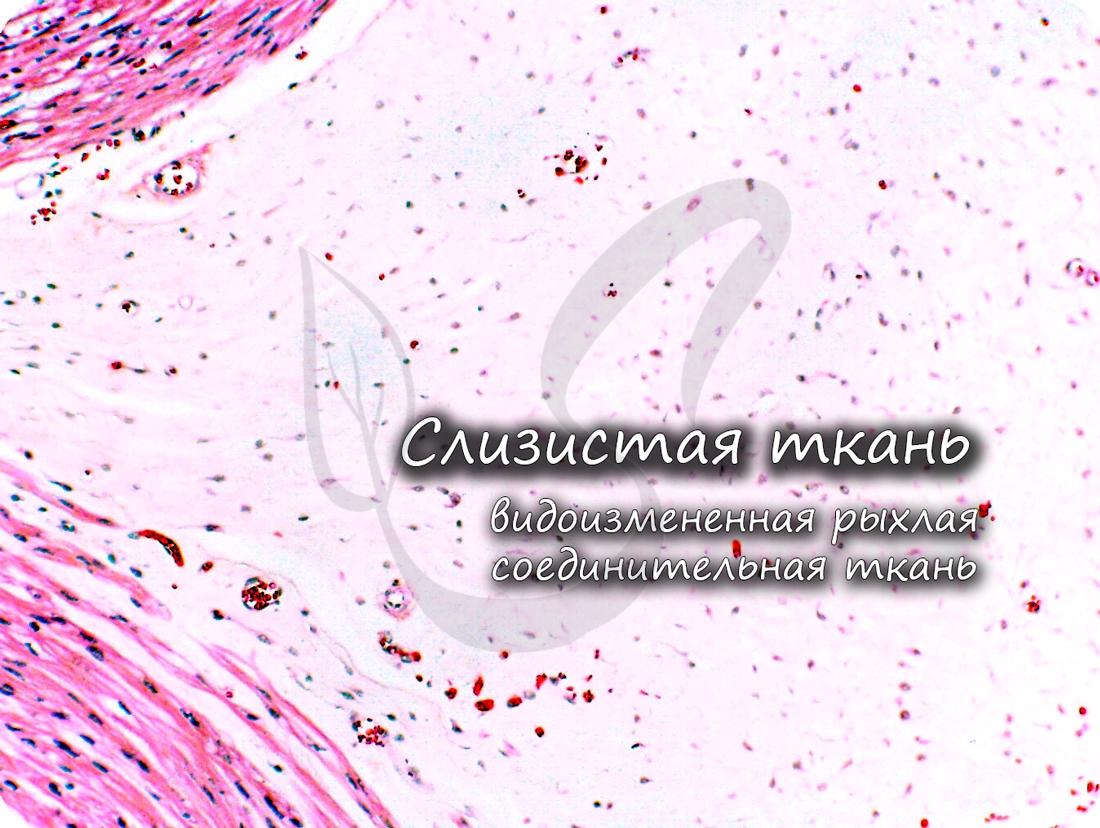
Слизистая (студенистая) ткань встречается в норме только между плодными оболочками и в составе пупочного канатика зародыша. Ее относят к эмбриональным тканям, на постэмбриональном этапе развития она отсутствует.
Скелетные соединительные ткани
К скелетным тканям относятся хрящевая и костная ткани, которые создают опорно-двигательный аппарат, выполняют защитную, механическую и опорную функции, принимают активное участие в минеральном обмене (обмен кальция, фосфора). Играют формообразующую роль в процессе эмбриогенеза и постэмбрионального развития (на месте многих будущих костей вначале образуется хрящ).
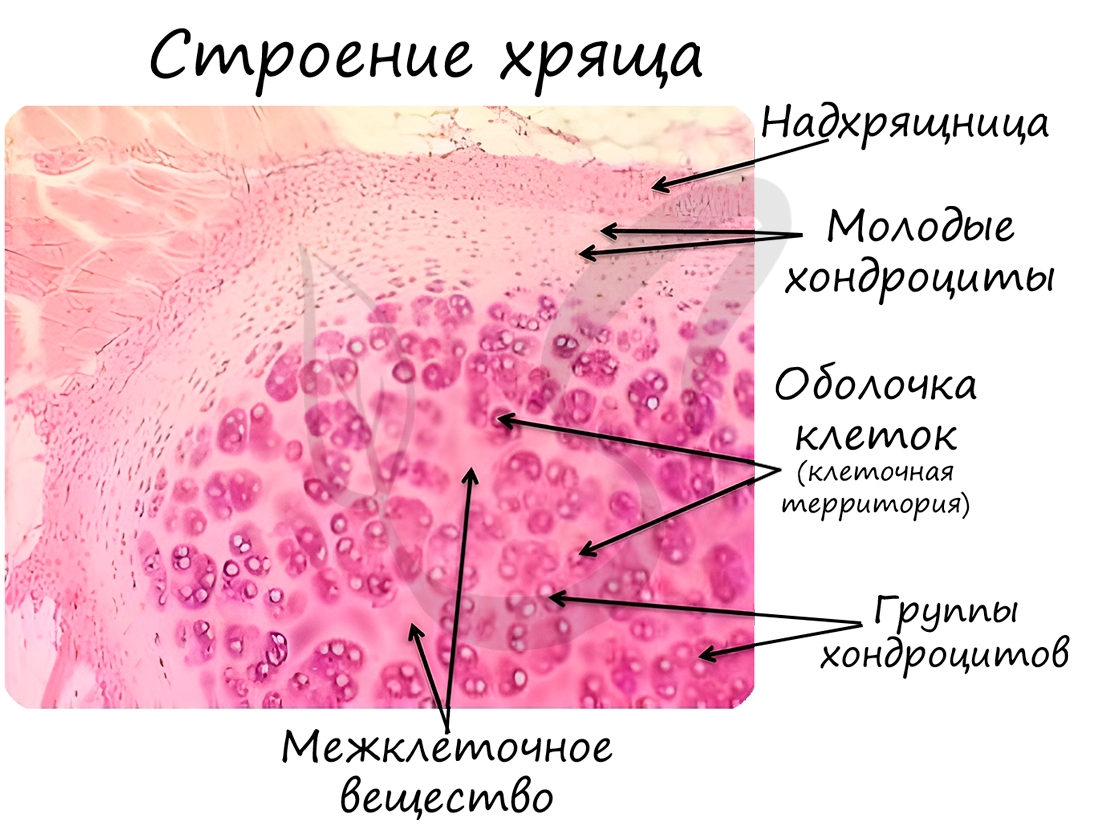
Хрящевая ткань может быть 3 видов: гиалиновая, эластическая и волокнистая.
Гиалиновая хрящевая ткань образует суставные поверхности костей, метафизы трубчатых костей в период их роста, хрящи воздухоносных путей (гортани, трахеи и крупных бронхов), передние отделы ребер. Эластическая хрящевая ткань образует ушные раковины, хрящи носа, средних бронхов, надгортанник. Волокнистая хрящевая ткань формирует межпозвоночные диски.
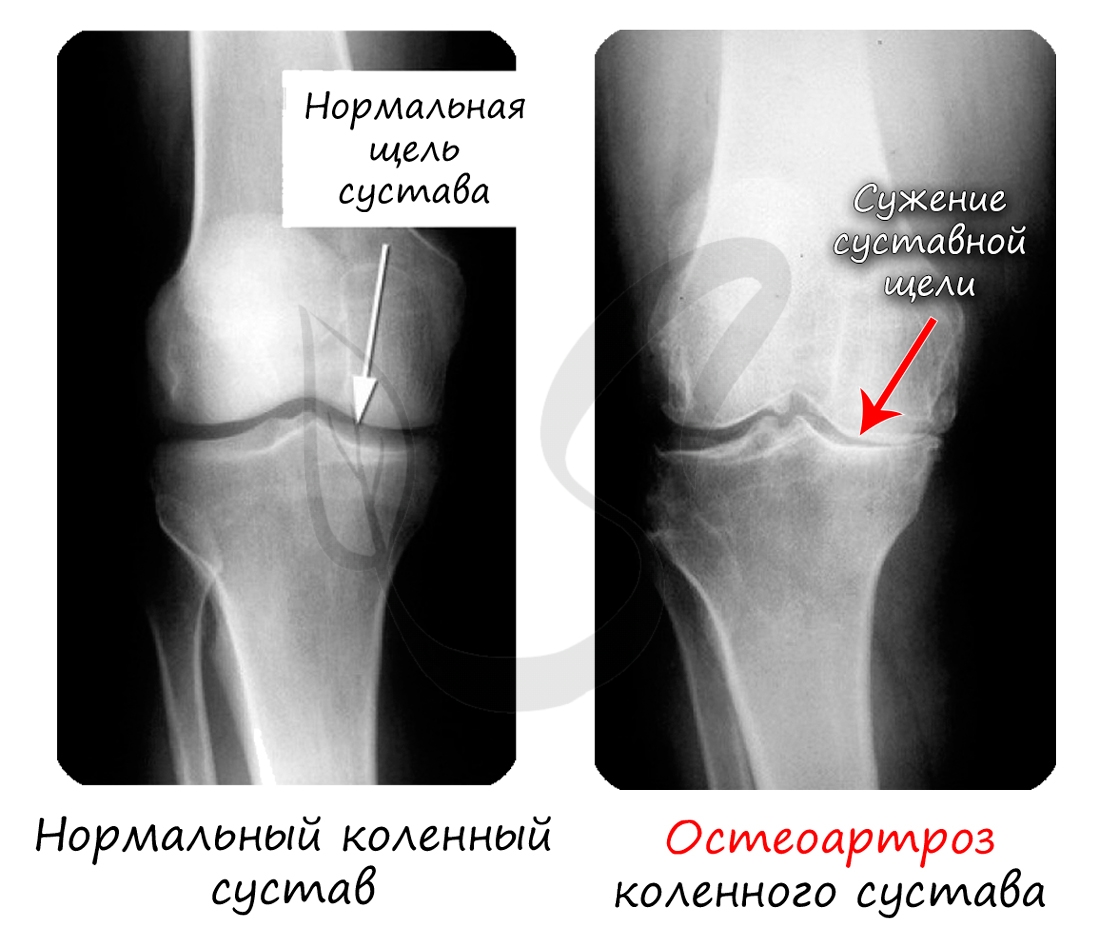
Хрящевая ткань выстилает поверхность костей в месте образования суставов. При нарушении в ней обменных процессов хрящевая ткань начинает заменяться костной, что сопровождается скованностью и болезненностью движений, возникает артроз.
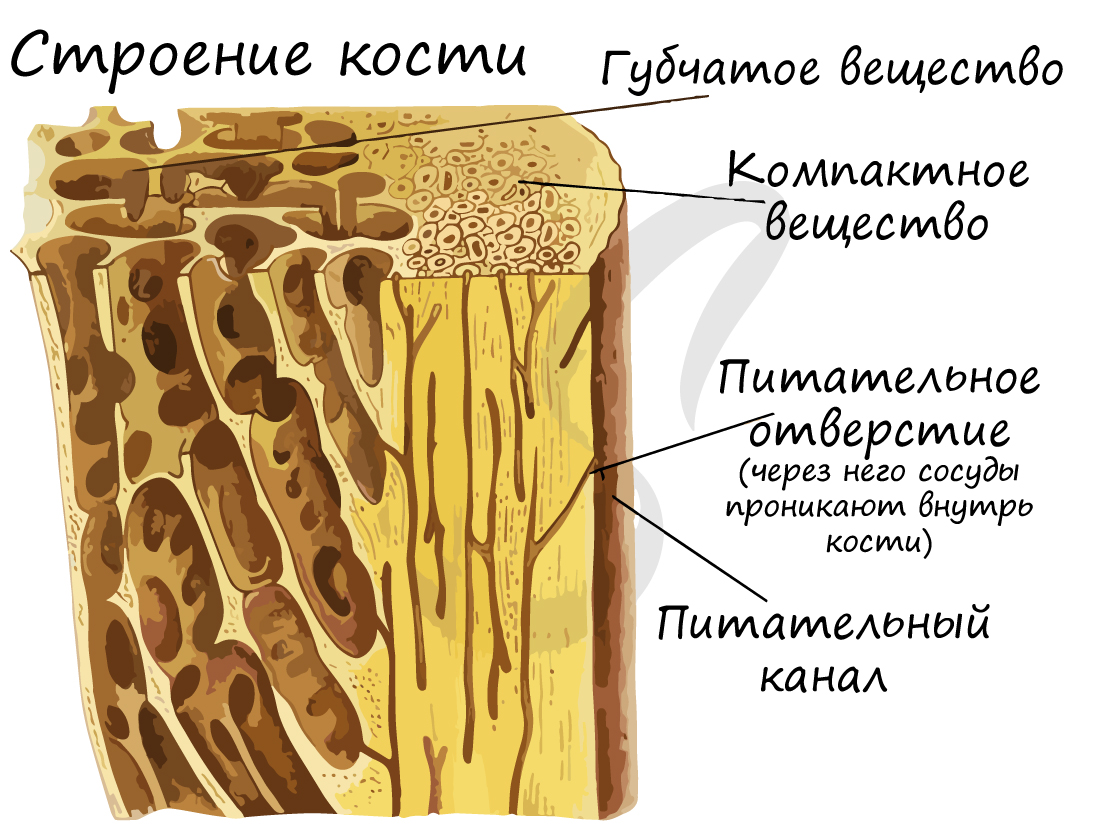
Костная ткань состоит из клеток и хорошо развитого межклеточного вещества, пропитанного минеральными солями (составляют около 60-70%), преобладающим из которых является фосфат кальция Ca3(PO4)2.
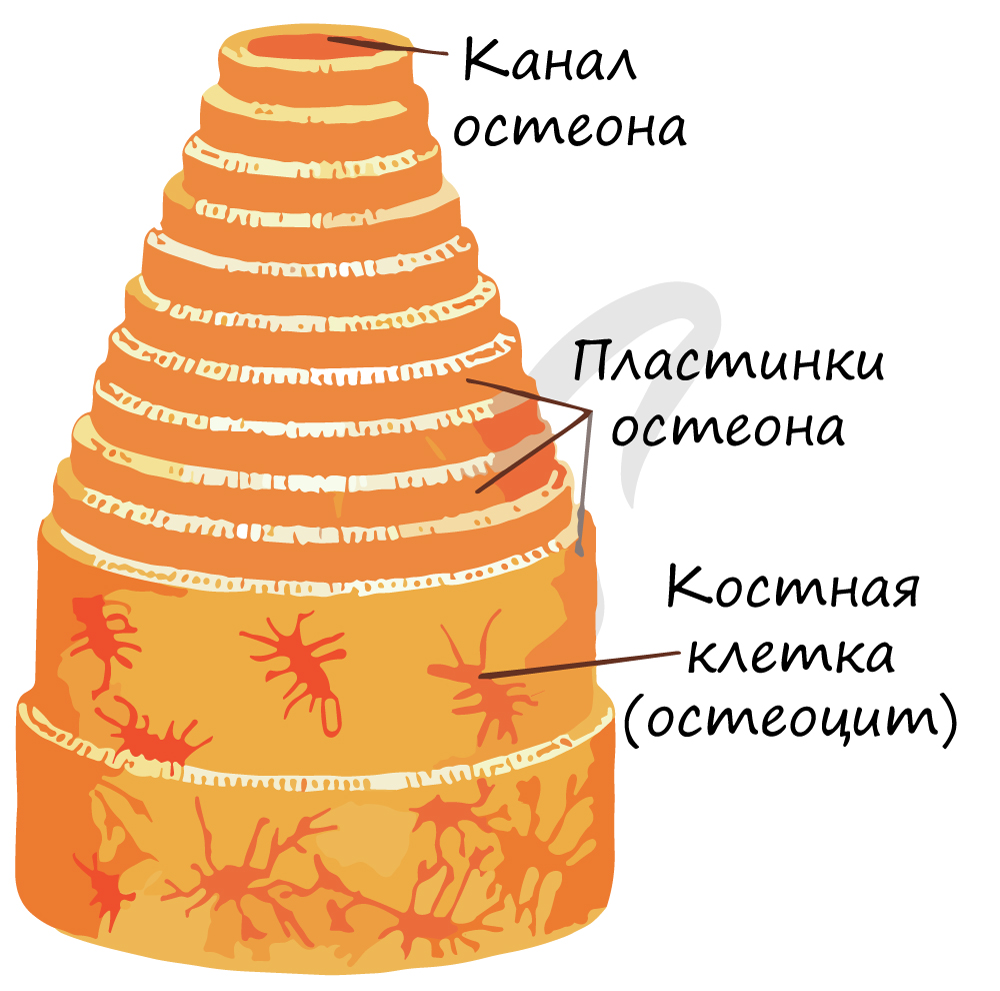
Компактное вещество почти не имеет промежутков, костные пластинки имеют концентрическую форму (полые цилиндры, вложенные друг в друга). Компактное вещество образует поверхности плоских и губчатых костей, поверхностный слой эпифиза и основную часть диафиза.
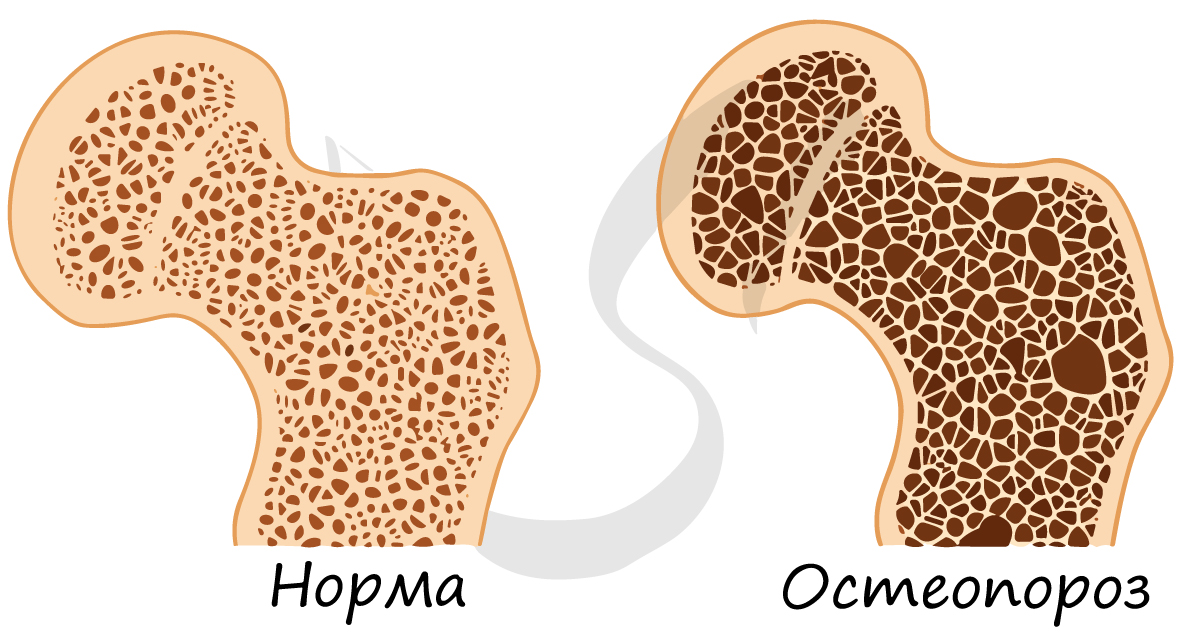
Минеральный компонент обеспечивает прочность кости. Благодаря нему костная ткань выполняет опорную функцию и способна выдерживать значительные нагрузки.
Органический компонент превалирует в костях новорожденных. Их кости очень эластичные. Постепенно минеральные соли накапливаются, и кости становятся твердыми, способными выдержать значительные физические нагрузки.
Происхождение
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое ретикулярные клетки
В функциональном отношении клетки лимфоидной системы могут быть разделены на три типа: стволовые кроветворные клетки, клетки-предшественники первичных лимфоидных органов, клетки вторичных лимфоидных органов. По темпу клеточного обновления лимфоидная ткань занимает одно из первых мест в организме. Развитие лимфоидных клеток не прекращается всю жизнь – это необходимо для “подстройки” иммунитета к постоянно изменяющейся иммунологической ситуации.
Особенность всей лимфоидной системы состоит в том, что в течение всей жизни ее органы объединяют интенсивные клеточные миграции, в ходе которых осуществляется пролиферация и дифференцировка иммунокомпетентных клеток. Эти процессы происходят при условии упорядоченной миграции клеток-предшественников из одних органов кроветворной системы в другие, включая костный мозг, тимус и периферические лимфоидные органы. Стоит отметить, что дифференцировка общих предшественников в разных направлениях (например, в Т- и В-клетки) требует различных несовпадающих местных условий.
Основная функция лимфоузлов состоит в обеспечении взаимодействия антигена, который поступает туда по афферентным лимфатическим сосудам, с иммунокомпетентными клетками. В ходе иммунного ответа в структуре лимфоузла происходит ряд изменений, благодаря которым обеспечивается возможность для наибольшего количества лимфоцитов проконтактировать с антигеном и между собой. Структуры лимфатического узла создают условия для направленного, а не случайного взаимодействия разных субпопуляций лимфоцитов и для развития стимулированных антигеном клонов иммунокомпетентных клеток.
Группой экспертов ВОЗ (Котье и соавт., 1973) предложено выделять в лимфоузле следующие функциональные зоны и структуры:
1. Кортикальный слой с залегающими в нем фолликулами.
2. Паракортикальную зону.
3. Мозговое вещество с мозговыми тяжами.
Фолликулы и мозговые тяжи являются тимуснезависимыми областями (В-зона), паракортикальная зона – тимусзависимой областью (Т-зона). В-зависимые зоны – это зоны лимфоидных фолликулов лимфоузлов, селезенки, аппендикса, миндалин, лимфоидных агрегатов кишечника. Т-зависимые зоны – это паракортикальная зона лимфоузлов, периартериальные зоны селезенки, интерфолликулярные зоны в аппендиксе, миндалинах, пейеровых бляшках.
Структура и клеточный состав лимфоузлов человека исследовались многими авторами. Непаренхиматозный компонент лимфатических узлов представлен стромальными образованиями, выполняющими, в основном, опорную и трофическую функцию – фибробласты, фиброциты, миоциты, эндотелиоциты сосудов, нейральные элементамы. Также непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток и экстрацеллюлярный матрикс, которые играют ключевую роль в формировании лимфоидного микроокружения, отвечающее за развитие лимфоидных клеток. Остальные элементы стромы играют вспомогательную роль.
Термин ретикулярные клетки носит собирательный характер и включает 4 основных морфофункциональных типа: гистиоцитарные, дендритные, интердигитирующие и фибробластические ретикулярные клетки. На светооптическом уровне с использованием рутинных окрасок дифференцировать указанные типы достаточно сложно. Определение принадлежности к определенному варианту требует гистохимических и иммуногистохимических методов анализа.
Гистиоцитарные ретикулярные клетки имеют вид фиксированных макрофагов, почти неотличимых от гистиоцитов и макрофагов костномозгового происхождения, особенно находящихся в лимфатических фолликулах.
Дендритные ретикулярные клетки преобладают в корковом веществе, главным образом в центрах первичных и вторичных лимфатических фолликулов, являясь антиген-представляющей субпопуляцией клеточных элементов лимфатического узла. Эти клетки способны длительное время удерживать антиген на своей поверхности, регулируя образование В-клеток памяти и предшественников антителоформирующих плазмоцитов. Кроме того, дендритные ретикулярные клетки образуют правильную сеть в первичных и вторичных лимфоидных фолликулах. Реализации этих функций способствуют длинные отростки цитоплазмы, которые соединены с такими же отростками соседних дендритных ретикулярных клеток. Они имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются на срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Их отростки также выявляются окрашиванием на CD21 и CD23. Дендритные клетки помимо длинных отростков, которыми они соединяются между собой, имеют отчетливо различимые замыкательные комплексы – десмосомы, отличающие эти клетки от интердигитирующих ретикулярных клеток.
Интердигитирующие ретикулярные клетки в наибольшем количестве присутствуют в паракортикальной зоне, определяя стимуляцию Т-клеточного ответа. Интердигитирующие ретикулярные клетки имеют бледно окрашивающиеся ядра овальной или удлиненной формы, иногда с инвагинациями довольно сложной конфигурации, и широкую цитоплазму. Эти клетки имеют большое сходство с клетками Лангерганса, но не содержат гранул Бирбека. При иммуноцитохимическом исследовании в них определяется белок S-100 и антиген HLA-DR. Интердигитирующие ретикулярные клетки, в отличие от дендритных, соединяются между собой и другими клеточными элементами при помощи пальцевидных отростков цитоплазмы, входящих между такими же структурами других клеток.
Фибробластические ретикулярные клетки характеризуются наличием в цитоплазме волокнистых структур, идущих на формирование ретикулиновых волокон.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса. Эмиграция лимфоцитов из лимфоузлов осуществляется через эфферентные лимфатические сосуды, по которым лимфоциты возвращаются в кровоток. В этих взаимодействиях участвуют селектины, CD44 и интегрины, экспрессированные на лимфоцитах.
Имеется небольшое количество работ по морфологии некоторых клеточных элементов лимфоидного микроокружения при лимфопролиферативных заболеваниях. Так, при исследовании морфологических особенностей дендритных ретикулярных клеток при неходжкинских лимфомах отмечено изменение ультраструктуры ретикулярных клеток. При этом, происходило уменьшение количества лимфоцитов, контактирующих с дендритными ретикулярными клетками, увеличение межклеточных расстояний, перестройки плазматических мембран, изменения ультрацитохимических свойств клеток, в частности, снижение или полное отсутствие реакции на кислую фосфатазу. Отмечено уменьшение количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях.
Известно, что строма реализует свое воздействие на гемопоэтические клетки, как путем непосредственных межклеточных контактов, так и опосредованно, с помощью гуморальных механизмов. При лимфоидных неоплазиях происходят значительные нарушения в системе межклеточных взаимодействий. Клетки микроокружения являются главным источником цитокинов – пептидов, обеспечивающих регуляцию пролиферации, дифференцировки и апоптоза гемопоэтических клеток. Отмечено, что роль цитокинов в патогенезе лимфопролиферативных заболеваний весьма значительна. К примеру, известно, что пролиферативная активность стромы лимфоузлов у больных неходжкинскими лимфомами не зависит от морфологического варианта заболевания, а связана с продукцией цитокинов, в частности ФНО-α стромальными элементами лимфатических узлов. У пациентов с хроничесским лимфолейкозом повышена секреция стромой лимфатических узлов ИЛ-6 и ИЛ-4 in vitro, что отражает участие данных веществ в патогенезе заболевания. Применение химиотерапии снижает продукцию ИЛ-4 in vivo, что может быть благоприятным фактором, учитывая особенность ИЛ-4 ингибировать апоптоз опухолевых клеток. Также были показаны различия в экспрессии внутриклеточного ИЛ-8 клетками опухолевого клона и нормальными В-лимфоцитами, что имеет клиническое значение.
Стромообразование в опухоли является результатом взаимодействия между опухолевыми клетками и клетками соединительной ткани гистиогенного и гематогенного происхождения. Существует множество установленных и предполагаемых взаимодействий между клетками стромы и паренхимы гемопоэтической и лимфатической систем. Хорошо известно, что клетки стромы костного мозга играют ключевую роль в хоуминге, пролиферации и дифференцировке клеток-предшественниц гемолимфопоэза. Таким же образом, эпителиальные клетки тимуса модулируют пролиферацию и дифференцировку Т-лимфоцитов. Что касается лимфатических узлов, значительные исследования были посвящены дендритным клеткам, которые презентируют антиген и участвуют в инициации Т- зависимых клеточных ответов.
Работы, посвященные изучению дендритных клеток (ДК) при некоторых формах опухолей, показали, что количество и иммунофенотип ДК, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований. ДК считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы.
Согласно данным Цыплакова Д.Э. и соавт. (1995), исследовавших влияние кровеносного микроциркуляторного русла на клеточный иммунный ответ в лимфатических узлах, регионарных к злокачественным опухолям, сосудистое русло лимфатических узлов играет двоякую роль. С одной стороны, на ранних этапах развития опухоли происходит активация Т-клеточных иммунных реакций с усилением рециркуляции лимфоцитов через посткапиллярные венулы и превращением их путем бласттрансформации в цитотоксические Т-киллеры, что, вероятно, сдерживает процесс метастазирования. С другой стороны, на более поздних стадиях опухолевого роста изменения сосудистой стенки и циркуляторные расстройства сопровождаются отложением внутри- и внесосудистого фибрина, затрудняя тем самым рециркуляцию лимфоцитов и, следовательно, приводят к уменьшению числа трансформированных Т-киллеров, способных уничтожать попадающие в лимфатический узел опухолевые клетки, что, по мнению авторов, предопределяет процесс метастазирования. При появлении в лимфатических узлах метастазов фибрин уже способствует их закреплению в лимфоидной ткани, а также изолирует от цитотоксического действия оставшихся в небольшом количестве Т-эффекторов.
На сегодняшний день накопилось достаточное количество данных, свидетельствующих о роли стромального микроокружения в становлении лимфопролиферативных заболеваний. При этом отсутствует целостное представление о структурных особенностях лимфоидной стромы при нарушениях пролиферации и дифференцировки В-лимфоцитов. Дальнейшее изучение лимфоидного микроокружения, его морфофункциональных особенностей, адгезивных взаимодействий с использованием современных методов структурного анализа может способствовать поискам новых методов лечения гемобластозов и лимфопролиферативных заболеваний.