Что такое рнк интерференция
РНК-интерференция. Клин клином.
«Много» – это не всегда «хорошо». Например, когда речь идет о вирусных белках. В этом случае остановить процесс белкового синтеза – жизненная необходимость для зараженной клетки. И она как опытный гомеопат начинает излечивать «подобное подобным».
В 2006 г. Нобелевской премии по физиологии и медицине были удостоены американские исследователи Эндрю Файр и Крэйг Мэллоу за открытие явления РНК-интерференции. Признание пришло к ним необычайно быстро – всего через восемь лет после опубликования в журнале Nature результатов их исследований, показывающих, что матричную РНК можно разрушить с помощью другой молекулы РНК, двуцепочечной. Инъекция такой дцРНК, комплементарной мРНК мышечного белка unc-22, блокировала синтез этого белка посредством разрушения самой матричной РНК.
С явлением интерференции (от лат. inter – между и ferens (ferentis) – несущий) большинство из нас знакомо из курса физики: вспомним яркие пятна нефтяных разводов, причудливо расходящиеся по воде круги от брошенного камня. Однако этот термин, обозначающий взаимодействие, «наложение» по определенным законам одинаковых по своей природе объектов, встречается и в психологии, и в фонетике, и в биологии
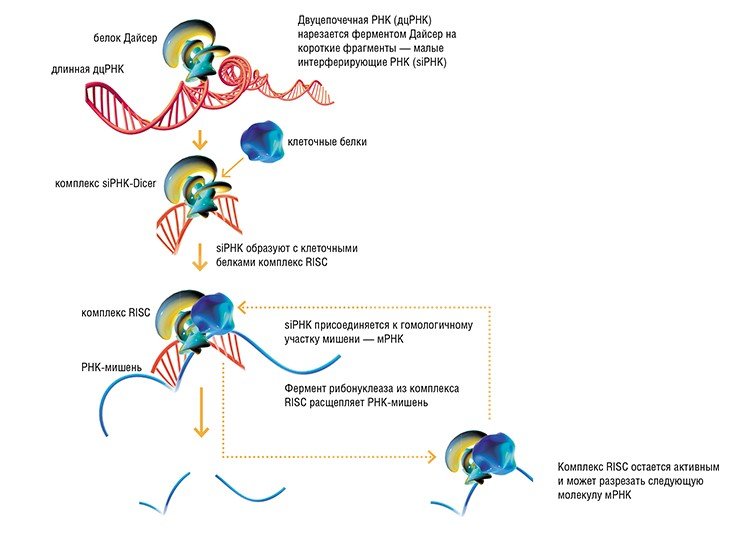
Механизм разрушения мРНК при помощи дцРНК строго избирателен. Попадая в клетку, длинные дцРНК связываются с клеточным ферментом Дайсер (Dicer – от англий-ского dice – нарезать) – ключевым белком в механизме РНК-интерференции – и разрезаются на короткие фрагменты, так называемые короткие интерферирующие РНК (siRNAs). Последние связываются с клеточным комплексом RISC, способным разрушать молекулы РНК, и направляют его только к тем мРНК, которые «узнают» по принципу гомологии нуклеотидных последовательностей. Таким образом обеспечивается специфичность РНК-интерференции.
Возникает вопрос, откуда же берутся длинные двуцепочечные РНК, запускающие механизм РНК-интерференции – ведь в норме в клетках млекопитающих они не синтезируются. Одним из путей попадания таких РНК в клетку может быть вирусная инфекция. Геном многих известных вирусов состоит именно из такой двуцепочечной РНК (а не ДНК, как у большинства живых организмов). Кроме того, подобные молекулы могут синтезироваться в клетке в качестве промежуточного продукта в процессе размножения некоторых вирусов. Поэтому появление двуцепочечной РНК является для клетки сигналом: «Опасность!» В ответ на него защитные системы клетки включают механизм уничтожения чужеродной генетической информации. Вирусная РНК разрушается, и процесс синтеза вирусных белков в клетке блокируется.
Двуцепочечные РНК участвуют в функционировании двух важнейших клеточных систем – противовирусной защиты и регуляции экспрессии генов
Следует отметить, что разрушением вирусной РНК защитные действия клетки не ограничиваются. Двуцепочечные РНК способны также стимулировать синтез интерферонов и цитокинов, оказывающих противовирусный эффект как на инфицированную, так и на соседние с ней клетки, подготавливая их к встрече с вирусом и активируя механизмы их клеточного иммунитета.
В последние годы было показано, что в клетке могут синтезироваться и свои собственные дцРНК, отличные по структуре от вирусных. Действуя по механизму РНК-интерференции, эти так называемые микроРНК могут вызывать остановку трансляции клеточных мРНК, блокируя синтез кодируемых ими белков. Таким образом, клетка может «выключать» гены, работа которых не нужна в данный момент. Следовательно, клетка, используя микроРНК, закодированные в ее собственном геноме, может регулировать экспрессию генов, реализуя свою генетическую программу развития.
Осознав, что с помощью малых интерферирующих РНК клетка справляется с целым рядом встающих перед ней проблем – от защиты от чужеродной генетической информации до регулировки программы развития клетки – исследователи поставили перед собой вопрос: нельзя ли использовать короткие синтетические молекулы РНК, гомологичные матричным РНК клетки, для разрушения последних. Такая возможность давала бы в руки ученым бесценный инструмент, способный регулировать экспрессию любого интересующего их гена. Кроме того, эти короткие олигорибонуклеотиды уже не распознаются клеткой как инфекционно опасные компоненты вирусного генома. Они не активируют клеточные механизмы противовирусной защиты и направлены исключительно на разрушение мРНК, гомологичной последовательности интерферирующей РНК.
Эксперименты показали, что это возможно, и сегодня такие синтетические молекулы, действующие по принципу РНК-интерференции, уже используются для регуляции экспрессии многих генов. Они действуют очень избирательно, разрушая только «нужные» молекулы мРНК, и проявляют активность в чрезвычайно низких концентрациях. Появление такого мощнейшего инструмента открыло для исследователей новые горизонты в области разработки целого спектра препаратов, подавляющих активность практически любых генов, в том числе вирусных и «опухолевых».
В одной лишь онкологии потенциальными мишенями для интерферирующих РНК могут являться мРНК, кодирующие различные классы белковых молекул, участвующих в процессе злокачественной трансформации. Вот только перечень классов подобных мишеней для терапевтического применения микроРНК: регуляторы клеточного цикла, ангиогенеза (роста сосудов, необходимых для питания опухоли), метастазирования и старения, белки, участвующие в блокировании апоптоза (программируемой гибели клеток), белки-иммуносупрессоры, мешающие организму самому бороться с раковыми клетками, а также белки, ответственные за устойчивость раковых клеток к химио- и радиотерапии.
Универсальная технология
При лечении ряда раковых заболеваний серьезной проблемой является устойчивость клеток опухоли к лекарственным препаратам. Такие раковые клетки способны выживать и размножаться в присутствии высоких концентраций цитостатических препаратов, когда обыкновенные, чувствительные к лекарствам опухолевые клетки неизбежно погибают.
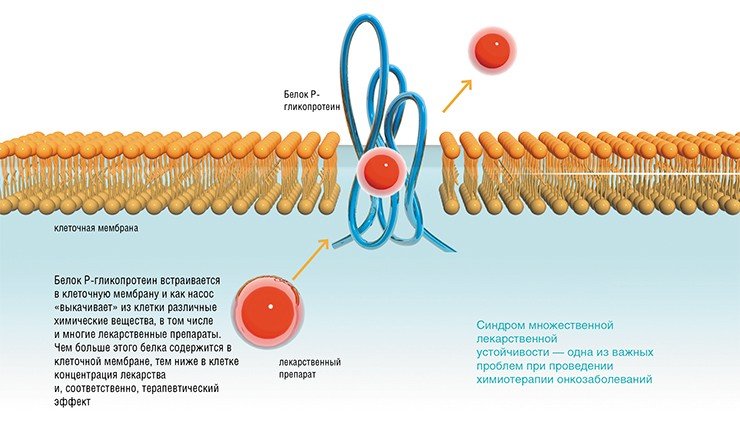
Такой синдром множественной лекарственной устойчивости связан с гиперэкспрессией клеточного гена MDR1, кодирующего P-гликопротеин. Этот транспортный белок работает как мембранный насос, «откачивающий» лекарственные препараты из цитоплазмы и таким образом снижающий их концентрацию в клетке.
Действие этого молекулярного насоса можно блокировать с помощью специальных химических веществ-ингибиторов. Но вряд ли это можно считать оптимальным решением проблемы: такие вещества сами по себе довольно токсичны и усугубляют тяжесть побочных эффектов химиотерапии. Выход из ситуации — создание таких лекарственных средств, которые устраняли бы первопричину синдрома устойчивости, то есть подавляли бы экспрессию гена MDR1.
Такие препараты на основе малых интерферирующих РНК были разработаны в новосибирском Институте химической биологии и фундаментальной медицины СО РАН. Они представляют собой комплексы синтетических олигорибонуклеотидов, гомологичных различным участкам матричной РНК гена MDR1.
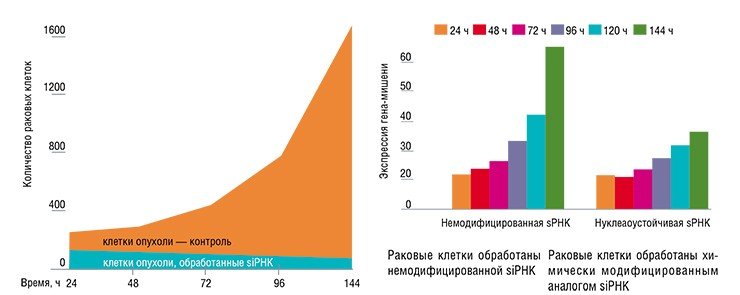
Для получения наиболее действенных малых интерферирующих РНК ими обрабатывали раковые клетки, обладающие устойчивостью к цитостатику винбластину, и отбирали те молекулы, низкие концентрации которых восстанавливали чувствительность опухолевых клеток к препарату, что приводило к гибели последних. Обработка самой эффективной из полученных siРНК снижала количество P-гликопротеина в раковых клетках в 20 раз уже через трое суток!
С использованием этого же подхода в ИХБФМ были получены ингибиторы и других «опухолевых» генов – протоонкогенов семейства MYC, играющих важную роль в регуляции клеточного цикла. Известно, что гиперэкспрессия генов c- и N-myc является одной из причин возникновения таких злокачественных опухолей, как нейробластомы. Клетки последних представляют собой не полностью дифференцированные нейральные клетки, продолжающие неконтролируемо делиться из-за нарушения генной экспрессии. Эти опухоли, нередко обнаруживающиеся у детей, далеко не всегда поддаются лечению.
Более того, в институте была получена siРНК, способная подавлять экспрессию сразу двух онкогенов, c-myc и N-myc. Этот препарат оказался эффективен против разных типов нейробластом, в том числе и устойчивых к лечению обычными противоопухолевыми средствами.
Полученные интерферирующие РНК могут рассматриваться как прототипы лекарственных препаратов, способных многократно повышать эффективность химиотерапии раковых заболеваний. Впрочем, до использования в медицинской практике этим препаратам еще предстоят долгий путь испытаний на лабораторных животных, а затем доклиническая и клиническая апробация.
«Химия» во благо
Для того чтобы интерферирующие РНК стали настоящими лекарствами, необходимо решить две проблемы: «защиты» и доставки РНК.
Первая связана с нестабильностью молекул РНК в крови и других биологических жидкостях. Это свойство обусловлено самой ролью РНК как переносчика генетической информации, количество которого должно подлежать быстрой регуляции. Ферменты РНКазы, содержащиеся как внутри клеток, так и во внеклеточной среде, эффективно расщепляют молекулы РНК, выполняя роль такого регулятора. Для защиты РНК от их действия природные нуклеотиды в ее составе заменяют на их химически модифицированные аналоги, придающие РНК устойчивость к действию ферментов. Однако такая замена может стать палкой о двух концах: сама биологическая активность интерферирующей РНК может снизиться либо быть полностью потеряна.
Поиски новых аналогов нуклеотидов, лишенных этих недостатков, ведутся во всем мире. Алгоритм получения нуклеазоустойчивых интерферирующих РНК, разработанный в ИХБФМ, основан на картировании чувствительных к рибонуклеазам участков молекулы siРНК и их направленной защите с помощью химически модифицированных аналогов нуклеотидов. В результате «адресно-защищенная» РНК сохраняет свою активность в присутствии 5 % сыворотки в течение восьми часов, в то время как немодифицированная siРНК полностью деградирует менее, чем за 5 минут. Благодаря приобретенной устойчивости значительно сокращается кратность введения новой дозы, необходимой для поддержания биологического эффекта.
Поиск новых «молекул-транспортеров» и «молекул-упаковщиков» для доставки интерферирующих РНК сейчас активно ведется в лабораториях всего мира, включая Россию. Уже в ближайшее время можно ожидать результатов, ознаменующих «прорыв» в эру новых технологий создания лекарств
Вторая проблема – создание средств доставки препарата в клетки и ткани. Для того чтобы комплексы, содержащие siРНК, попадали точно «по адресу», в их состав вводят специальные молекулы, которые и «узнают» клетки определенного типа. В качестве таких молекул могут выступать антитела, специфичность связывания которых чрезвычайно высока.
Преодоление клеточной мембраны также представляет проблему для любых заряженных молекул, в том числе и олигорибонуклеотидов. Здесь на помощь может прийти использование в качестве средств доставки препаратов катионных липидов и полимеров, которые образуют с интерферирующими РНК комплексы определенного размера. Такие комплексы способны проникать в клетки благодаря природным механизмам транспорта веществ. Другим перспективным подходом является присоединение к siРНК молекул, заведомо обладающих способностью проникать в клетки, таких как холестерин, фолат и других природных молекул, необходимых для функционирования клетки.
Проблема доставки интерферирующих РНК в некоторые типы клеток и тканей уже успешно решена, и эффективность подавления экспрессии генов-мишеней подтверждена на экспериментальных животных. Однако, как отмечают специалисты, текущее состояние дел в этой области следует считать обнадеживающим, но скромным результатом. Именно от разработки адекватных средств и схем доставки лекарственных молекул РНК в самые разные типы клеток при различных заболеваниях зависит то, как скоро всю мощь этого нового подхода в лечении удастся почувствовать на практике.
Логашенко Е. Б., Владимирова А. В., Зенков А. Н., Репкова М. Н., Веньяминова А. Г., Черноловская Е. Л., Власов В. В. (2005) Обращение фенотипа множественной лекарственной устойчивости с помощью малых интерферирующих РНК. // Известия АН, серия химическая, 2, 41—44.
Aronin N. (2006) Target selectivity in mRNA silencing. Gene Therapy, 13, 509—516.
Corey D. (2007) Chemical modification: the key to clinical application of RNA interference? // The Journal of Clinical Investigation, 117, 3615—3622.
Grimm D. and Kay M. (2007) Therapeutic application of RNAi: is mRNA targeting finally ready for prime time? The Journal of Clinical Investigation, 117, 3633—3641.
Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S. E., and Mello C.C. (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans // Nature, 391, 806—811.
Kabilova T. O., Chernolovskaya E. L., Vladimirova A. V., Vlassov V. V. (2006) Inhibition of Human Carcinoma and Neuroblastoma Cell Proliferation by anti c-Myc siRNA // Oligonucleotides, 16, 15—25.
Что такое РНК-интерференция и как инвестировать в супертехнологию
РНК-интерференция (RNAi) — одно из самых выдающихся открытий в науке, сделанное в 1998 г. двумя учеными — Эндрю Файром и Крейгом Мелло. В 2006 г. оба ученых были удостоены Нобелевской премии по физиологии и медицине.
Разберемся подробнее в том, что такое RNAi и рассмотрим компанию, которая является одним из лидеров направления.
РНК-интерференция
Если упрощенно описывать процесс, то РНК-интерференция (RNAi) позволяет отключить участок генома, не редактируя его. Благодаря открытию, сделанному Эндрю Файром и Крейгом Мелло, появилась возможность лечить болезни при помощи микроРНК (siRNA), вводя их в клетки и подавляя экспрессию (условно говоря, работу) генов, вызывающих болезнь, а также блокировать части генов вирусов, опасных для жизни человека. Организмы, полученные таким способом, не считаются генно-модифицированными.
Если у человека есть дефективные mRNA, то результатом могут быть опасные последствия, начиная от психических заболеваний до различных форм аномального развития. В частности, потеря активности mRNA — одна из основных причин образования опухолей.
По мнению специалистов, РНК-интерференция может быть применена для лечения вируса простого герпеса типа 2, нокдауна рецепторов хозяина к ВИЧ, сайленсинг (подавление) генов гепатита A и гепатита B, сайленсинг генов вируса гриппа, подавление репликации вируса кори. Также возможно лечение нейродегенеративных заболеваний, например болезни Хантингтона.
На основе RNAi могут быть разработаны препараты для профилактики и терапии коронавирусной инфекции. Компания, которую мы рассмотрим, уже приступила к стадии доклинической разработки такого препарата.
РНК-интерференцию также часто считают многообещающим способом лечения опухолей путем выключения генов, повышенно экспрессирующихся (процесс, в ходе которого наследственная информация от гена преобразуется в функциональный продукт — РНК или белок) в клетках опухолей, либо генов, принимающих участие в делении клеток. Важной областью исследований в области РНК-интерференции для клинического применения является разработка методов безопасной доставки mRNA, например, подбор векторных систем, для терапии генами.
Arrowhead Pharmaceuticals
Arrowhead не является пионером в области применения РНК-интерференции. Первые биотех-стартапы, планировавшие создавать лекарства на базе данной технологии, начали массово возникать еще в 2001 г. Пузырь инвестиций в области рос, а после лопнул, поскольку никто так и не научился доставлять микроРНК (siRNA) до нужных клеток. Первое лекарство, созданное другой компанией, вышло на рынок только в 2018 г.
На сегодняшний день Arrowhead Pharmaceuticals смогла создать надежную и универсальную платформу Targeted RNAi Molecule Platform (TRiMTM) для разработки лекарств на основе технологии RNAi. На ее создание ушло более 10 лет. Пока препаратов, прошедших полное одобрение FDA, в портфеле компании нет.
Препараты в разработке
В портфеле компании находится 16 препаратов на разных фазах исследований, 5 из которых на II фазе. 7 препаратов биотеха уже нашли поддержку со стороны Big Farma — Janssen Pharmaceuticals (Johnson & Johnson), Amgen, Takeda.
Ведущим кандидатом на одобрение является терапевтический препарат ARO-AAT, разрабатываемый при поддержке Takeda. В настоящее время проходит II фазу испытаний. Нацелен на лечение редкого генетического заболевания печени, связанного с дефицитом антитрипсина альфа-1. Недавно был получен от FDA статус прорывной терапии.
Инвесторам стоит также обратить внимание, что компания начала доклиническую стадию испытания препарата для терапии от Covid-19 ARO-COV.
Подводя итог, можно сказать, что благодаря платформе биотеху с относительно небольшой капитализацией удается разрабатывать немалое количество препаратов. При этом почти все из тех, что находятся на II стадии, разрабатываются при поддержке крупных корпораций.
Перспективы и риски
В целом риски биотехнологических компаний хорошо известны — остановка испытаний, неполучение одобрения от FDA, выпуск более эффективных препаратов конкурентами и т.д. В случае с Arrowhead, на мой взгляд, пока сохраняется риск способности получать полное одобрение от FDA препаратов, созданных на основе Targeted RNAi Molecule Platform, но партнерство с крупными корпорациями обнадеживает.
Говоря о перспективах, вполне допускаю, что менеджмент Johnson & Johnson, в случае успеха, может рассмотреть вариант приобретения Arrowhead Pharmaceuticals, особенно после объявления об разделении компании. Недавно один из конкурентов корпорации, датская Novo Nordisk, приобрела компанию Dicerna Pharmaceuticals, разрабатывающую лекарства также на основе технологии RNAi. Поглощение биотехов в области RNAi фармгигантами вполне может стать трендом.
Торговый план
Бумаги биотеха Arrowhead Pharmaceuticals рекомендую рассмотреть для покупки с текущих уровней с долгосрочным горизонтом инвестирования в технологию RNAi, при этом зарезервировав часть капитала для дополнительных приобретений в случае коррекции широкого рынка акций.
При падении котировок в результате появления негативных новостей стоит внимательно рассмотреть ситуацию. Если негатив не будет связан с ключевыми направлениями деятельности биотеха, снижения можно рассматривать как возможность для наращивания позиций.
Инвестору необходимо учитывать, что покупка бумаг на данном этапе развития бизнеса компании является исключительно венчурной инвестицией. Риск потери большей части вложений высок, но соотношение риска/потенциальной прибыли считаю асимметричным в положительную сторону.
БКС Мир инвестиций
Последние новости
Рекомендованные новости
Нефтегазовый сектор — в лидерах роста
Рубль ждет вердикта ФРС на непростом внешнем фоне
Эксперимент. Портфели силы и слабости
Заседание Банка России. Прогнозы
Заседание ФРС. Рождественский Tapering не за горами
10 российских акций с самыми высокими дивидендами в 2022
Meta Platforms (Facebook): акционеры требует перемен. Что ждать инвесторам
Акции Beyond Meat отталкиваются от дна. Что происходит
Адрес для вопросов и предложений по сайту: bcs-express@bcs.ru
* Материалы, представленные в данном разделе, не являются индивидуальными инвестиционными рекомендациями. Финансовые инструменты либо операции, упомянутые в данном разделе, могут не подходить Вам, не соответствовать Вашему инвестиционному профилю, финансовому положению, опыту инвестиций, знаниям, инвестиционным целям, отношению к риску и доходности. Определение соответствия финансового инструмента либо операции инвестиционным целям, инвестиционному горизонту и толерантности к риску является задачей инвестора. ООО «Компания БКС» не несет ответственности за возможные убытки инвестора в случае совершения операций, либо инвестирования в финансовые инструменты, упомянутые в данном разделе.
Информация не может рассматриваться как публичная оферта, предложение или приглашение приобрести, или продать какие-либо ценные бумаги, иные финансовые инструменты, совершить с ними сделки. Информация не может рассматриваться в качестве гарантий или обещаний в будущем доходности вложений, уровня риска, размера издержек, безубыточности инвестиций. Результат инвестирования в прошлом не определяет дохода в будущем. Не является рекламой ценных бумаг. Перед принятием инвестиционного решения Инвестору необходимо самостоятельно оценить экономические риски и выгоды, налоговые, юридические, бухгалтерские последствия заключения сделки, свою готовность и возможность принять такие риски. Клиент также несет расходы на оплату брокерских и депозитарных услуг, подачи поручений по телефону, иные расходы, подлежащие оплате клиентом. Полный список тарифов ООО «Компания БКС» приведен в приложении № 11 к Регламенту оказания услуг на рынке ценных бумаг ООО «Компания БКС». Перед совершением сделок вам также необходимо ознакомиться с: уведомлением о рисках, связанных с осуществлением операций на рынке ценных бумаг; информацией о рисках клиента, связанных с совершением сделок с неполным покрытием, возникновением непокрытых позиций, временно непокрытых позиций; заявлением, раскрывающим риски, связанные с проведением операций на рынке фьючерсных контрактов, форвардных контрактов и опционов; декларацией о рисках, связанных с приобретением иностранных ценных бумаг.
Приведенная информация и мнения составлены на основе публичных источников, которые признаны надежными, однако за достоверность предоставленной информации ООО «Компания БКС» ответственности не несёт. Приведенная информация и мнения формируются различными экспертами, в том числе независимыми, и мнение по одной и той же ситуации может кардинально различаться даже среди экспертов БКС. Принимая во внимание вышесказанное, не следует полагаться исключительно на представленные материалы в ущерб проведению независимого анализа. ООО «Компания БКС» и её аффилированные лица и сотрудники не несут ответственности за использование данной информации, за прямой или косвенный ущерб, наступивший вследствие использования данной информации, а также за ее достоверность.
Что такое рнк интерференция
Механизм РНК-интерференции состоит в том, что присутствующая в клетке двухцепочечная РНК, которая часто представляет собой чужеродный геном РНК-вирусов, разрезается на короткие фрагменты ферментом Dicer. Одна из двух цепей РНК-фрагмента включается в белковый комплекс RISC (RNA-induced silencing complex) и взаимодействует с комплементарной вирусной мРНК, которая затем расщепляется RISC комплексом. В результате синтез белка, кодируемого данной мРНК, прекращается. Наряду с ответом на чужеродную РНК, клетки синтезируют собственные короткие интерферирующие РНК (short interfering RNA — siRNA) из так называемой микроРНК (miRNA). МикроРНК процессируются аналогично двухцепочечным РНК вирусов и подавляют синтез клеточных белков за счет деградации мРНК либо путем создания препятствий на мРНК для работы белок-синтезирующей молекулярной машины (рибосомы). Таким образом, микроРНК являются частью клеточной системы управления активностью генов.
За открытие РНК-интерференции американские исследователи Эндрю Файр и Крейг Мелло были удостоены Нобелевской премии по физиологии и медицине в 2006 г. На основе описанного ими механизма разработаны методы направленного подавления активности генов с помощью коротких синтетических РНК дуплексов. Такие дуплексы могут быть созданы против любой мРНК благодаря тому, что последовательность генома многих организмов, включая человека, уже известна. В настоящее время изучаются перспективы применения РНК-интерференции в медицине для лечения инфекционных, онкологических и других заболеваний.
Для доставки синтетичеких РНК дуплексов в клетки широко используются подходы на основе нанобиотехнологий. Среди них: липосомы, углеродные нанотрубки, самоорганизующиеся полимерные наночастицы на основе циклодекстрина и др. Поверхность этих наночастиц модифицируют антителами и др. и векторами для направленной доставки в раковые клетки, к очагам внутрисосудистого поражения и т. п.
Иллюстрации
Фрагмент Dicer разрезает двуцепочечную РНК. При этом образуются siRNA. Эти процесссированные РНК связываются с каталитически активными белками (нуклеазами, RISC). Комплекс RISC и siRNA специфически разрушает mRNA и предотвращает трансляцию.